转录组测序+IP-MS揭示糖尿病溃疡潜在治疗靶点
2022-04-14 来源:本站 点击次数:1663
近日,上海市皮肤病医院院长,上海市中医药研究院皮肤病研究所所长李斌教授团队在皮肤科顶刊JOURNAL OF INVESTIGATIVE DERMATOLOGY(IF:8.551/Q1)上发表了题为PD-L1 Triggered by Binding eIF3I Contributes to the Amelioration of Diabetes-Associated Wound Healing Defects by Regulating IRS4的研究论文,报道了糖尿病溃疡的潜在治疗靶点。该研究中的转录组测序及IP-MS由上海生物芯片有限公司(生物芯片上海国家工程研究中心)完成。
原文链接:https://www.jidonline.org/article/S0022-202X(21)01460-3/fulltext
研究内容
持续的慢性炎症和上皮化延迟会导致糖尿病溃疡(DUs)延迟愈合。PD-L1在愈合缺陷中具有抗炎和增殖活性的功能,但其在DU发病机制中的作用尚不清楚。在DU组织中发现PD-L1水平较低,外源性PD-L1在愈合过程中具有治疗作用,可以加速再上皮化,并减轻会导致伤口延迟闭合的长期炎症反应。研究利用转录组测序检测PD-L1的下游效应子,并利用免疫沉淀结合质谱(IP-MS)和免疫共沉淀筛选其相互作用的蛋白。在体内和体外对eIF3I-PD-L1-IRS4信号通路的生物学功能进行检测。最后,通过免疫组化验证了eIF3I、PD-L1和IRS4在人类临床样本DU组织中的表达水平。在机制上,PD-L1与eIF3I结合,通过下调IRS4促进皮肤糖尿病创面愈合。这些发现表明,eIF3I/PD-L1/IRS4信号通路有助于伤口愈合缺陷,可以作为DU中潜在的治疗靶点。
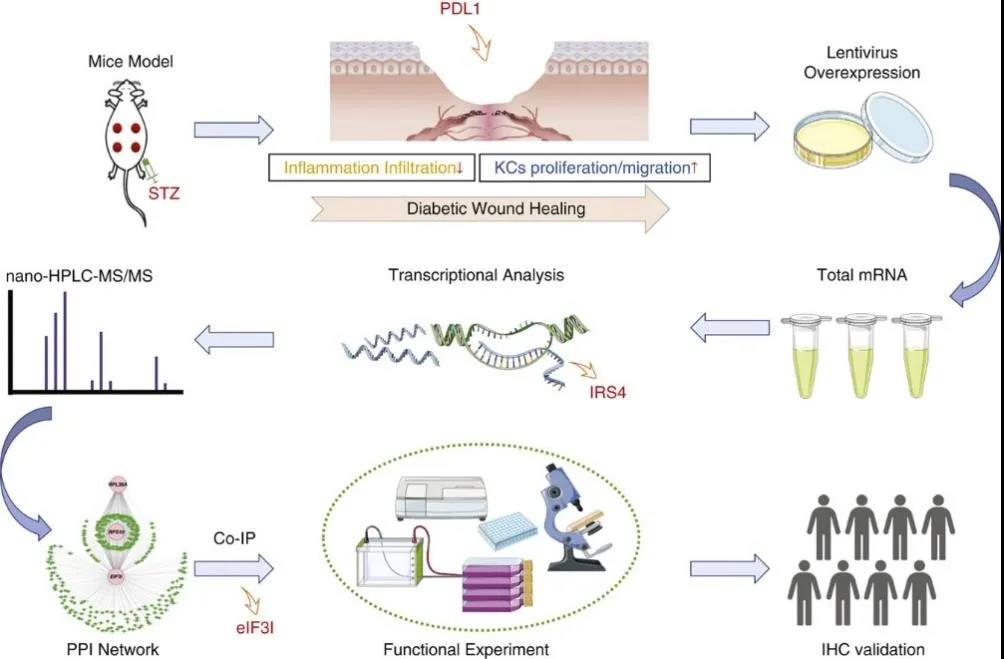
研究思路
1. PD-L1在体内对DU有治疗作用
研究者首先建立了小鼠糖尿病溃疡(DU)动物模型,以阐明表皮角质细胞中的PD-L1是否与伤口延迟愈合的发展有关系。通过比较DU创面中PD-L1的表达水平发现与正常创面相比,PD-L1在DU处明显下调,并在PD-L1蛋白处理后得到回复,提示PD-L1缺陷可能与DU愈合延迟有关。进一步实验表明PD-L1比重组牛碱性成纤维细胞生长因子(rb-bFGF)具有更高的创面愈合效率,且PD-L1可以使创面组织形成、炎症消退,这与rb-bFGF的治疗结局相似。在安全性上,对建立后第九天的DU模型检测肝肾功能未发现明显的安全性问题。这些结果表明外部施用PD-L1会导致上皮化加速和炎症缓解,DU的愈合障碍可能是因为内源性PD-L1缺乏所致。
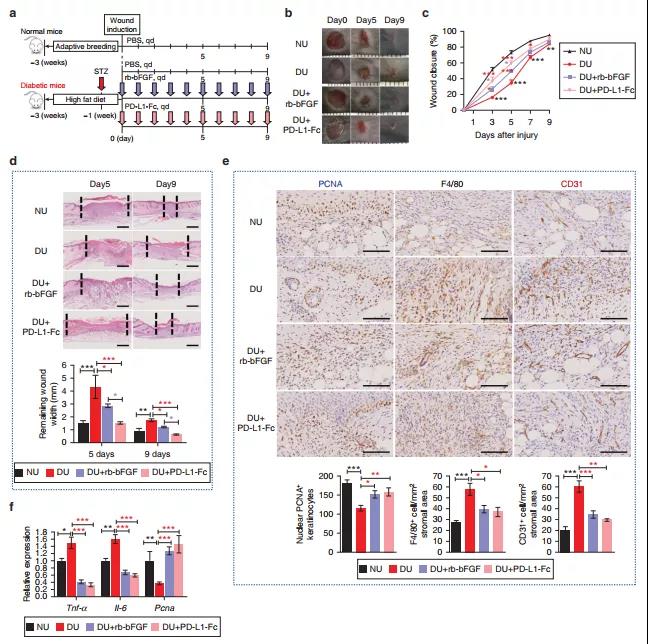
图1 PD-L1可改善DU缺陷、HaCaT细胞增殖/迁移和炎症反应
2. PD-L1促进HaCaT细胞增殖/迁移并减轻炎症
根据前人的研究已知PD-L1在靶向角质细胞的再上皮化过程中起作用,研究者使用PD-L1过表达的HaCaT细胞,发现上调PD-L1显著促进了细胞增殖、迁移,并显示了抗炎作用。无论是体内研究还是体外部分,PD-L1可通过减轻慢性炎症反应和促进角质细胞的增殖与迁移来改善DU创面愈合缺陷。
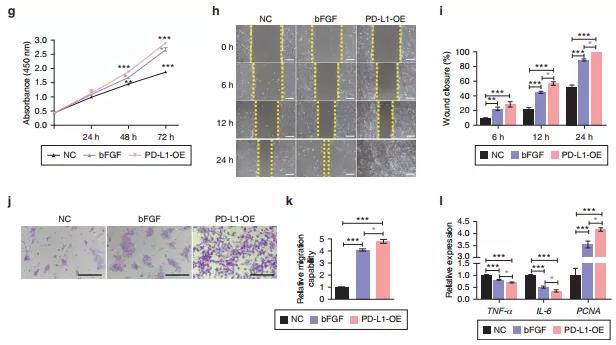
图2 PD-L1促进HaCaT细胞增殖/迁移,减少炎症
3. PD-L1的转录图谱--过表达HaCaT细胞
为了进一步确定PD-L1对伤口修复的影响,利用RNA测序检测了PD-L1过表达和正常HaCaT细胞的转录谱。结果表明PD-L1过表达和正常HaCaT细胞的mRNA表达状态存在很大差异,并且差异表达(DE)的mRNAs可能受PD-L1调节,从而改善伤口愈合。此外,进行了GO和KEGG通路富集分析(图2c和d)。结果表明,PD-L1在HaCaT细胞中的过表达上调了参与伤口愈合的DE mRNAs,有利于组织重建,并下调了与炎症机制与免疫反应相关的DE mRNAs。
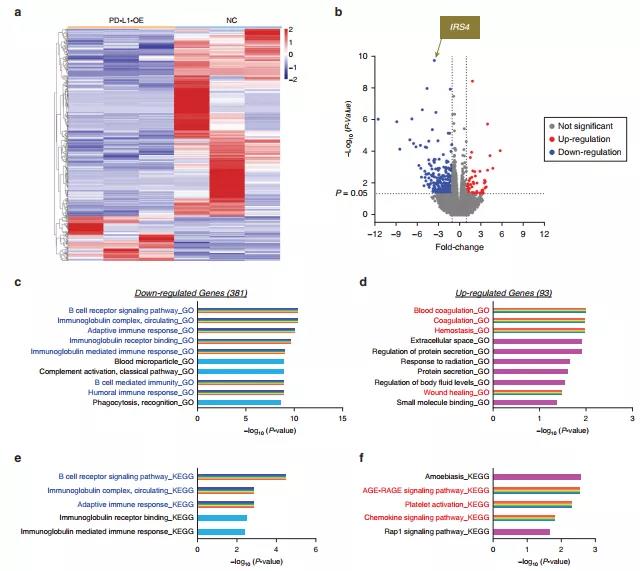
图3 PD-L1改变了HaCaT细胞的转录组特征
4. IRS4 是加重DU缺陷的PD-L1 下游效应器
从上述研究结果可知,IRS4是下调最显著的差异mRNA,接下来确定IRS4在正常创面、DU创面和PD-L1处理的DU创面中的表达情况。DU处检测到IRS4的高表达,并与DU创面中PD-L1的缺失相关。说明IRS4可能在DU恢复过程中起到抑制作用。为了进一步验证IRS4在HaCaT细胞中的生物学功能,使用针对人IRS4的小干扰RNA(small interfering RNAs,siRNAs)敲除IRS4,用过表达质粒上调IRS4。结果表明,IRS4的存在通过减少细胞增殖/迁移和增强炎症浸润,破坏了愈合重建的生物学过程。为了确定PD-L1与IRS4 的功能关系,采用针对人PD-L1的siRNAs 敲除PD-L1。IRS4在PD-L1敲除的细胞中表达较高,而在PD-L1过表达的细胞中IRS4表达降低。这些结果表明IRS4是PD-L1的下游效应器。此外,挽救实验验证发现IRS4过表达可以部分逆转PD-L1过表达介导的细胞增殖/迁移增加和炎症减弱。综上所述,PD-L1通过抑制IRS4的表达来改善细胞表型。
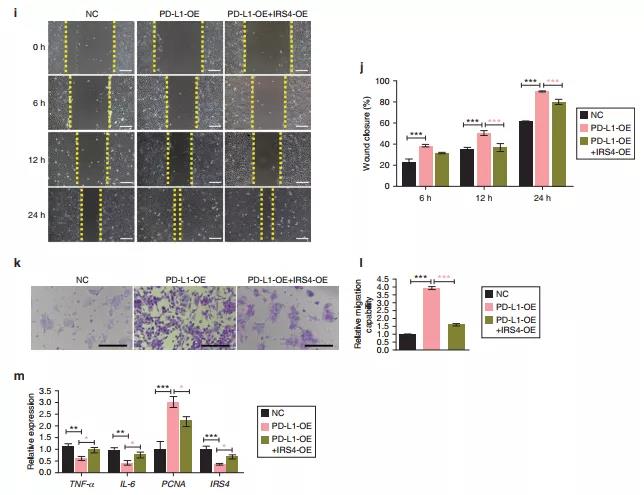
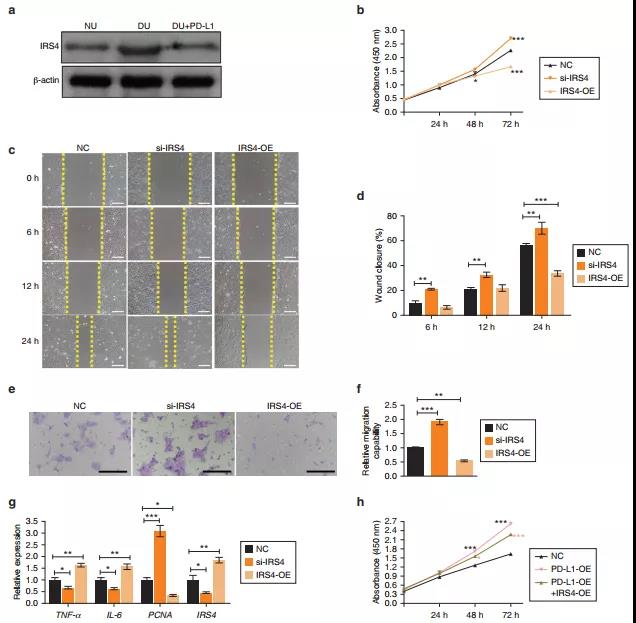
图4 IRS4活性受PD-L1直接或部分负向调控
5. eIF3I与PD-L1相互作用
为了识别与PD-L1相互作用的细胞蛋白,利用过表达PD-L1的细胞进行了免疫沉淀和质谱实验。质谱分析鉴定出107个特异性结合PD-L1的蛋白。此外,研究者采用生物信息学分析,应用蛋白质-蛋白质相互作用网络发现eIF3I可能在PD-L1引导的翻译调控中发挥核心作用。此外,作者通过免疫共沉淀试验验证了eIF3I和PD-L1之间的相互作用。
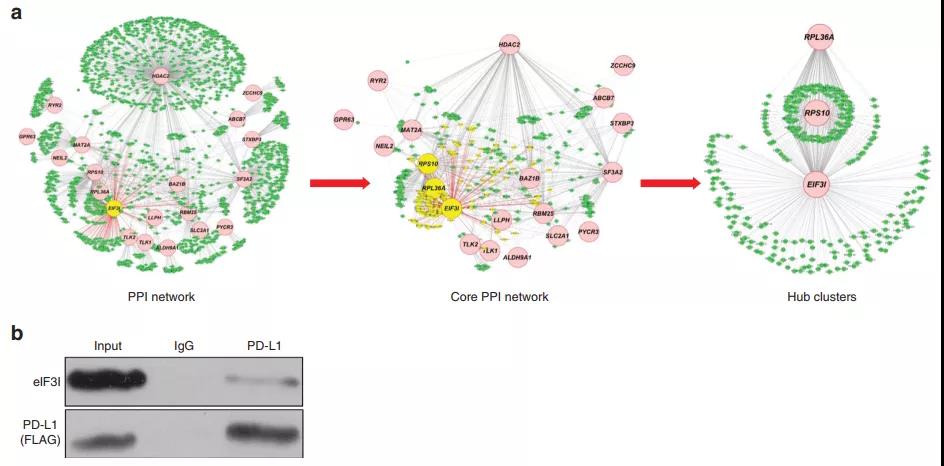
图5 EIF3I与PD-L1相互作用
6. eIF3I通过PD-L1/IRS4信号通路改变DU相关的疾病状态
研究发现eIF3I基因敲除可显著抑制细胞增殖/迁移,增加炎症浸润,而过表达eIF3I则显示相反的结果。这表明eIF3I对DU的愈合有积极的作用,并可能通过PD-L1介导的生物学过程发挥作用。
Western blot结果显示,eIF3I敲除可以降低PD-L1的表达水平,增加IRS4的表达水平,而过表达eIF3I则得到相反结论。进一步检测eIF3I调节PD-L1/IRS4信号通路的功能,发现eIF3I过表达挽救了依赖于PD-L1敲除的细胞增殖/迁移的减少和炎症的恶化。此外,IRS4的过表达部分抵消了eIF3I过表达和PD-L1敲除诱导的影响。综上所述,eIF3I至少部分地通过PD-L1/IRS4信号通路加速增殖/迁移并抵抗炎症。
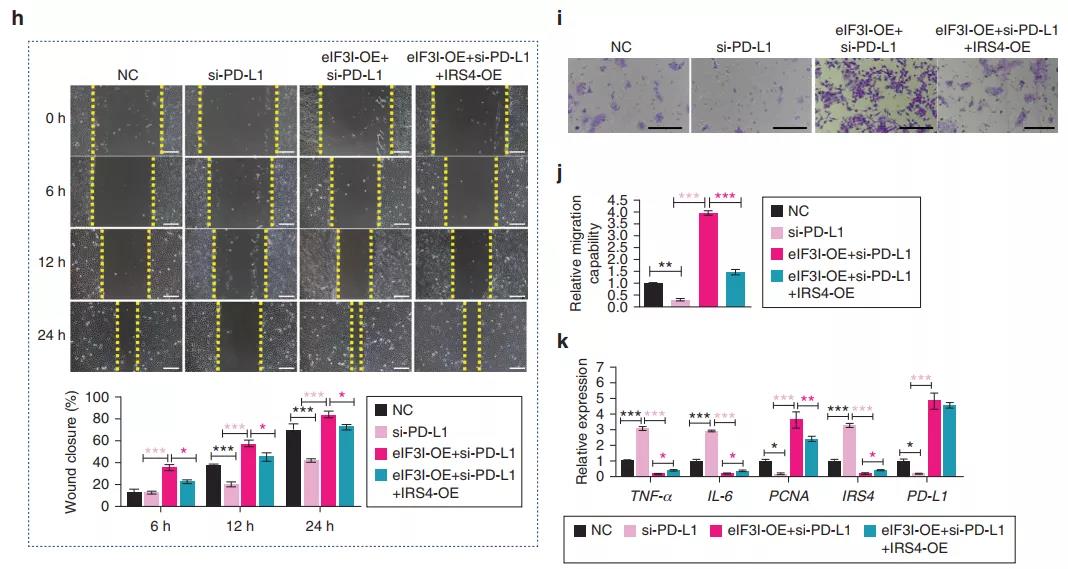
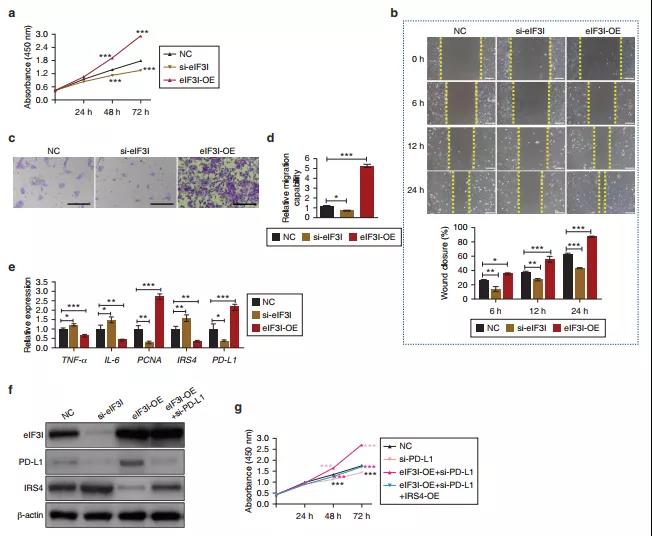
图6 EIF3I通过调节PD-L1/IRS4信号通路促进细胞增殖/迁移并减轻炎症
7. eIF3I、PD-L1和IRS4在人DU中的表达
为了验证eIF3I/PD-L1/IRS4信号通路在临床中的作用,使用糖尿病创面皮肤和正常皮肤样本研究eIF3I、PD-L1和IRS4的激活状态。在糖尿病伤口创面,炎症指标CD45+、MPO+和CD68+与正常皮肤组织相比明显增加。值得注意的是,与正常样本相比,糖尿病创面皮肤样品中eIF3I和PD-L1的细胞质染色下降,而IRS4染色在糖尿病创面中增加。临床样本结合体内外实验结果提示eIF3I/PD-L1/IRS4信号通路是治疗DU的潜在靶点。
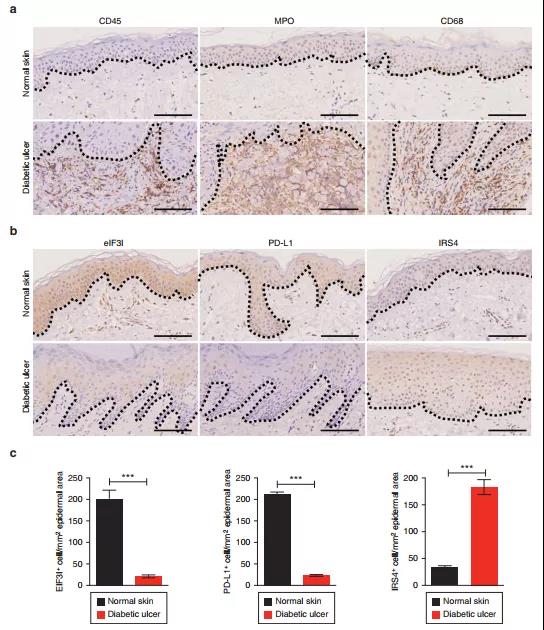
图7 糖尿病溃疡患者组织中eIF3I、PD-L1和IRS4的相关性
研究结论
研究综合转录组测序+IP-MS研究策略,发现eIF3I/PD-L1/IRS4信号通路有助于伤口愈合缺陷,可以作为DU中潜在的治疗靶点,为糖尿病溃疡延迟愈合的治疗带来新的希望。

