敲除 RASA2助力提高过继性 T 细胞持抗原敏感性和持久性
2023-01-04 来源:MedChemExpress 点击次数:1263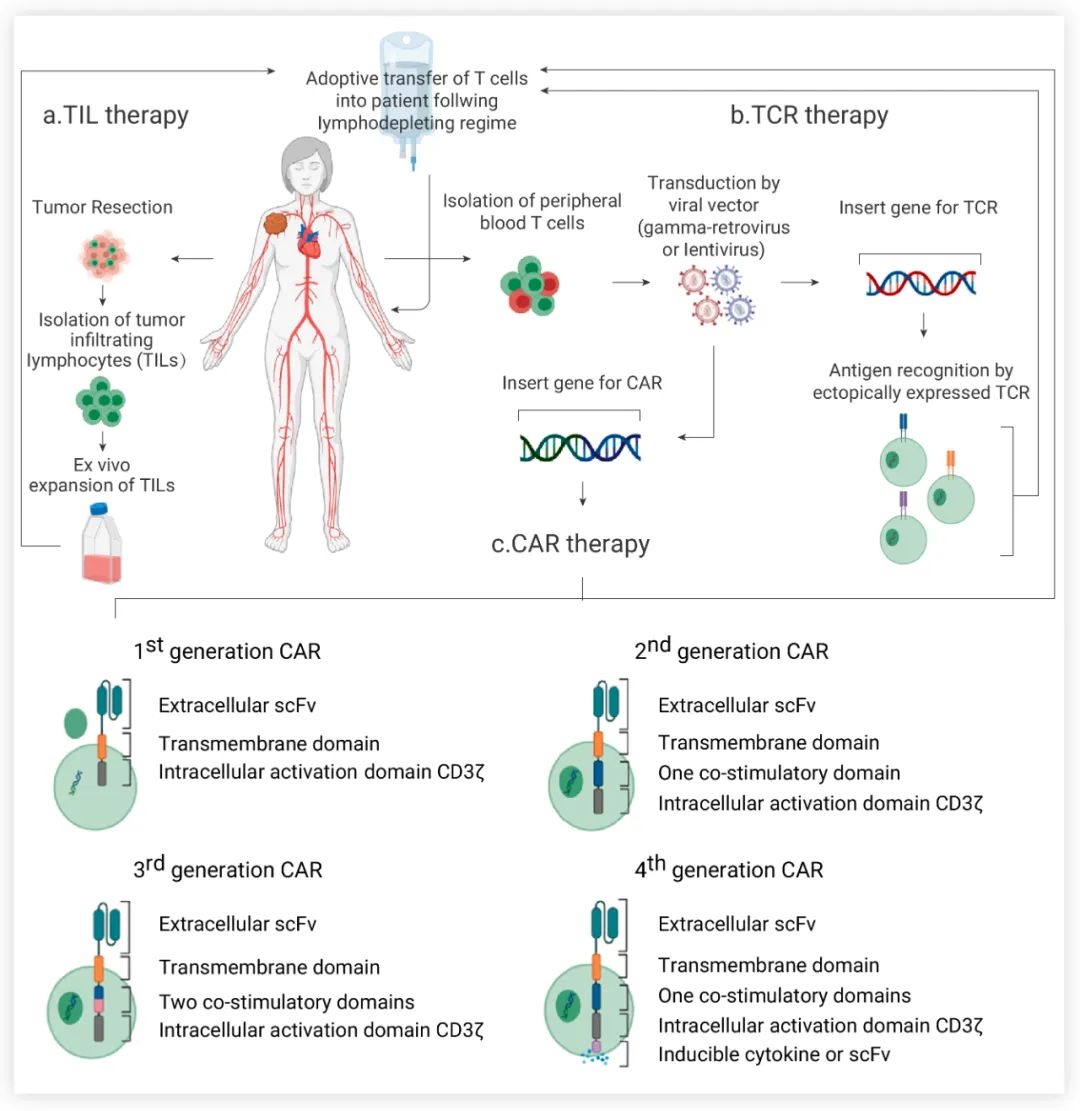
图 1. 过继性 T 细胞疗法[1]
a. TIL 疗法:切除肿瘤后,分离肿瘤反应性 T 细胞进行体外培养;b-c.TCR-T 与 CAR-T疗法:通过病毒载体对外周血 T 细胞进行基因修饰以表达特定的 TCR 或 CAR。在过继转移 TILs、TCR-T 或 CAR-T 细胞之前,患者先进行淋巴细胞衰竭预治疗,以创造过继细胞可生存的空间和内稳态环境。
目前,临床试验使用经过改造的 CAR 和 TCR 在复发或难治性血液系统恶性肿瘤患者中已产生了不错的治疗效果[2],但过继 T 细胞疗法依然有很大的改善空间。研究表明,过继 T 细胞治疗癌症的疗效可能受到来自外部因素和内在抑制检查点的抑制信号的限制[3],而靶向基因编辑有可能克服这些限制并增强 T 细胞治疗功能。
今年 8 月 Nature 发表了一篇题为 RASA2 ablation in T cells boosts antigen sensitivity and long-term function 的文章——该研究证明了敲除 T 细胞中的 RASA2 可以提高其抗原敏感性和持久性[4]。RASA2 是一种 RAS GTPase 激活蛋白 (RasGAP),是人类T细胞中的信号检查点,这项研究的发现意味着 RASA2 作为一个有希望的靶标基因将为 T 细胞治疗血液病和实体瘤适应症提供新的策略。下面我们就来看一下研究人员是如何开展这项研究的。
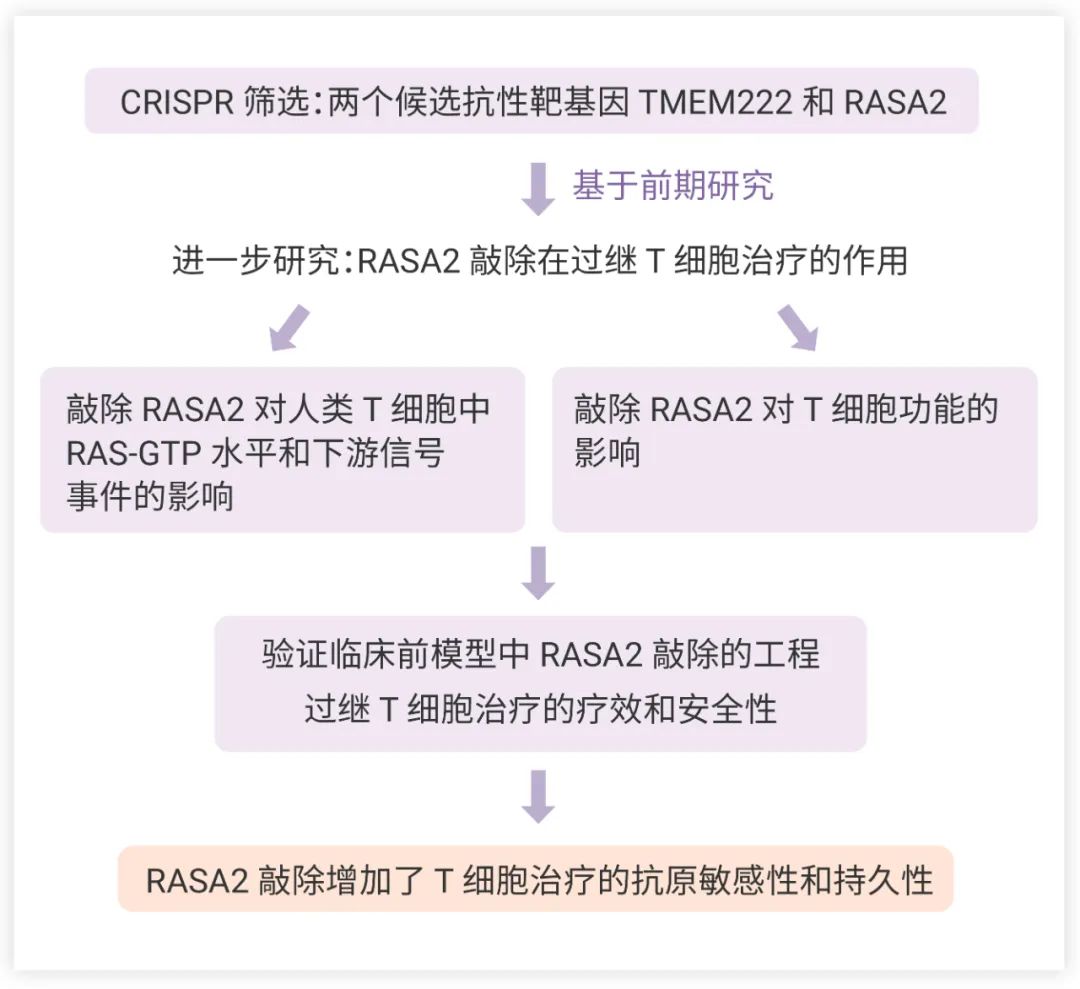 图 2. RASA2 ablation in T cells boosts antigen sensitivity and long-term function 文章思维导图
图 2. RASA2 ablation in T cells boosts antigen sensitivity and long-term function 文章思维导图
抑制性肿瘤微环境和 T 细胞内在检查点都会影响靶向实体瘤的工程 T 细胞的功效。为了识别 T 细胞中对内在和外在抑制条件具有抗性的调节因子,研究人员利用全基因组 CRISPR 敲除来筛选原代人 T 细胞 (图 3a)。他们使用来自多个独立供体的 T 细胞和在多种抑制条件下进行了分析,并在每一种分析条件下都用流式细胞技术分选鉴定了促进 T 细胞增殖的基因靶点。最后在高度分裂的 T 细胞中成功筛选出两个候选抗性靶基因:TMEM222 和 RASA2 (图 3b)。基于该团队前期的研究[5],研究人员选择进一步对 RASA2 敲除 (RASA2 Knock-out, RASA2-KO) 在过继 T 细胞治疗的作用进行了研究。
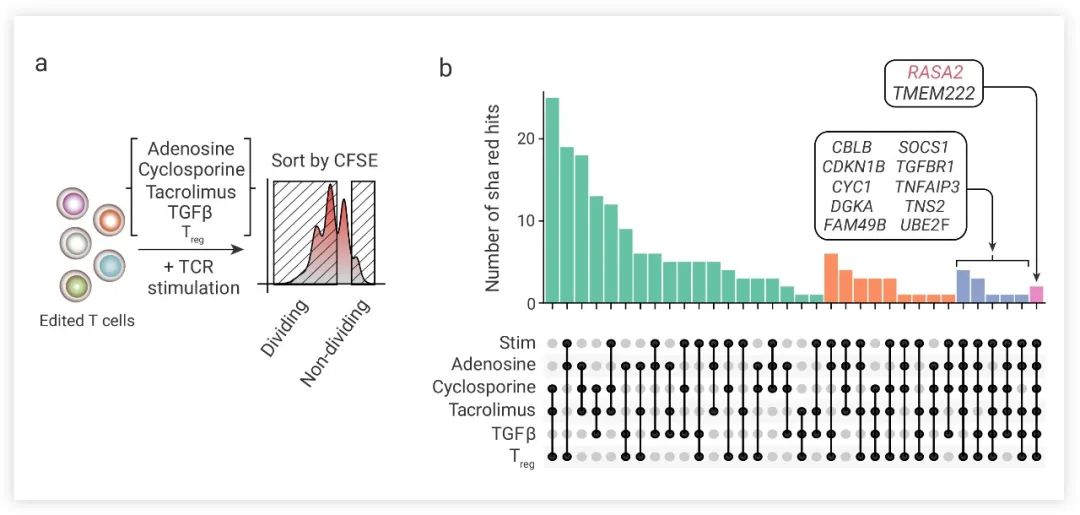
图 3. CRISPR 筛选确定 RASA2 为免疫抑制抵抗的调节剂[4]
a. 人类 T 细胞中抗药基因靶点的全基因组筛选示意图;b. 与非分裂细胞相比,高分裂细胞在所有筛选中共有的基因命中分析集中在两个候选抗性目标基因,TMEM222 和 RASA2
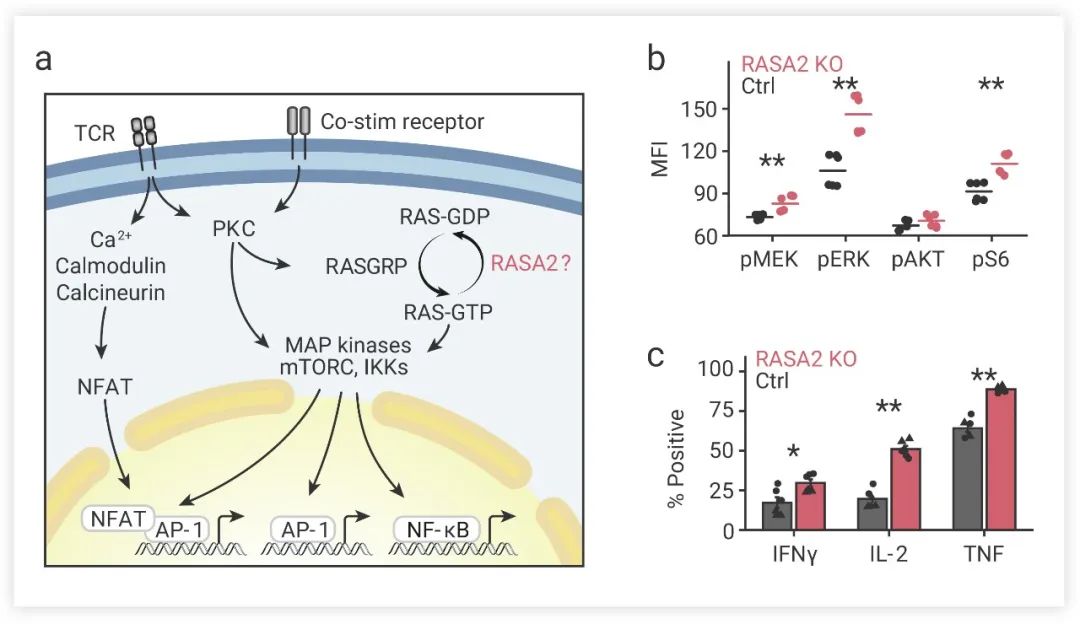
图 4. RASA2 敲除可以促进 T 细胞活化、提高抗原敏感性[4]
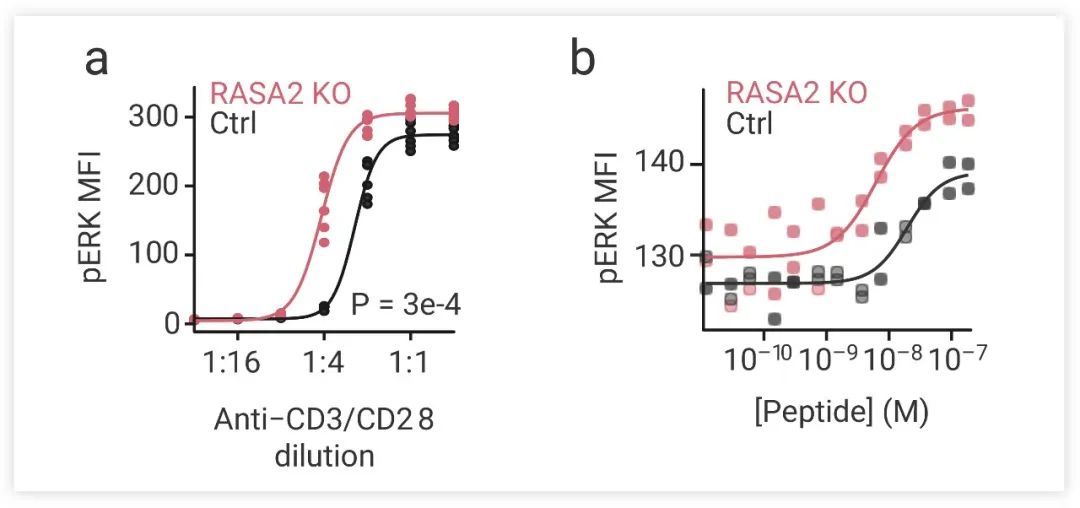
图 5. RASA2 敲除 (RASA2-KO) T 细胞的 ERK 磷酸化水平随抗 CD3/CD28 抗体浓度 (a) 和 NY-ESO-1 多肽浓度 (b) 增加,且比对照细胞水平更高 (MFI: mean fluorescent intensity,平均荧光强度)[4]
■ 增强 T 细胞对癌细胞的杀伤力
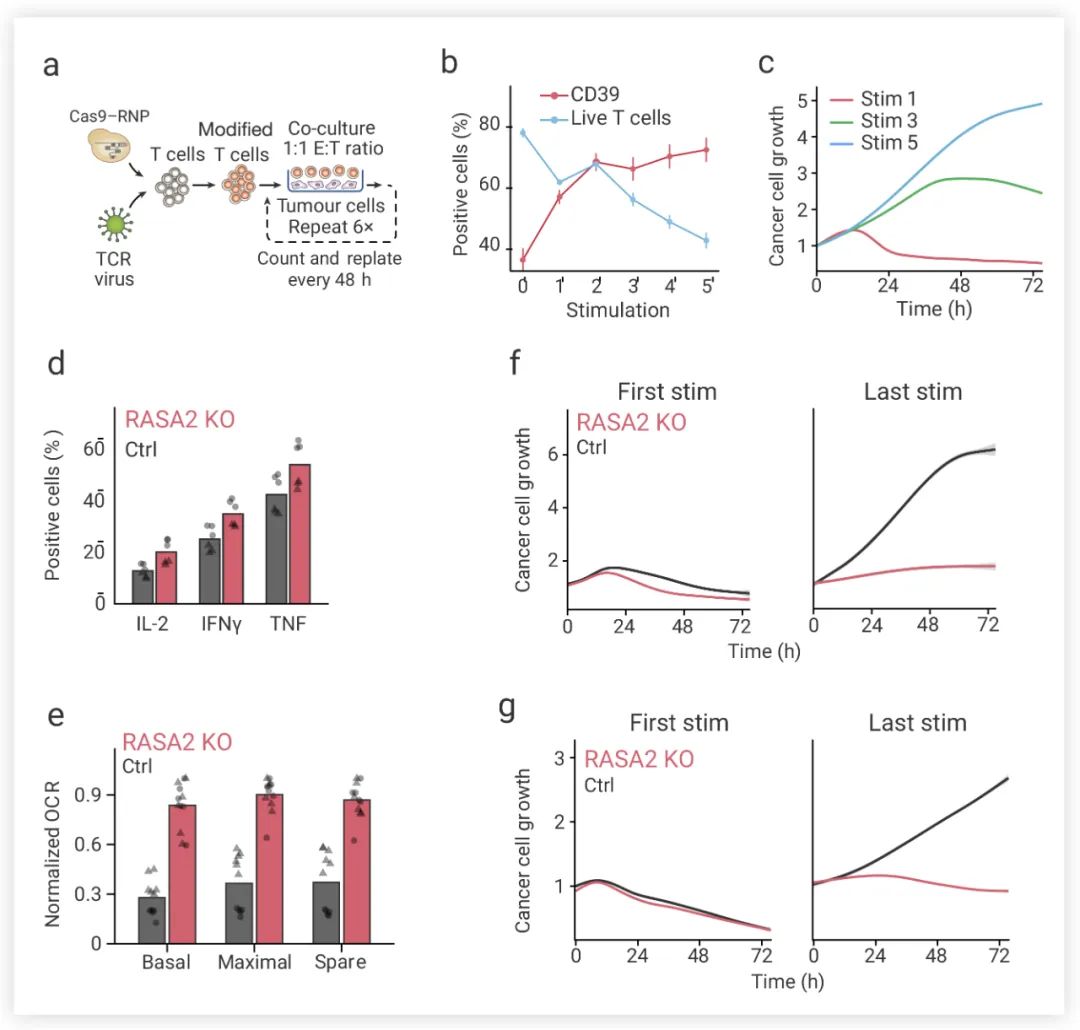
为了测试 RASA2 的敲除是否会改善慢性抗原暴露诱导的 T 细胞功能障碍,研究者们建立了一种重复刺激试验——将抗原特异性 T 细胞与新鲜靶肿瘤细胞以 1:1 的效靶比 (E:T) 进行共培养,每 48 小时重复一次 (图 6a)。在重复刺激下,抗原特异性 T 细胞相对富集 (CD39 比例逐渐升高),T 细胞活力和活化水平下降 (图 6b),代谢谱的改变以及关键细胞表型标记物的渐进性变化,与功能失调的T细胞状态一致。T 细胞暴露次数越多,控制癌细胞扩张的能力越弱 (图 6c)。 而 RASA2 敲除能够缓解 T 细胞的活力下降。与对照组 T 细胞相比,重复刺激后 RASA2 敲除 T 细胞会表现出更高水平磷酸化 MAPK 信号、激活和多重效应细胞因子 (图 6d);实时细胞代谢分析显示,重复刺激后,与对照组T细胞相比,RASA2 敲除 T 细胞的基础耗氧率 (OCR) 高于对照组 T 细胞的基础耗氧率 (图 6e)。接下来研究人员测试反复接触肿瘤抗原是否会影响 RASA2 敲除 T 细胞的癌细胞杀伤能力。结果表明,与对照组 T 细胞相比, RASA2 敲除的 T 细胞在多次刺激后对癌细胞杀伤作用的优势更为显著,RASA2 的敲除可使 TCR-T 细胞和 CAR-T 细胞对这种功能失调状态产生抵抗力 (图 6f-g)。
图 6. 通过反复接触癌细胞,RASA2 敲除可以改善功能性 T 细胞的持久性[4]
a. T 细胞重复刺激实验示意图;b. 随刺激次数增加,T 细胞活力下降;c. 在第 1、3、5 次对 T 细胞刺激后,癌细胞生长随时间逐渐失控;d. RASA2-KO T 细胞的细胞因子 IL-2、IFNγ、TNF 水平升高;e. RASA2-KO T 细胞的 OCR 高于对照组T细胞的基础耗氧率;f-g. 在第一次和最后一次次刺激 RASA-KO T 细胞仍能有效抑制癌细胞生长,对照细胞在最后一次刺激时无法控制癌细胞
■ 改善 T 细胞在动物模型的抗肿瘤效力
最后,研究人员在多个临床前模型中测试了 RASA2 的敲除是否会改善过继性T细胞治疗的性能。通过 TCR-T 细胞治疗的黑色素细胞瘤 A375 模型、TCR-T 细胞治疗的白血病 Nalm6 模型、CAR-T 细胞治疗的 Nalm6 模型以及 CAR-T 细胞治疗的腹膜内局部骨肉瘤 LM7 模型,证明了 RASA2 敲除可以提高肿瘤小鼠的存活率、延长肿瘤小鼠的存活时间。以上结果说明 RASA2 敲除可以改善 TCR-T 和 CAR-T 细胞对抗一系列液体和固体肿瘤的临床前模型的性能,突出了其在多种免疫治疗适应症方面的潜力。研究人员也评估了过继 T 细胞转移对小鼠健康的影响,与对照组相比,RASA2 敲除的T细胞小鼠的体重和组织病理并没有发生改变。敲除 CAR-T 细胞中的 RASA2 可以提高抗肿瘤疗效 (图7) 和生存率,且没有明显增加安全风险。
图 7. RASA2-KO 的 CAR-T 细胞比对照 T 细胞的在第 56 天抑瘤效果比较 (蓝圈中为肿瘤)[4]
|
相关产品 |
|
是一种超级激动剂抗 CD28 单克隆抗体,可直接刺激 T 细胞。 |
| Binetrakin是一种 T 淋巴细胞衍生的多效性细胞因子,可影响多种细胞类型,包括 B 细胞和 T 细胞。 |
|
可抑制 T 淋巴细胞信号转导和 IL-2 转录。具有强免疫抑制特性。 |
|
是一种免疫抑制剂,可抑制抗 CD3 /抗 CD28 单抗和脂多糖激活的小鼠脾细胞增殖。 |
|
是一种 T 细胞特异性表面糖蛋白 CD28 (TP44) 拮抗剂,通过靶向和减弱关键的 CD28/B7-2 共刺激通路来调节炎症反应。 |
|
Tyrosinase (192-200), human mouse 是一种多肽,可被 HLA-B44 分子上的细胞溶解 T 细胞 (CTL) 识别。可用于黑色素瘤相关癌症的研究。 |
参考文献
2. Fesnak AD, June CH, Levine BL. Engineered T cells: the promise and challenges of cancer immunotherapy. Nat Rev Cancer. 2016;16(9):566-581.
3. Anderson KG, et al. Obstacles Posed by the Tumor Microenvironment to T cell Activity: A Case for Synergistic Therapies. Cancer Cell. 2017 Mar 13;31(3):311-325.
4. Carnevale J, Shifrut E, et al. RASA2 ablation in T cells boosts antigen sensitivity and long-term function. Nature. 2022 Sep;609(7925):174-182.
5. Shifrut E, et al. Genome-wide CRISPR Screens in Primary Human T Cells Reveal Key Regulators of Immune Function. Cell. 2018 Dec 13;175(7):1958-1971.e15.