内质网自噬的发展历程和主要调控途径详细介绍
2023-12-25 来源: 点击次数:3386自噬 (Autophagh),既 “自己吃自己”,是细胞应对不良环境自发产生的一种保护机制 (根据细胞内容物进入溶酶体的不同方式,自噬可分为三大类:微自噬、分子伴侣介导的自噬 (CMA) 和巨自噬)[1]。自噬受一系列自噬相关基因 (ATG) 的调控,一般符合 “Cargo-ligand-receptor” 模式,主要分为 4 个过程:自噬的诱导,自噬体形成,自噬体与溶酶体的融合,完成自噬。
自噬可以是非选择性或选择性的,选择性自噬有目的吞噬不同底物:线粒体、过氧化物酶体、核糖体、内质网 (ER)、溶酶体、细胞核、蛋白酶体和脂滴 (LD) (图 1)[2]。
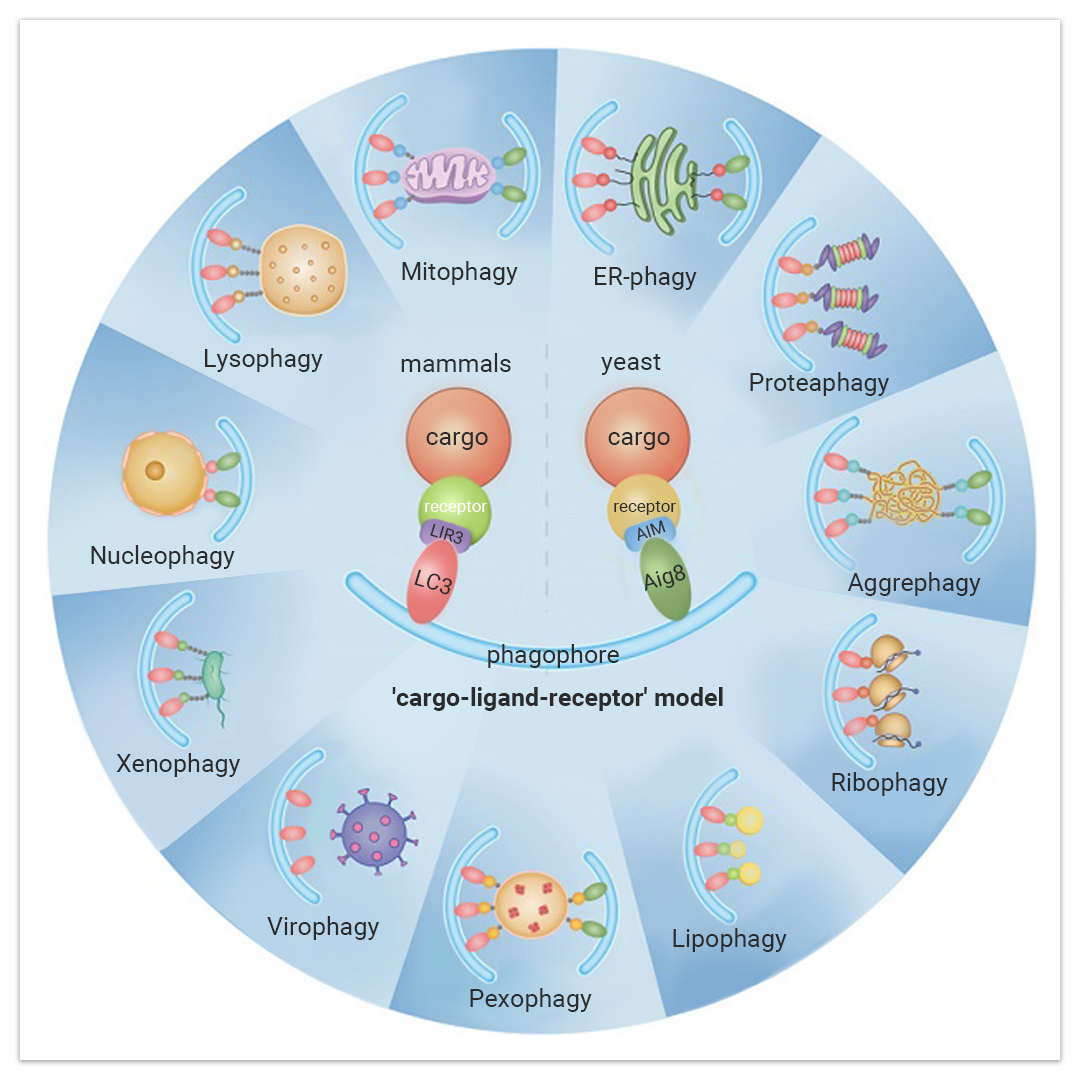
不同的选择性自噬方式:线粒体自噬 (Mitophagy)、核糖体自噬 (Ribophagy) 以及异源自噬(Xenophagy) 等。
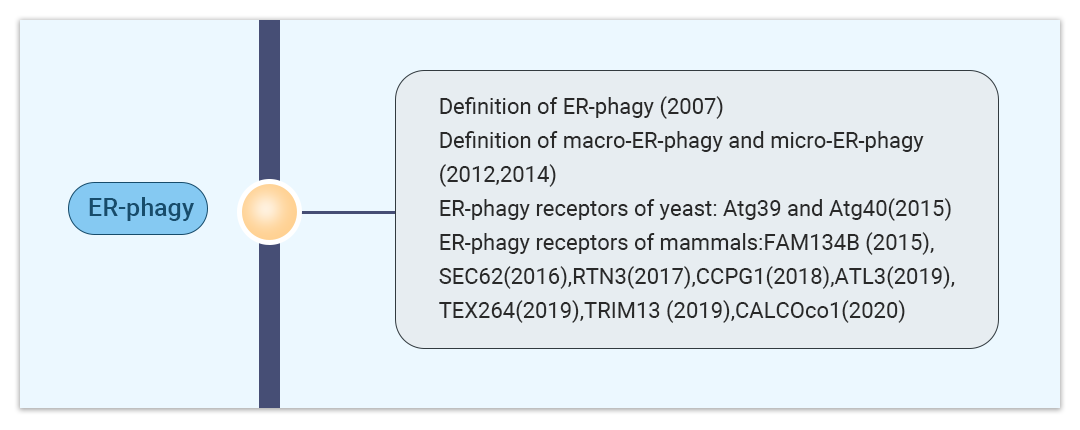
图 2. 内质网自噬的发展历程[2]
■ 内质网:维持细胞稳态的重要细胞器
作为一种重要的连续膜细胞器,内质网由一系列与核膜相连的扁平囊组成,其质量控制对维持细胞稳态中起着重要作用。当细胞暴露于不利的外部刺激 (基因突变、缺氧、营养缺乏和氧化应激等条件) 时,会诱导内质网应激 (Endoplasmic reticulumstress, ERS) 的发生,导致未折叠和错误折叠的蛋白质在内质网腔中积累,从而激活未折叠蛋白反应 (Unfolded protein response, UPR) 抵御不利的外部环境[4]。 内质网的质量控制主要有两条途径介导:泛素-蛋白酶体系统 (该系统为“ER 相关蛋白降解” (ERAD) 途径)和自噬-溶酶体系统。
内质网的质量控制主要有两条途径介导:泛素-蛋白酶体系统 (该系统为“ER 相关蛋白降解” (ERAD) 途径)和自噬-溶酶体系统。
ERAD 的底物仅限于蛋白质,而自噬-溶酶体系统能够降解蛋白的物质以及部分内质网。
 ER 应激诱导的自噬有两个主要功能:
ER 应激诱导的自噬有两个主要功能:
2. 当 ER 压力消失时,将扩大的 ER 大小减小到正常水平。
■ 内质网应激下自噬的主要调控途径
在 ERS 诱导的自噬过程中,UPR 通过相应的 IRE1α、PERK,ATF6 和 Ca2+ 调控自噬的发生,其中关键的调节因子是C/EBP同源蛋白 (CHOP)[3]。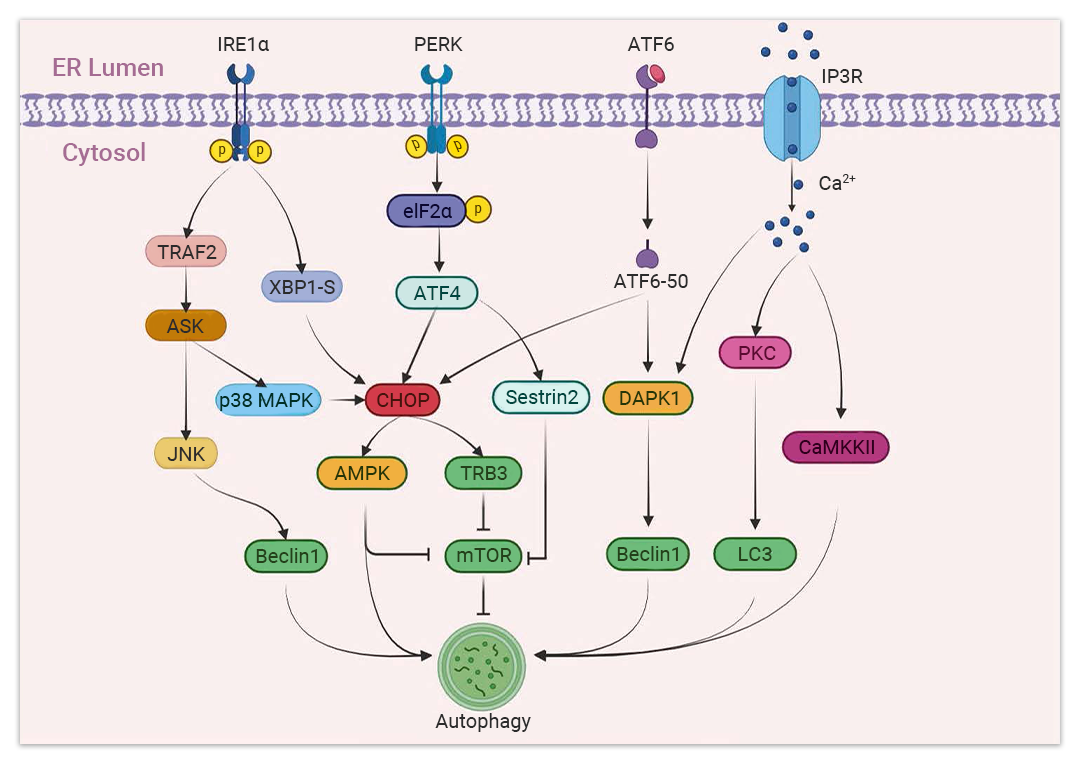
IRE1α:IRE1α通路中 TRAF2 被激活,进而下游细胞凋亡信号调节激酶 (ASK)/c-JNK 被激活,从而介导磷酸化 Bcl2,并破坏 Bcl2/Beclin1 间的相互作用,导致 Beclin1 的释放,从而增强基础自噬。IRE1α-TRAF2 通路还可以通过促进 ATG 复合物和 LC3 的形成来促进自噬体膜的延伸和扩展[5][6]。
PERK:UPR 的 PERK-eIF2α-ATF4 通路导致 Sestrin2 和 DDIT4 相关基因的表达,抑制 mTORC1 活性,并诱导自噬。ER 中 Ca2+ 的释放激活死亡相关蛋白激酶 1(DAPK1)、蛋白激酶 C (PKC)、钙/钙调蛋白依赖性蛋白激酶 II (CaMKII) 等相应因子参与调控自噬。
■ 内质网自噬发生的关键 “守门人”:自噬受体
这里不得不先说关键选手,自噬受体 (ER-Phagy adaptor),为了确保选择性自噬顺利发生,货物 (Cargos) 必须被自噬体膜上的蛋白质识别,ERA 可以通过自噬受体直接连接到内质网并降解过量的 ER。迄今为止,在哺乳动物和酵母中分别发现了FAM134B、RTN3L、CCPG1、SEC62、TEX264 和 ATL3 和 Atg39 和 Atg40 等自噬受体 (图 4)[6]。
以上自噬受体的都是 ER 膜蛋白,它们在结构、组织分布方面有所不同,可介导内质网不同区域的降解 (内质网由几个子结构域组成,如片内质网、管状内质网、核膜和内质网出口位点, 如 FAM134B 主要介导片内质网的降解,而 RTN3L 和 ATL3 介导管状内质网的降解)。
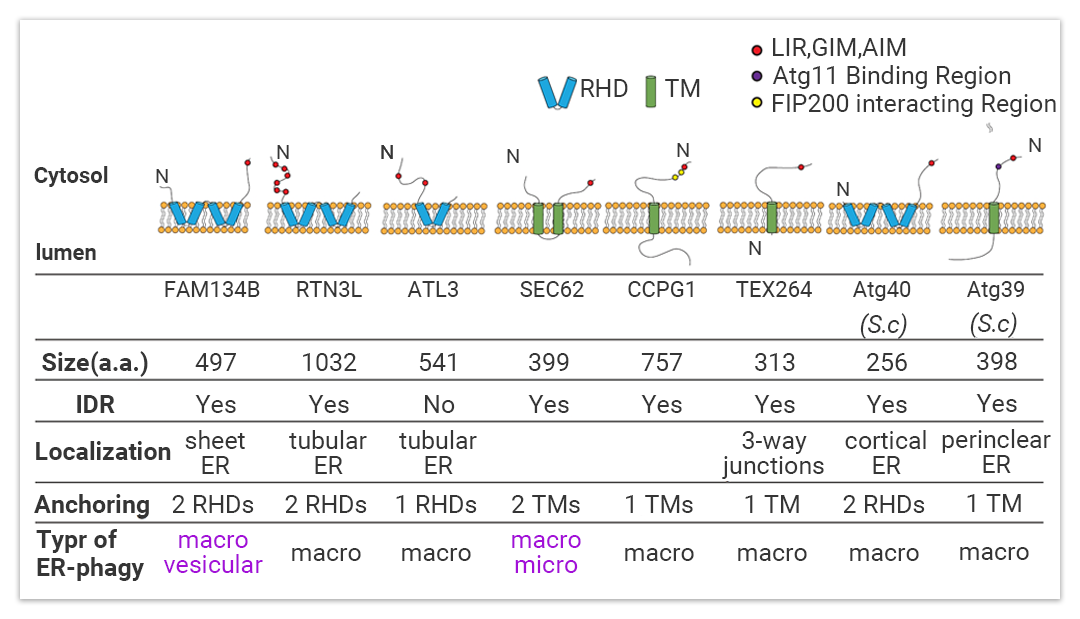
图 5. 不同的自噬受体[7]
这些受体它们都含有至少一个LC3/GABARAP 相互作用区 (LIR;LC3-interacting region) 或 Atg8 相互作用基序);可以结合哺乳动物的自噬体 LC3/GABARAP 家族蛋白或酵母的Atg8家族蛋白;或者可与最上游的自噬起始复合物组分 (如 Atg1/ULK1) 相互作用。■ 内质网自噬的三大途径
介绍完自噬的受体,就该介绍内质网自噬的途径了,依据内质网结构,分为以下 3 大途径:大 ER 自噬 (Macro-ER-phagy),微 ER 自噬 (Micro-ER-phagy) 和囊泡传递 (Vesicular delivery)。

图 5:内质网自噬的不同途径[8]
Macro-ER-phagy:在内质网应激的诱导下,内质网结构被破坏,需要降解的内质网成分被特定的内质网自噬受体识别 “标记”,并被 LC3/GABARAP/Atg8 识别,与 ER 连接的隔离膜组装并扩展为吞噬细胞,然后吞噬细胞包裹 ER 片段并密封形成自噬体。随后,自噬体与溶酶体融合形成哺乳动物细胞中的自噬溶酶体。最终,被自噬体吞噬的成分被溶酶体水解酶降解。
Micro-ER-phagy:微吞噬溶酶体膜内陷并“挤压”内质网进入溶酶体腔。此外,溶酶体可以直接与内质网衍生的囊泡融合进行降解 (“囊泡传递”)。
当然内质网自噬的形成是一个复杂的过程,内质网自噬的信号也可能会传递到线粒体或者其他细胞器,其常常伴随核糖体自噬和线粒体自噬一起发生或相互传递信号,共同在细胞中发挥作用;下面 Table 为不同自噬的关联情况。
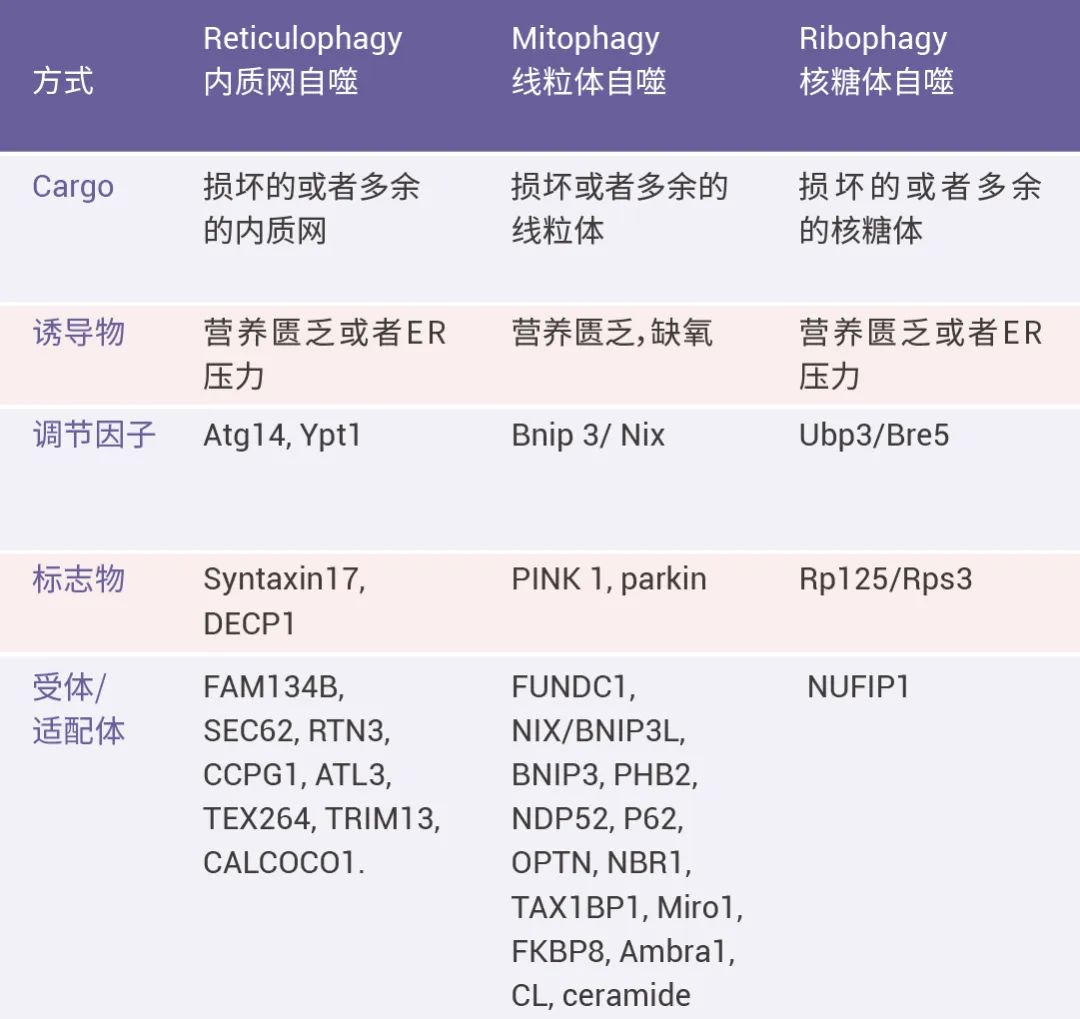
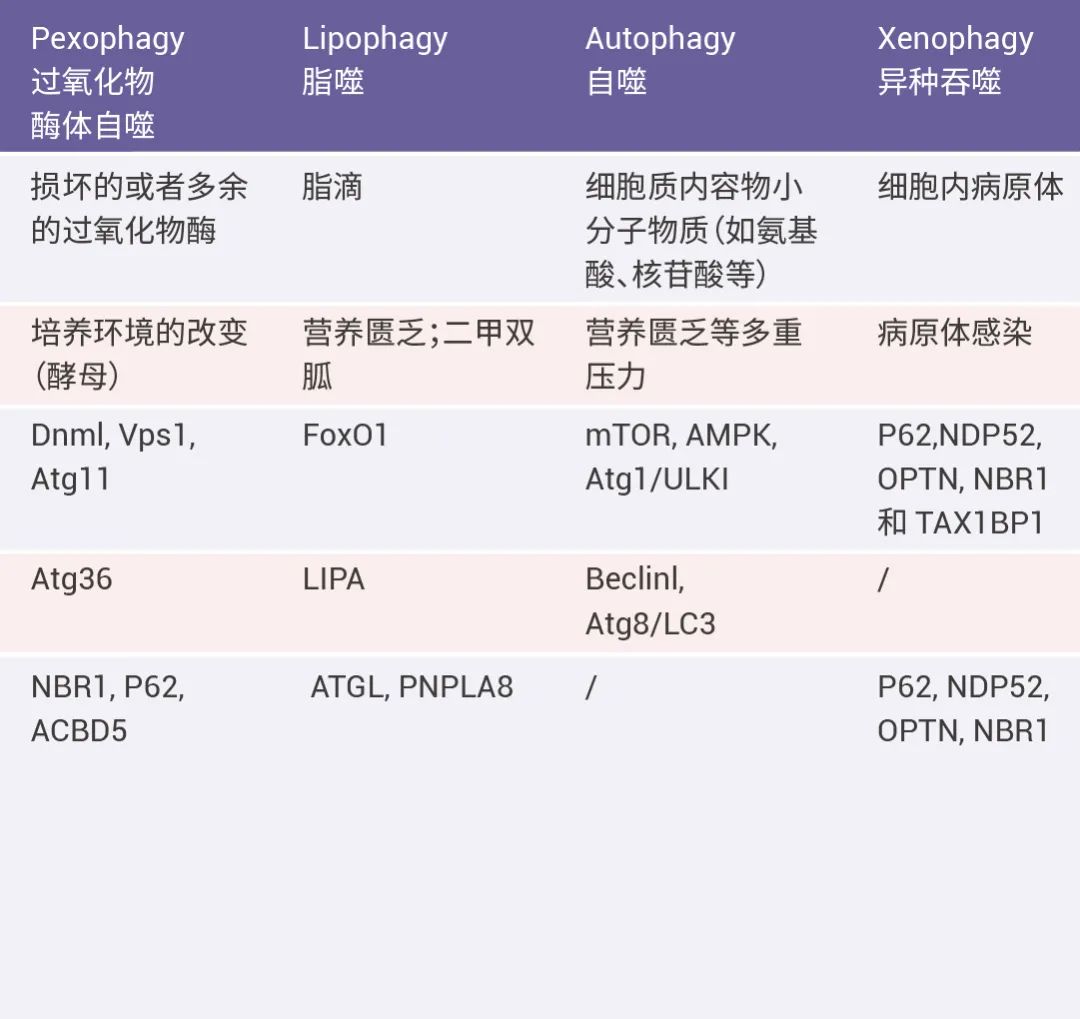
■ 小结
内质网,作为细胞重要的细胞器之一,其稳态改变会引发一系列细胞反应,小 M 今天给大家简要介绍了一种选择性自噬,ER 诱导的自噬,这种自噬方式清除细胞内受损的内质网或内质网片段,以帮助内质网的质量调控;还介绍了内质网自噬的诱导的相关信号通路,形成过程,以及与其他自噬的区别,希望对大家有所帮助!| 相关产品 |
| 4μ8C (IRE1 Inhibitor III) 是 IRE1α 的小分子抑制剂。 |
| APY29 一种特异性的 IRE1α 别构调节剂,通过结合到 ATP 结合口袋来抑制 IRE1α 的自主磷酸化,IC50 值为 280 nM。APY29 也可以变构激活 IRE1α 相邻 RNase 域。 |
| GSK2850163 GSK2850163 是一个新型的肌醇需要酶-1α (IRE1α) 抑制剂,它可抑制 IRE1α 的激酶活性和 RNA 酶活性,其 IC50 值分别为 20 和 200 nM。 |
| GSK2606414 GSK2606414 是可渗透细胞且有口服活性的蛋白激酶 R 样内质网 (ER) 激酶 (PERK) 抑制剂,IC50 值为 0.4 nM。 |
| MK-28 MK-28 是有效、选择性的 PERK 激动剂。MK-28 在小鼠中表现出良好的药代动力学特征,且能透过血脑屏障。 |
| 自噬化合物库 自噬参与多种生理和病理过程。细胞自噬调控异常会导致多种疾病的发生,包括感染、癌症、神经退行性疾病、衰老和心脏病等。MCE 提供 1245 种自噬信号通路相关的产品,是研究自噬相关调控及疾病的有用工具。 |
| 3-Methyladenine (3-MA) PI3K 的抑制剂。它通过抑制 class III PI3K 广泛作为自噬 (autophagy) 的抑制剂使用。 |
| Bafilomycin A1 大环内酯类抗生素, 是一种自噬 (autophagy) 晚期阶段抑制剂。Bafilomycin A1 阻断自噬体与溶酶体的融合,并抑制培养细胞溶酶体中的酸化和蛋白质降解。Bafilomycin A1 也诱导调亡 (apoptosis)。 |
参考文献
1. Evripidis Gavathiotis, Ana Maria Cuerv, et al. Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome. Cell2021 May 13;184(10):2696-2714.e25.
2. Wen Li, Pengcheng He, Yuge Huang, et al. Selective autophagy of intracellular organelles: recent research advances. Theranostics. 2021 Jan 1;11(1):222-256.
3.Sebastián Bernales, Sebastian Schuck, Peter Walter. ER-phagy: selective autophagy of the endoplasmic reticulum. Autophagy. 2007 May-Jun;3(3):285-7.
4.Khaminets, A, et al., Regulation of endoplasmic reticulum turnover by selective autophagy. Nature, 2015. 522(7556): p. 354
5.Jian Zhang, Jiafu Guo, et al. Endoplasmic reticulum stressmediated cell death in liver injury. Cell Death Dis. 2022 Dec 19;13(12):1051.
6.Mochida, K, et al., Receptor-mediated selective autophagy degrades the endoplasmic reticulum and the nucleus. Nature, 2015. 522(7556): p. 359-62.
7.Haruka Chino, et al. ER-Phagy: Quality Control and Turnover of Endoplasmic Reticulum. Trends Cell Biol. 2020 May;30(5):384-398.
8.Fulvio Reggiori, et al. ER-phagy: mechanisms, regulation, and diseases connected to the lysosomal clearance of the endoplasmic reticulum. Physiol Rev. 2022 Jul 1;102(3):1393-1448.
9. Yo-Hei Yamamoto, Takeshi Noda. Autophagosome formation in relation to the endoplasmic reticulum. J Biomed Sci. 2020 Oct 22;27(1):97.
10. Jose Norberto S Vargas, Maho Hamasaki, et al. The mechanisms and roles of selective autophagy in mammals. Nat Rev Mol Cell Biol. 2023 Mar;24(3):167-185.

