逍鹏新品速递:重组人白蛋白蓄势待发
2023-08-21 来源:本站 点击次数:2943
“最初,人血白蛋白(Human Serum Albumin, HSA)在战争生灵涂炭之时诞生并挽救无数生命。1940年,美国输血委员会批准白蛋白作为血浆替代物用于临床,此后广泛用于各种临床治疗。随着研究的深入,HSA多功能特性被逐一发现,让其在各生物领域大展拳脚,然而血液来源白蛋白引起的短缺和安全问题,让重组HSA(Recombinant Human Serum Albumin, rHSA)进入大家的视野……”
01.
HSA的基础知识
VivaCell
人血白蛋白(Human Serum Albumin, HSA)顾名思义是在人体血液中发现的血清白蛋白,是人体血浆中含量最多的蛋白质,约占血清蛋白的一半,约35-50g/L(3.5–5.0g/dL),具有维持血液渗透压、结合和转运各种分子、清除自由基、调节免疫反应和凝血等重要的代谢作用。
-
稳定性
pH 4-9范围内稳定,60℃的高温下耐受10小时。
-
结构
HSA的单多肽含有585个氨基酸,三维(Three dimensions)结构是一个具有三个同源结构域I, II, III的α-螺旋椭球,同源结构域间通过二硫键交联。白蛋白分子结构域内存在不同的药物结合位点,因此白蛋白具有较高的结合能力,可转运多种药物、脂肪酸、胆红素、离子(Na+、K+、Ca2+)和多种激素。
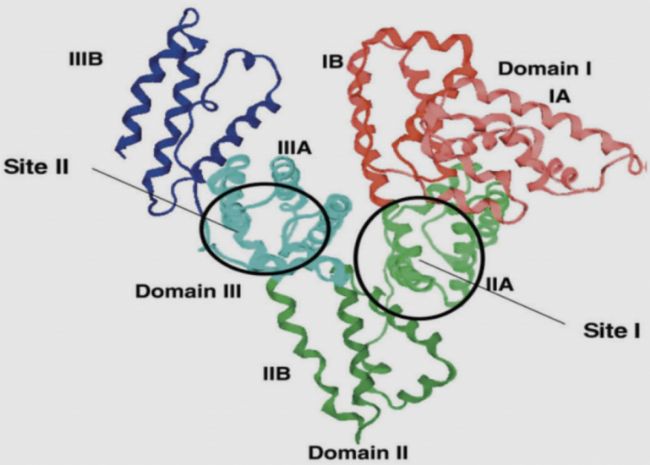
图1 HSA结构示意图
(引用自Chuang VTG, Otagiri M. Stereoselective binding of human serum albumin. Chirality. 2006; 18(3): 159–166. )
HSA作为研究最多的蛋白质之一,因其免疫原性低,容易获得且有良好的生物相容性,在生物学领域被广泛运用。
02.
HSA的主要来源
VivaCell
-
人血白蛋白
来源受限、成本高、存在批间差异和潜在动物源病毒污染的安全隐患。
-
重组人血白蛋白(Recombinant Human Serum Albumin,rHSA)
基于白蛋白多种特性,其在生物学领域应用颇多,白蛋白的需求量日益增加,人血白蛋白远远不能满足需求,这促使了对rHSA的开发和研究。
-
两种高效的重组表达系统:酵母和水稻
在过去的几十年里通过科学家们的尝试和努力,从多种表达系统中筛选出毕赤酵母和水稻两种高效的白蛋白表达系统。
水稻表达系统:重组蛋白特异性地在水稻胚乳细胞中表达,因水稻种植规模化简单,表达体系杂质少纯化成本低,安全性高也被广泛运用。
酵母表达系统:兼具原核和真核表达的优势,提供多种翻译后修饰,如蛋白水解加工、折叠和二硫键形成,避免不良的翻译后修饰,是生产具有工业或医学功能性应用重组蛋白的杰出宿主。
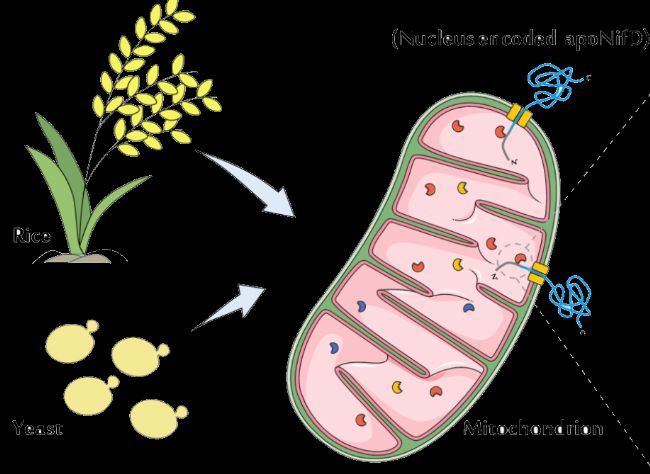
图2 两种重组白蛋白表达系统
(图源网络)
-
rHSA可替代性
研究表明rHSA与人血白蛋白有相同的结构和生理生化性质,其在细胞培养、药用辅料及临床方面的作用完全可替代人血白蛋白。重组人血白蛋白的替代试验表明,rHSA比人血白蛋白纯度高、质量稳定,安全性方面等或许还优于人血白蛋白。国内外一些企业已经或正在使用rHSA替代人血白蛋白作为药物辅料来提高其产品的安全性,增加市场竞争力。例如默克公司的麻腮风三联疫苗已经获得美国FDA批准上市,辅料使用重组人血白蛋白,产品上市多年,尚无相关不良反应的报道。
(图源网络)
03.
HSA在不同领域中的应用
VivaCell
临床用药:
HSA对于多种疾病的治疗具有重要的临床意义,包括低血容量、休克、手术失血、创伤、急性呼吸窘迫综合征、血液透析、急性肝衰竭、低蛋白血症、复苏等。
-
失血性休克复苏:在外科手术中,HSA可以减少液体需求,提高血浆胶体渗透压,减少肺水肿和肠道水肿等。
-
低蛋白血症:低白蛋白血症是危重病的常见并发症。静脉输注血清白蛋白可提高血浆胶体渗透压,促进胃肠道营养的吸收和利用,降低发病率。
-
慢性肝病:研究表明,肝硬化会伴随机体中有效HSA浓度降低,静脉注射HSA可以有效治疗失代偿性肝硬化病症。另外,HSA可以与血管加压药联合治疗肝肾综合征,提高治疗效果,降低复发率。
医疗器械涂层:
在临床应用中,多种医疗器械不可避免会与血液直接接触。非涂层医疗器械通常会将血浆蛋白(如纤维蛋白原)吸附在其表面,被吸附的蛋白进一步介导血小板聚集,形成血小板-纤维蛋白血栓,从而诱导炎症和凝血反应甚至威胁使用者的生命。
-
HSA特性及应用
HSA被证明具有抗血栓和抗腐蚀的特性,还能够提供抗氧化保护,防止内皮细胞凋亡。因此,HSA涂层也被应用于各种生物材料。研究表明,动脉血管假体材料涤纶用于动脉置换会容易引发血栓。将移植物涂覆交联白蛋白涂层后发现减少了凝血活化和纤维蛋白肽的形成,以及白细胞和血小板的粘附,涤纶的短期血液相容性有显著改善。
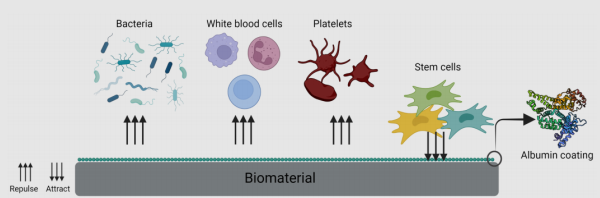
图3 生物材料表面的白蛋白涂层
(引用自BioRender.com)
-
目前的一些商业产品已经利用了白蛋白涂层,如灌注系统、导管和插管等。例如迈柯唯(Maquet)品牌下的 Bioline 和 Safeline 两个产品。以Bioline为例,通过共价键结合肝素和白蛋白的涂层可确保被涂层的PVC管道内部表面平整均匀,从而减少凝血活性、血栓形成和补体系统激活。
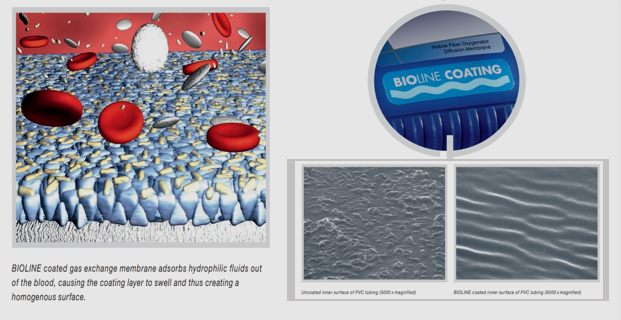
图4 Bioline涂层说明
(引用自Maquet.com)
药用辅料:
-
药物递送系统(Drug Delivery System,DDS)是指在空间、时间及剂量上全面调控药物在生物体内分布的技术体系。其目标是在恰当的时机将适量的药物递送到正确的位置,从而增加药物的利用效率,提高疗效,降低成本,减少毒副作用。
-
理想药物载体
HSA的多功能特性使其具有优异的药代动力学,如延长循环半衰期,增强疗效,降低毒性等,理所应当的成为药物和基因递送的理想载体。例如白蛋白紫杉醇(Paclitaxel For Injection Albumin Bound)——人血白蛋白作为紫杉醇助溶剂的一种药物,不仅自身的水溶性以及抗肿瘤作用都得到了进一步提升。研究表明,其作用机理可能是增加了紫杉醇在肿瘤细胞内的存在浓度,与白蛋白结合的紫杉醇可以通过快速交换细胞膜的脂质成分进入细胞。同时该药物还可以减轻对人体的毒性反应,使用前无需特意对患者进行脱敏处理,从而减轻患者的治疗负担。
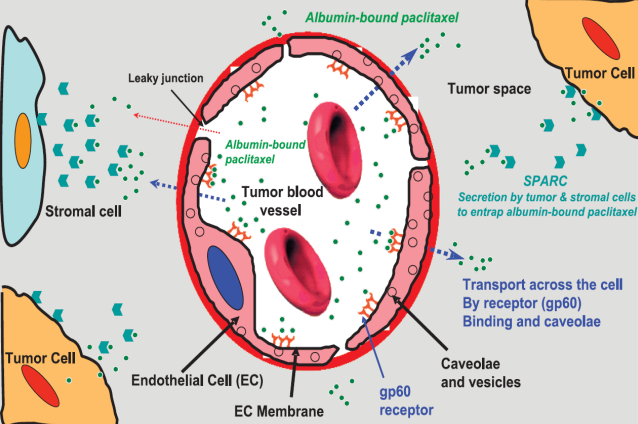
图5 紫杉醇白蛋白作用机理
(引用自Desai N, Trieu V, Damascelli B, Soon-Shiong P. SPARC expression correlates with tumor response to albumin-bound paclitaxel in head and neck cancer patients. Transl Oncol 2009;2:59-64.)
-
纳米技术对医学和生物学的最大影响之一就是在药物释放系统(DDS),制备纳米载体最常用的构建对象之一就是白蛋白。多种药物和带电分子都能与白蛋白结合,所以它们可以有效地结合到白蛋白纳米载体的基质中。白蛋白纳米载体已被证明是一种有效的药物载体,可提高抗癌药物的杀瘤活性。许多研究已经使用基于HSA的DDS来递送不同的抗癌药物,如阿霉素(DOX)。
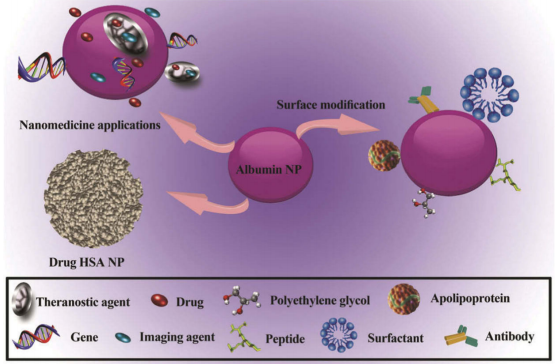
图6 白蛋白纳米多功能载体系统
(引用自Karimi M, Bahrami S, Ravari SBeal. Albumin nanostructures as advanced drug delivery systems. Expert Opin Drug Deliv. 2016 Nov;13(11):1609-1623. doi: 10.1080/17425247.2016.1193149. Epub 2016 Jun 3. PMID: 27216915; PMCID: PMC5063715)
-
疫苗稳定剂
研究表明,人血白蛋白能够提高疫苗冻干制品的稳定性,可以替代明胶作为药物的稳定剂。为了保障疫苗使用的安全性,无动物源的rHSA成为理想选择。美国药典已经明确rHSA的质量标准,为其生产应用提供指导,国内外一些企业已经或正在使用rHSA替代人血白蛋白作为药物辅料来提高其产品的安全性,增加市场竞争力。例如默克公司,使用rHSA作为辅料的麻腮风三联疫苗已经获得美国FDA批准上市,产品上市多年,无不良反应的报道。
细胞培养:
-
细胞培养基补充剂
HSA可提供对细胞生长很重要的氮和必需氨基酸,并有助于维持细胞培养环境中的PH和渗透压平衡。
-
多功能抗氧化剂
HSA具有多种配体结合能力和自由基捕获特性,因此具有特定的抗氧化功能。HSA可以结合脂肪酸并防止其发生氧化;铜与HSA结合后,将不会参与自由基相关的氧化还原反应;通过与半胱氨酸和谷胱甘肽结合形成蛋白质混合二硫化物,有助于防止这些分子被氧化并提高其细胞利用度;结合胆红素和吡哆醛-5’-磷酸盐并防止它们发生氧化。
HSA通常根据不同的细胞类型和培养应用采取不同的浓度添加到细胞培养基中。
04.
产品推荐
VivaCell
EastBuminTM重组人白蛋白,East意为东方,与酵母的英文Yeast发音相同,是VivaCell旗下又一位新成员。该产品作为国内酵母表达的重组人血白蛋白,采用新型规模化纯化工艺生产,GMP等级,无批间差、低内毒素、具有高安全性和优越的生物活性,适合多种类型细胞的生长,如间充质干细胞,胚胎干细胞,诱导多能干细胞和免疫细胞等。目前该产品已经进入临床三期试验,我们将为您提供最优质最安全的产品,为您的试验助一臂之力。
| 产品名称 | 产品货号 | 产品规格 |
|
|
C6520-0001 | 1g |
| C6520-0005 | 5g | |
| C6520-0100 | 100g |
参考文献
[1] Kuten Pella O, Hornyák I, Horváthy D, et al. Albumin as a Biomaterial and Therapeutic Agent in Regenerative Medicine. Int J Mol Sci. 2022 Sep 12;23(18): 10557.
[2] Karimi M, Bahrami S, Ravari SB,et al. Albumin nanostructures as advanced drug delivery systems. Expert Opin Drug Deliv. 2016 Nov; 13(11): 1609-1623.
[3] Rabbani G, Ahn SN. Structure, enzymatic activities, glycation and therapeutic potential of human serum albumin: A natural cargo. Int J Biol Macromol. 2019 Feb 15; 123: 979-990.
[4] Krajewski S, Neumann B, Kurz J, Perle N,et al. Preclinical evaluation of the thrombogenicity and endothelialization of bare metal and surface-coated neurovascular stents. AJNR Am J Neuroradiol. 2015 Jan; 36(1): 133-139.
[5] Mishra V, Heath RJ. Structural and Biochemical Features of Human Serum Albumin Essential for Eukaryotic Cell Culture. Int J Mol Sci. 2021 Aug 5; 22(16): 8411.
[6] Ohnishi K, Kawaguchi A, Nakajima S, et al. A comparative pharmacokinetic study of recombinant human serum albumin with plasma-derived human serum albumin in patients with liver cirrhosis. J Clin Pharmacol. 2008 Feb; 48(2): 203-208.
-END-


