荧光超分辨显微术浅析与活细胞超分辨成像新进展
2023-03-23 来源:本站 点击次数:3537
本文作者:钱佳铭博士
南京理工大学智能计算成像实验室
光学显微镜
光学显微镜(optical microscopy),顾名思义,是通过光学手段将人眼所不能分辨的微小物体放大成像,以供人们提取微细结构的光学仪器。如今,光学显微镜已发展成为许多基础研究和工程应用中的核心技术,广泛应用于生命科学、生物学、物理学、化学、材料科学、纳米技术、工业检测、医学等领域,为人类的发展做出了不可磨灭的重大贡献。早在三百多年前,人类就已经使用光学显微镜观察肉眼无法分辨的微观物体。1662年,英国物理学家罗伯特·胡克(Robert Hooke,1635—1703年)使用自制的显微镜观察软木切片,发现其在放大后呈现出类似修道院单人居室的微观结构,并以拉丁语“Cella”(“细胞”英文单词“Cell”的由来)命名这些结构,意为“小房间”或“小隔间”。这是人类历史上第一次观察到细胞。


图2 列文虎克制作的显微镜及记录手稿。(a) 列文虎克制作的显微镜,先存于乌得勒支大学博物馆。(b) 列文虎克绘制的细菌。(c) 列文虎克寄给英国皇家学会的书信之一

图3 不同时期的奥林巴斯显微镜。依次为1920年“旭号”显微镜、1927年“昭和号”显微镜、1980年“BH2”系列显微镜、1983年“AH2”系列显微镜、1993年“BX”系列显微镜、1996年“MX50”显微镜、“IX3”系列研究型倒置显微镜、IXplore spinSR超分辨共聚焦显微镜
超分辨荧光显微成像技术
1873年,德国物理学家恩斯特·阿贝(Ernst Karl Abbe,1840—1905年)提出了光学成像系统的衍射极限理论,指出光学显微镜的分辨率极限大约是可见光波长的一半(约200nm),这被称为“阿贝极限”1,2。该问题困扰着科学家长达一个世纪之久,这一时期光学显微镜的应用一直被限制在细胞水平而无法在亚细胞层面进行高分辨成像。

图4 2014年,诺贝尔化学奖授予Eric Betzig,Stefan W. Hell和William E. Moerner三位科学家,以表彰他们对超分辨率荧光显微成像技术的重大贡献
· 单分子定位的显微术
在基于单分子定位的超分辨显微成像技术中,PALM由2014年诺贝尔奖得主之一Betzig8提出,该技术基于荧光分子的光转化能力和单分子定位,通过用光控制每次仅有少量随机离散的单个荧光分子发光,并准确定位单个荧光分子点扩散函数的中心,最终利用多次曝光叠加成一幅超高分辨率图像(图5)。
由Hess9提出的荧光活化定位显微术(fluorescence photoactivation localization microscopy, fPALM)与PLAM原理相似,荧光团经探测器成像后,由光强控制荧光分子被可逆地灭活或不可逆地光漂白而从视场中消失。由Zhuang等10提出的STORM技术与PALM技术在原理上类似,其利用化学小分子Cy3和Cy5、Cy7等荧光分子对的光转换效应同样可以达到突破光学极限的效果。与PALM区别在于其所利用的探针是化学小分子而不是生物大分子。因此,STORM需要利用荧光发色团标记抗体对靶蛋白进行识别,可以检测到内源性蛋白,避免PALM中由于外源性表达偶联荧光蛋白的靶蛋白对其定位产生的可能的影响。2014年,三个小组分别报道了互补式可激活型荧光蛋白系统,在哺乳动物(PAGFP11和PAmCherry12)和大肠杆菌中(mEos3.213)实现了荧光互补和超高分辨率成像,对二聚化或相互作用蛋白的超高分辨率成像具有重要应用价值。基于单分子定位的超分辨显微成像技术可实现10~30nm的横向分辨率,但由于反复激活和淬灭荧光分子,所需时间长,其时间分辨率较低。
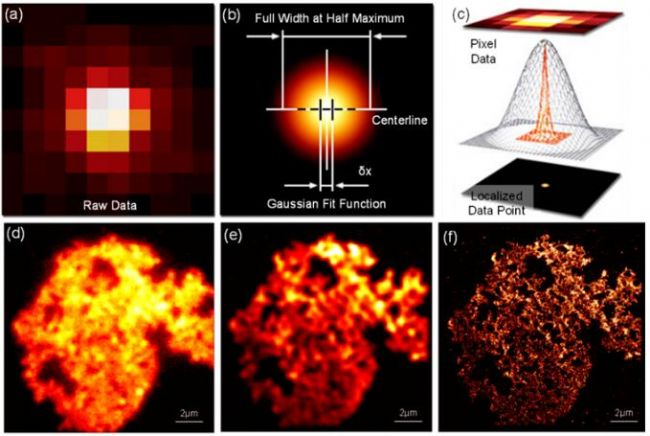 图5 PALM原理示意图与结果图。(a)-(c) PALM原理示意图,其中图(a)为探测的单个原始光子图像,图(b)对对图(a)的高斯拟合,图(c)为定位的图(a)的中心。(d) 聚苯乙烯微球的宽场图像。(e) 叠加原始PALM堆栈数据中单分子图像所获取的聚苯乙烯微球图像。(f) 聚苯乙烯微球的PALM超分辨图像
图5 PALM原理示意图与结果图。(a)-(c) PALM原理示意图,其中图(a)为探测的单个原始光子图像,图(b)对对图(a)的高斯拟合,图(c)为定位的图(a)的中心。(d) 聚苯乙烯微球的宽场图像。(e) 叠加原始PALM堆栈数据中单分子图像所获取的聚苯乙烯微球图像。(f) 聚苯乙烯微球的PALM超分辨图像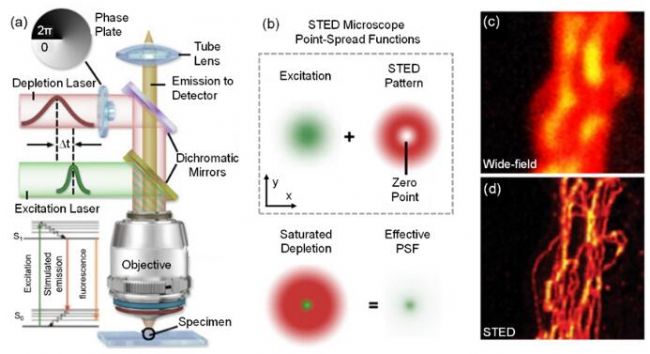
图6 STED的超分辨原理示意图和结果图16。(a) STED典型光学系统。(b) STED超分辨原理。(c) 微管宽场图
另一种典型的基于点扩散函数调制的超分辨技术是SIM技术。如前所述,成像系统的分辨率受到阿贝衍射极限的限制,存在接近波长一半尺度的衍射极限,物场信息中高于此光学传递函数截止频率的成分将会被滤除。针对这一问题,Gustafsson18于2000年提出了SIM技术,其基本原理是通过结构化照明在频域以空间混频的方式将物体高频信息载入光学系统的探测通带内实现突破阿贝衍射极限的超分辨光学显微成像。当利用周期性结构正弦照明光激发样品时,在频域上由于结构光频谱与物频谱的卷积而产生携带物体信息的多级频谱。其中±1级频谱将携带物体细节信息的高频部分平移至截止频率范围内而被探测,如图7所示。但这些高频信息与0级频谱的低频信息叠加在一起,需要后期数据处理(如相移、反卷积、参数估计等)将三级频谱分开才能有效获得样品的高频信息19。由于结构光条纹照射在样品上也受到系统衍射限制,因此等效截止频率最多可拓展一倍,即SIM的分辨率最多能在衍射极限基础上提高一倍,达到非相干衍射极限的2倍,约在100nm20。尽管SIM对横向分辨率的提升不如PALM、STORM、STED等技术,但其高的光子效率、较快的成像速度和全场成像等优点使得其非常适合进行活细胞的超分辨成像。值得注意的是,光栅衍射效应不仅仅限于±1级频谱,例如矩形光栅的频谱就要丰富得多,其还包括±2级、±3级等高阶频谱。
因此,假如能采用矩形光栅作为结构光,则可以产生多级频谱,使等效截止频率得到多次拓展从而大幅提高分辨率。但由于结构光的产生也受到光学系统有限孔径的限制,直接在物平面上形成一个周期接近衍射极限分辨率的矩形光栅并不现实。针对此问题,Gustafsson21在传统SIM的基础上进一步提出了饱和结构光照明显微技术(saturated SIM,SSIM),巧妙地利用荧光分子的饱和激发使样品在正弦光波激发下发出具有高阶频率分量的非正弦结构光,从而实现多级频谱拓展[如图7(b)],将分辨率提高到了约50nm的水平。然而饱和照明所需的高强度激光增加了SSIM的光毒性与光漂白,无法发挥SIM高光子效率、低光损伤的优势,使其难以运用于活细胞成像,因此并未得到广泛应用。

实时活细胞超分辨显微成像
近日,来自南京理工大学的陈钱、左超教授课题组提出一种高效、鲁棒的基于主成分分析的结构光照明显微技术(PCA-SIM),首次实现了在有外界干扰的复杂、低信噪比实验环境下对照明参数的快速自适应精准补偿和对活细胞精细结构的实时、高质量动态超分辨成像31。他们发现,理想无干扰条件下的结构光照明相量矩阵应是一个秩-1矩阵,其仅包括一个“主成分”,在最小二乘意义上描述了相量矩阵处于一个单一维度的“特征子空间”。然而,由于噪声、光学像差、样品非均匀调制度等干扰因素,通常情况下实验上所获得的相量矩阵会存在不规则的高维分量。如何消除这些高维干扰分量以获得对应理想照明相量矩阵中单一“主成分”,将是低信噪比条件下进行SIM准确参数估计的关键。
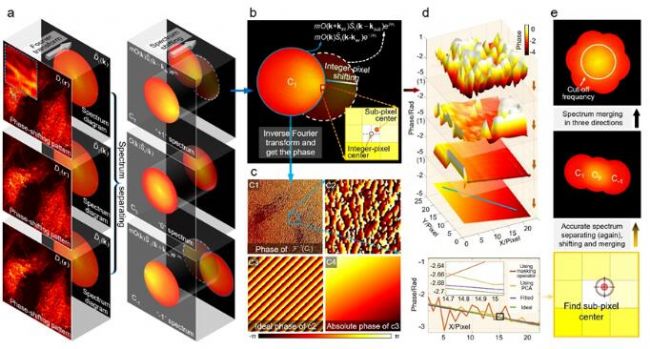
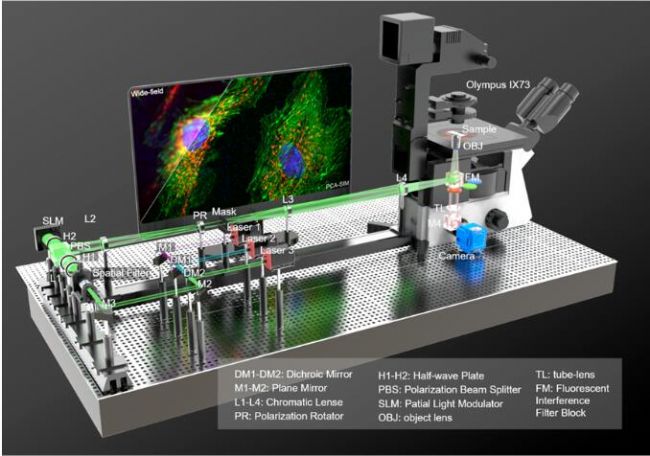
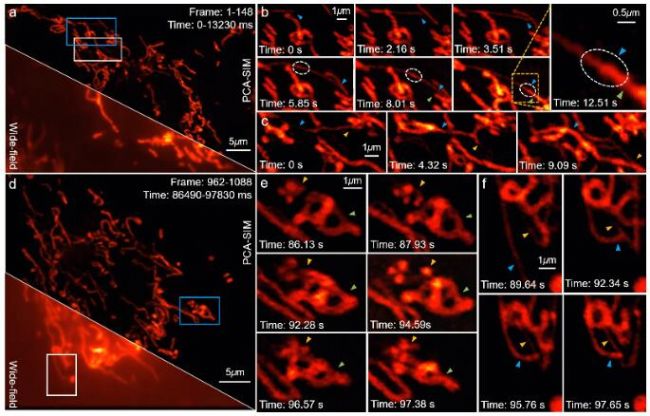
研究者基于PCA-SIM实现了对活体COS-7细胞线粒体的实时超分辨成像,依靠的平台是基于奥林巴斯IX73倒置荧光显微镜自主搭建的三色干涉式SIM超分辨仪器(图9)。图10给出了部分实时观测的活体COS-7细胞的线粒体动态小管事件(mitochondrial dynamic tubulation,MDT)。如图10(a)-10(b),细长且高度动态的MDT小管从线粒体中不断延伸,并与其他线粒体发生融合,形成了两个线粒体之前的膜桥。随后MDT小管逐渐增厚并趋于稳定,最终构成线粒体网络。这些实验现象对研究线粒体网络的形成以及线粒体功能(如线粒体DNA完整性、细胞凋亡等)的维持具有重要意义。PCA-SIM为研究活细胞中纳米尺度结构演化、细胞器互作和生物分子动力学信息提供了一种快速实时、灵活便捷、低光损伤的成像新手段,在生命科学、基础医学等领域具有广阔的应用前景。
产品介绍
【IX3系列研究级倒置显微镜】

IX3系列(IX53/73/83)作为能提供活细胞成像的高度可扩展的光学平台,其建立在雄厚的技术基础之上,拥有灵活的结构,容易利用的光路,提供高分辨,高反差的宽场图像。一切设计基于用户的心声,科学家的工作流程需要,广泛应用在细胞生物学,神经生物学,发育生物学,分子生物学,光生物学等领域,将成为科研工作者进行更高水平的活细胞研究的有力武器。

X Line(翼系列)平场二代超复消色差物镜(PlanXApo),在平场超复消色差(PlanSApo)物镜的技术基础上突破创新,在平场性、色差矫正和分辨率三项技术的层面兼收并举,同时囊括三项技术的尖端参数要求,满足高质量、大视场、高分辨率精确成像的要求,可以说,一枚物镜就可以让我们看得更多、更细、更美,也更自由。
Reference
1. 左超 & 陈钱. 分辨率, 超分辨率与空间带宽积拓展—从计算光学成像角度的一些思考. 中国光学 中英文 15, 1105–1166 (2022).
2. 左超, 陈钱, & others. 计算光学成像: 何来, 何处, 何去, 何从? 红外与激光工程 51, 20220110 (2022).
3. Westphal, V. et al. Video-rate far-field optical nanoscopy dissects synaptic vesicle movement. Science 320, 246–249 (2008).
4. Gustafsson, M. G. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198, 82–87 (2000).
5. Betzig, E. et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science 313, 1642–1645 (2006).
6. Rust, M. J., Bates, M. & Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat. Methods 3, 793–796 (2006).
7. Weiss, P. S. Nobel prizes for super-resolution imaging. (2014).
8. Betzig, E. et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science 313, 1642–1645 (2006).
9. Hess, S. T., Girirajan, T. P. & Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys. J. 91, 4258–4272 (2006).
10. Rust, M. J., Bates, M. & Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat. Methods 3, 793 (2006).
11. Xia, P. et al. Superresolution imaging reveals structural features of EB1 in microtubule plus-end tracking. Mol. Biol. Cell 25, 4166–4173 (2014).
12. Nickerson, A., Huang, T., Lin, L.-J. & Nan, X. Photoactivated localization microscopy with bimolecular fluorescence complementation (BiFC-PALM) for nanoscale imaging of protein-protein interactions in cells. PloS One 9, e100589 (2014).
13. Liu, Z. et al. Super-resolution imaging and tracking of protein–protein interactions in sub-diffraction cellular space. Nat. Commun. 5, 4443 (2014).
14. Hell, S. W. & Wichmann, J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt. Lett.19, 780–782 (1994).
15. Klar, T. A., Jakobs, S., Dyba, M., Egner, A. & Hell, S. W. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proc. Natl. Acad. Sci. 97, 8206–8210 (2000).
16. Hell, S. W. Far-field optical nanoscopy. science 316, 1153–1158 (2007).
17. Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R. & Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis.Nature 440, 935 (2006).
18. Gustafsson, M. G. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198, 82–87 (2000).
19. Eggeling, C., Willig, K. I., Sahl, S. J. & Hell, S. W. Lens-based fluorescence nanoscopy.Q. Rev. Biophys. 48, 178–243 (2015).
20. Kner, P., Chhun, B. B., Griffis, E. R., Winoto, L. & Gustafsson, M. G. Super-resolution video microscopy of live cells by structured illumination. Nat. Methods 6, 339 (2009).
21. Gustafsson, M. G. Nonlinear structured-illumination microscopy: wide-field fluorescence imaging with theoretically unlimited resolution. Proc. Natl. Acad. Sci. 102, 13081–13086 (2005).
22. Li, D. et al.Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science 349, aab3500–aab3500 (2015).
23. Li, D. et al.Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science 349, (2015).
24. Markwirth, A. et al. Video-rate multi-color structured illumination microscopy with simultaneous real-time reconstruction. Nat. Commun. 10, 1–11 (2019).
25. Wang, Z. et al. High-speed image reconstruction for optically sectioned, super-resolution structured illumination microscopy. Adv. Photonics 4, 026003 (2022).
26. Müller, M., Mönkemöller, V., Hennig, S., Hübner, W. & Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nat. Commun. 7, 1–6 (2016).
27. Huang, X. et al. Fast, long-term, super-resolution imaging with Hessian structured illumination microscopy. Nat. Biotechnol. 36, 451–459 (2018).
28. Shroff, S. A., Fienup, J. R. & Williams, D. R. Phase-shift estimation in sinusoidally illuminated images for lateral superresolution. J. Opt. Soc. Am. A 26, 413 (2009).
29. Wicker, K. Non-iterative determination of pattern phase in structured illumination microscopy using auto-correlations in Fourier space. Opt. Express 21, 24692 (2013).
30. Gustafsson, M. G. L. et al. Three-Dimensional Resolution Doubling in Wide-Field Fluorescence Microscopy by Structured Illumination. Biophys. J. 94, 4957–4970 (2008).
31. Qian, J. et al. Structured illumination microscopy based on principal component analysis. eLight 3, 4 (2023).

