原代细胞分离培养实验步骤及注意事项盘点
2025-04-03 来源:本站 点击次数:594
原代细胞(Primary cells)是指直接从机体取出的组织或细胞获得单个细胞并在体外进行培养的细胞。组织主要指组织器官、外周血及胚胎等。由于原代细胞生长缓慢,繁殖一定的代数停止生长(一般10代以内)。

一、各类组织的取材技术:
1、 皮肤和粘膜的取材
主要取自于手术过程中的皮片,方法似外科取断层皮片手术操作,但面积一般2~4平方厘米。
2、内脏和实体瘤的取材
内脏除消化道外基本是无菌的,但取材时要明确和熟悉所需组织的类型和部位,实体瘤取材时要取肿瘤细胞丰富的区域,要避开破溃、坏死液化部分,以防污染,尽量去除混杂的结缔组织。
3、血液细胞的取材
血细胞、淋巴细胞的取材,一般多抽取静脉外周血,或从淋巴组织中(如脾、扁桃体、胸腺、淋巴结等)分离细胞,取材时应注意抗凝。
4、 骨髓、羊水、胸/腹水细胞取材
严格无菌,注意抗凝,还要尽快分离培养,离心后,用无钙、镁PBS洗两次,再用培养液洗一次后即可培养,不宜低温存放。
5、动物组织取材
I、鼠胚组织取材
首先用引颈或气管窒息致死法处死孕期合适的动物,然后将其整个浸泡在含有75%酒精的烧杯中,5分钟后(注意时间不能太长,以避免酒精从口或其他通道进入体内,影响组织活力),取出动物,在消毒过的木板上可用无菌的图钉或大头针固定四肢,切开皮肤,用无菌操作法解剖取胚或用无菌止血钳挟起皮肤、用无菌眼科剪沿躯干中部环形剪开皮肤,用止血钳分别挟住两侧皮肤拉向头尾,把动物反包,暴露躯干,然后再固定,更换无菌解剖器材,采用无菌操作法解剖取出胚胎。
II、幼鼠胚肾(或肺)取材
幼鼠采用上述方法处死消毒后,腹部朝上固定在木板上,先切开游离毛皮并拉开至两侧:然后采用无菌法打开胸腔取肺,或背部朝上固定在木板上,先将背部毛皮切开游离并拉向两侧,然后采用无菌法从背部打开腹腔取肾。
6、鸡(鸭)鸟类胚胎组织取材步骤
1)、取孵化至适当胚龄(9~12天)的胚蛋,用照蛋灯在暗处灯检,若有丰富血管、胚体有运动的胚蛋,说明胚体发育良好,并用有色笔划出气室和胚体位置。
2)、将胚蛋置于蛋架上,先用温水清洗蛋壳,再用75%酒精棉球擦干;
经碘酒、75%酒精消毒后,在无菌条件下采用无菌法用剪刀或镊子打开气室,沿气室边缘去除蛋壳;
3)、用眼科镊撕去壳膜,暴露出鸡胚;
4)、用弯头镊轻挑起胚头,取出胚胎,放入无菌平皿中,解剖取材。
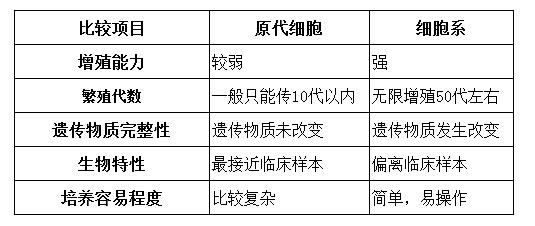
二、原代细胞与细胞系的区别
三、原代细胞分离培养
取材--分离--培养--鉴定
首先将组织从机体中取出,经胰蛋白酶/胶原酶处理后分散成单细胞,再在合适的培养基中培养,使细胞繁殖到一定系数后进行细胞鉴定。
四、实验步骤:
1.取7-10d雄性SD大鼠,颈椎脱臼处死,浸泡于75%乙醇消毒3-5min。
2.在超净工作台中,将大鼠断头置于玻璃培养皿中,打开颅腔后取出全脑,放在盛有预冷的PBS玻璃培养皿中,去除小脑和间脑。
3.将大脑半球在干滤纸上缓慢滚动以去除软脑膜和脑膜大血管,再放在新的盛有预冷的PBS玻璃培养皿中。
4.用细解剖镊去除大脑白质、残余大血管和软脑膜,保留大脑皮质。
5.大脑皮质放于DMEM中(含庆大霉素和谷氨酰胺 ),剪碎成约1mm3大小,放入50ml的离心管中,加入混合酶液I(0.05-0 .1%II型胶原酶,0 .025-0 .05%IV型胶原酶,200-400U DNaseI),混匀后37℃水浴消化1-1.5h。
6.室温1 000×g离心8min,去上清液。
7.沉淀中加入20%BSA重悬浮,充分混匀,1 000×g,20min,4℃离心,去上清。
8.沉淀加入4ml混合酶液II( 0.05-0.1%的胶原酶/分散酶,0.05-0.1%I型胶原酶,100-300U DNaseI )重悬浮,混匀,37℃水浴消化0.5-1h,700×g室温离心6min,去上清液。
9.沉淀加入2ml DMEM(含庆大霉素和谷氨酰胺)培养液悬浮混匀,铺于经离心形成连续梯度的12ml 50%Percoll(25 000×g,60min,4℃),1000×g,4℃离心10min。
10.靠近底部的红细胞层之上的白黄色的层面即为纯化的微血管段,吸出后DMEM漂洗两次(离心1000×rpm,6min,室温),去上清液。
加入DMEM完全培养液(20%FBS,4ug/ml嘌呤霉素 )重悬浮,接种于含5%的大鼠 血清37℃孵育过夜所制备的细胞培养皿中,置于37℃、5%CO2培养箱内静置培养24h后更换不含嘌呤霉素的混合培养基,随后隔天换液。

一、各类组织的取材技术:
1、 皮肤和粘膜的取材
主要取自于手术过程中的皮片,方法似外科取断层皮片手术操作,但面积一般2~4平方厘米。
2、内脏和实体瘤的取材
内脏除消化道外基本是无菌的,但取材时要明确和熟悉所需组织的类型和部位,实体瘤取材时要取肿瘤细胞丰富的区域,要避开破溃、坏死液化部分,以防污染,尽量去除混杂的结缔组织。
3、血液细胞的取材
血细胞、淋巴细胞的取材,一般多抽取静脉外周血,或从淋巴组织中(如脾、扁桃体、胸腺、淋巴结等)分离细胞,取材时应注意抗凝。
4、 骨髓、羊水、胸/腹水细胞取材
严格无菌,注意抗凝,还要尽快分离培养,离心后,用无钙、镁PBS洗两次,再用培养液洗一次后即可培养,不宜低温存放。
5、动物组织取材
I、鼠胚组织取材
首先用引颈或气管窒息致死法处死孕期合适的动物,然后将其整个浸泡在含有75%酒精的烧杯中,5分钟后(注意时间不能太长,以避免酒精从口或其他通道进入体内,影响组织活力),取出动物,在消毒过的木板上可用无菌的图钉或大头针固定四肢,切开皮肤,用无菌操作法解剖取胚或用无菌止血钳挟起皮肤、用无菌眼科剪沿躯干中部环形剪开皮肤,用止血钳分别挟住两侧皮肤拉向头尾,把动物反包,暴露躯干,然后再固定,更换无菌解剖器材,采用无菌操作法解剖取出胚胎。
II、幼鼠胚肾(或肺)取材
幼鼠采用上述方法处死消毒后,腹部朝上固定在木板上,先切开游离毛皮并拉开至两侧:然后采用无菌法打开胸腔取肺,或背部朝上固定在木板上,先将背部毛皮切开游离并拉向两侧,然后采用无菌法从背部打开腹腔取肾。
6、鸡(鸭)鸟类胚胎组织取材步骤
1)、取孵化至适当胚龄(9~12天)的胚蛋,用照蛋灯在暗处灯检,若有丰富血管、胚体有运动的胚蛋,说明胚体发育良好,并用有色笔划出气室和胚体位置。
2)、将胚蛋置于蛋架上,先用温水清洗蛋壳,再用75%酒精棉球擦干;
经碘酒、75%酒精消毒后,在无菌条件下采用无菌法用剪刀或镊子打开气室,沿气室边缘去除蛋壳;
3)、用眼科镊撕去壳膜,暴露出鸡胚;
4)、用弯头镊轻挑起胚头,取出胚胎,放入无菌平皿中,解剖取材。
二、原代细胞与细胞系的区别

三、原代细胞分离培养
取材--分离--培养--鉴定
首先将组织从机体中取出,经胰蛋白酶/胶原酶处理后分散成单细胞,再在合适的培养基中培养,使细胞繁殖到一定系数后进行细胞鉴定。
四、实验步骤:
1.取7-10d雄性SD大鼠,颈椎脱臼处死,浸泡于75%乙醇消毒3-5min。
2.在超净工作台中,将大鼠断头置于玻璃培养皿中,打开颅腔后取出全脑,放在盛有预冷的PBS玻璃培养皿中,去除小脑和间脑。
3.将大脑半球在干滤纸上缓慢滚动以去除软脑膜和脑膜大血管,再放在新的盛有预冷的PBS玻璃培养皿中。
4.用细解剖镊去除大脑白质、残余大血管和软脑膜,保留大脑皮质。
5.大脑皮质放于DMEM中(含庆大霉素和谷氨酰胺 ),剪碎成约1mm3大小,放入50ml的离心管中,加入混合酶液I(0.05-0 .1%II型胶原酶,0 .025-0 .05%IV型胶原酶,200-400U DNaseI),混匀后37℃水浴消化1-1.5h。
6.室温1 000×g离心8min,去上清液。
7.沉淀中加入20%BSA重悬浮,充分混匀,1 000×g,20min,4℃离心,去上清。
8.沉淀加入4ml混合酶液II( 0.05-0.1%的胶原酶/分散酶,0.05-0.1%I型胶原酶,100-300U DNaseI )重悬浮,混匀,37℃水浴消化0.5-1h,700×g室温离心6min,去上清液。
9.沉淀加入2ml DMEM(含庆大霉素和谷氨酰胺)培养液悬浮混匀,铺于经离心形成连续梯度的12ml 50%Percoll(25 000×g,60min,4℃),1000×g,4℃离心10min。
10.靠近底部的红细胞层之上的白黄色的层面即为纯化的微血管段,吸出后DMEM漂洗两次(离心1000×rpm,6min,室温),去上清液。
加入DMEM完全培养液(20%FBS,4ug/ml嘌呤霉素 )重悬浮,接种于含5%的大鼠 血清37℃孵育过夜所制备的细胞培养皿中,置于37℃、5%CO2培养箱内静置培养24h后更换不含嘌呤霉素的混合培养基,随后隔天换液。
相关文章
更多 >

