
分子对接


分子对接能有效运用于: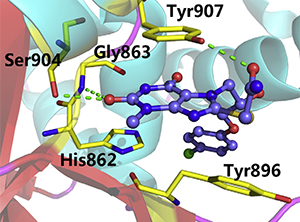
- 探索药物小分子和大分子受体的具体作用方式和结合构型;
- 筛选可以与靶点结合的先导药物;
- 解释药物分子产生活性的原因;
- 指导合理地优化药物分子结构。
【服务内容】
- 同源模建(受体无结构)
- 受体、配体准备
- 结合位点判断
- 蛋白柔性构象探索
- 配体构象数据库准备
- 分子对接
- 结果分析、评价
随着X-Ray 衍射和NMR 技术的发展,已经有大量的靶标蛋白的三维晶体结构被解析出来,得到蛋白的晶体结构后并不能直接用于分子对接。实际上,在蛋白的解析过程中经常会有各种各样的错误,比如原子的缺失、蛋白的二级序列和三维结构不能对应等等,这些都会影响对接的准确性,特别是当这些错误出现在配体的结合口袋内时。因此,在对接前必须对这些错误进行更正。无论是X-Ray 还是NMR 都只能确定重原子的位置而没有氢原子的位置信息,在对接前就需要先进行加氢质子化,标示局部电性,这样才能用于对接。
准备蛋白结构后需要寻找药物分子结合的活性位点,而蛋白表面的拓扑非常复杂、多样,物理化学性质也异常多样化,究竟哪些位点才是小分子药物结合的位置,并能抑制或激活蛋白的活性呢?实际上针对靶标蛋白必然有一些相应的研究和其生物学功能的注释。
在大多数情况下,蛋白也是通过结合天然的配体(大分子或小分子)来发挥其生物学功能。这些天然配体的结合位点很可能就是其抑制剂或激动剂的结合位点。如果缺少这些相应的生物学注释,也可以借助于计算分析,从拓扑、物化性质等多个角度来考察蛋白表面,找到合适的结合位点,并和实验信息相结合,最后确定活性位点。
众所周知,蛋白-配体相互作用过程中,存在诱导契合效应,结合过程中其构象都会发生相应的变化,一个准确的对接必须考虑到受体和配体的柔性。现在的软件工具虽然很多都宣称可以进行受体柔性对接,但是方法上都有比较大的局限性,可能只是通过力场优化等方法进行侧链的构象优化。
我们可以通过计算机模拟的方法考察蛋白可能存在的几种不同的构象,通过这些构象作为对接的起点能更多的考虑蛋白的柔性。另一个柔性是配体的柔性。尽管在对接过程中软件会自动的考虑配体的柔性,比如旋转一些可旋转键。但是这种构象的产生也是比较有限的,比如无法充分考虑到饱和环的构象。我们可以通过构象搜索、饱和环构象搜索等方法尽可能的遍历配体的优势构象来作为对接的构象库,从而提高准确性!对接后一般通过结合自由能的打分来进行排序。可能每个配体有多种的结合构象,我们通过综合的评价方法来挑选最有可能的结合模式,比如结合自由能的打分、分子的应力能等,并且结合人为的判断挑选来找到真正合理的结合方式。



| 单位名称: |
|
详细地址:
广东省广州市天河区珠江西路5号广州国际金融中心807-809
|
|
qq:
194432588
|
| 官网: |
| 联系电话: |
| Email: |



