外泌体的介绍和检测提取机制
2021-08-05 来源:MedChemExpress 点击次数:2706想当初,外泌体刚被发现的时候,还被贴上了“代谢废物”的标签,如今却摇身一变成了科研宠儿!妥妥的拿着“废柴逆天”主角剧本。
外泌体 (Exosome) 是什么?
所有原核和真核细胞在生理正常或异常时,均可通过出芽的方式释放各种各样的膜包裹的囊泡 (Extracellular vesicles, EVs) 到胞外环境中,如外泌体、微囊泡、凋亡小体。胞外囊泡可广泛的分为两类,核外颗粒体 (Ectosome) 和外泌体。核外颗粒体是从质膜脱离的外出芽小泡,包括直径在 ~50 nm-1 μm 的微泡、微粒和大囊泡。
外泌体是细胞核内体途径起源的、直径在 ~40-160 nm (平均 100 nm) 的囊泡。外泌体的产生涉及到一个独特的细胞内调节过程,这可能决定了它们的组成,从而决定了它们的功能。
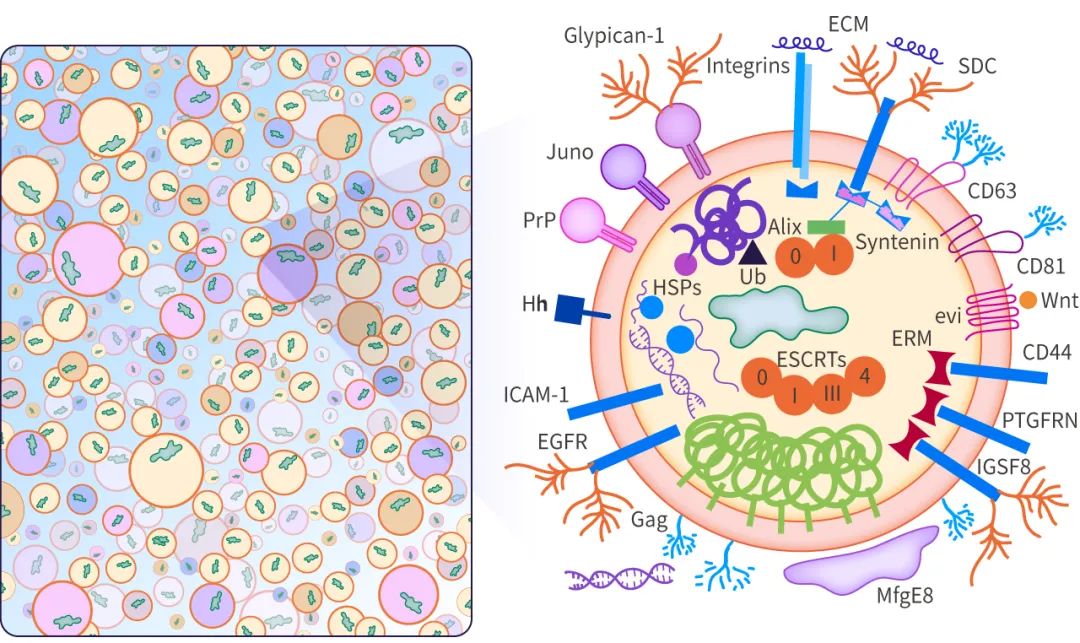
图 1. 外泌体结构和内容物
外泌体的产生和分泌
外泌体的产生涉及质膜的双重内陷、和含有腔内小泡 (Intraluminal vesicles, ILVs)、细胞内多囊泡体 (Multivesicular bodies, MVBs) 的形成。ILVs 通过 MVBs 与质膜的融合和胞吐,最终以外泌体的形式分泌到胞外。
质膜的第一次内陷形成一个杯状结构,其中包含细胞表面的蛋白与胞外一些可溶性蛋白,这个过程形成了早期内涵体 (Early-sorting endosome, ESE)。ESEs 可发展为成熟的晚期内涵体 (Late-sorting endosomes, LSEs),并最终生成 MVBs。MVBs 是通过质膜双凹形成的,这一过程导致 MVBs 含有多个 ILVs (未来的外泌体)。MVBs 可以与溶酶体或自噬体融合被降解,或与质膜融合以释放所含的 ILVs 为外泌体。
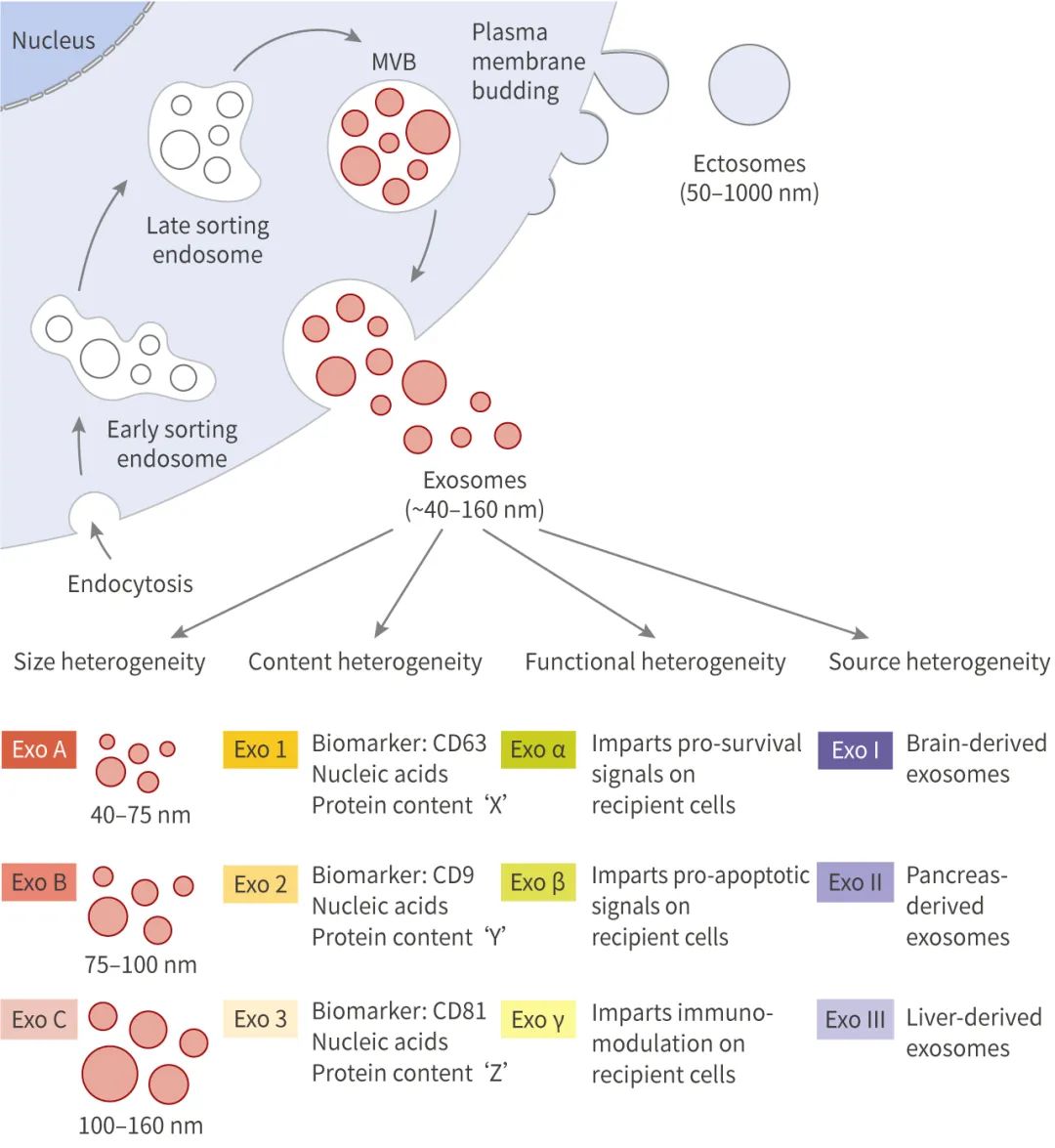
图 2. 外泌体的生成、分泌和分类
外泌体的起源和形成方式导致其内容物、形状、大小均有差异,从而会影响受体细胞的不同功能,这种特性被称为外泌体的异质性。外泌体可通过其大小和表面特异性标记被识别,包括 TSG101、Alix、Flotillin-1、CD63、CD9 等。
外泌体分泌途径的分子机制
■ ESCRT
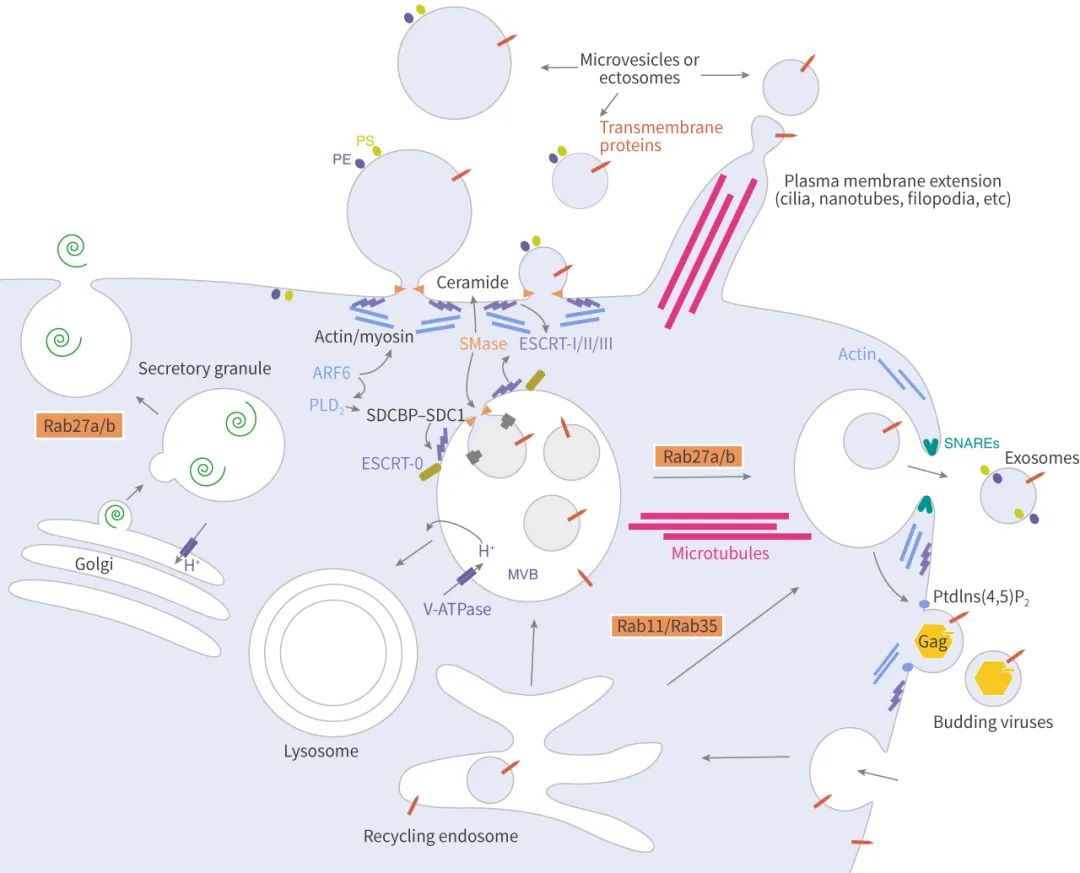
说起分泌和转运,不得不提转运所需的内涵体分选复合体 (Endosomal sorting complex required for transport, ESCRT)。ESCRT 是一个蛋白家族,在 MVBs 膜上连续结合复合物 (ESCRT-0, -I, -II 和 -III),其中 ESCRT-0 通过泛素化依赖途径调控内容物聚集,ESCRT-I 和 ESCRT-II 诱导芽的形成,ESCRT-III 驱动小泡的脱落,而辅助蛋白 (特别是 VPS4 ATPase) 允许 ESCRT 系统的解离和循环。
ESCRT-0:ESCRT-0 复合体 (HRS 和 STAM) 不参与出芽和膜分离的过程,因此可作为追踪外泌体来源的依据。HRS (Hepatocyte growth factor-associated tyrosine kinase) 识别单泛素化的蛋白,并与泛素化部分结合将蛋白靶向到 ILVs 上 (蛋白分选到 ILVs 中的过程主要取决于泛素化),并与 STAM、Eps15 和 Clathrin 形成复合体。随后 HRS 招募肿瘤易感基因 TSG101 (ESCRT-I 的组分),ESCRT-0 和 ESCRT-I 一起负责泛素化蛋白的分选。
ESCRT-II :ESCRT-II 是一个异四聚体的蛋白复合物,由 Vps36、Vps22 和双拷贝的 Vps25 组成。Vps36 的 N 末端可与泛素 (内容物蛋白或其它 ESCRT 上蛋白)、以及 ESCRT-I 的 C 末端结合。ESCRT-I/II 的超复合体被证明在 ILVs 的膜变形中发挥重要作用。然后,ESCRT-II 的 Vps25 亚基和 ESCRT-III 的 Vps20 亚基结合,启动 ESCRT-III 工作。
图 3. 外泌体的生物合成 (相关分子)
ESCRT-III:以酵母为例,ESCRT-III 由 Vps20、Snf7 (Vps32)、Vps24 和 Vps2 四个核心亚基、以及辅助蛋白 Did2、Vps60、和 Ist1 组成,在细胞质中,这些亚基都是不活跃的单体,一旦结合膜上,它们形成一个瞬态的 ESCRT-III 异聚合物。前面说到 ESCRT-II 的 Vps25 亚基和 ESCRT-III 的 Vps20 亚基结合, 然后 Snf7 被 Vps24 和 Vps2 包裹 (像帽子盖住),与 Vps20 形成复合体。ESCRT-III 促进膜分离,促使囊泡断离。
■ Rab GTPases
Rab 家族的小 GTPases 成员在细胞内 ILVs 的转移中发挥了明确的作用,也参与了 MVBs 与质膜的对接、以及外泌体的释放。其中 Rab27a 和 Rab27b 作用于 MVBs (也叫 MVE,Multivesicular endosomes) 与质膜的对接。Rab27a 抑制后,MVBs 的大小显著增加,而抑制 Rab27b 后导致 MVBs 的向核周围区域的重新分布,此外,Rab27 两个效应因子 Slp4 (SYTL4) 和 Slac2b (EXPH5) 被抑制后同样抑制外泌体的分泌且分别导致 Rab27a 和 Rab27b 的沉默。
■ SNAREs
研究外泌体生物发生的一个主要目标是识别 MVBs 与质膜融合所需要的 SNARE (可溶性 N-乙基马来酰亚胺敏感融合连接蛋白受体) 复合物。YKT6 SNARE 被证明是分泌含 Wnt 的外泌体所必需的,而 Syx-5 (线虫同源物 Syntaxin-5),通过 Ral-1 小 GTPase 使 MVBs 靶向质膜。另外,Syntaxin-1A 是神经元特异性的 SNARE,参与突触囊泡的分泌,能影响果蝇的外泌体分泌。
■ 其它
ARF6 是 ILVs 出芽和外泌体生物合成的调节因子,该调节作用依赖于 ARF6 的效应器 PLD2。
Doa4 N 末端具有一个相当于 MIT 结构域的 α 螺旋结构,直接与 ESCRT-III 的 Vsp20 亚基中类似 MIM1 的序列结合,可促进 ILVs 的形成。
外泌体被生产出来后去哪里了呢?小编告诉你,它们可能被别的细胞“吃了”!
外泌体的摄取
目前还不清楚外泌体是否必须被免疫细胞和非免疫细胞内化以引起细胞反应。根据现有研究,外泌体被摄取内化的途径主要有以下几种。
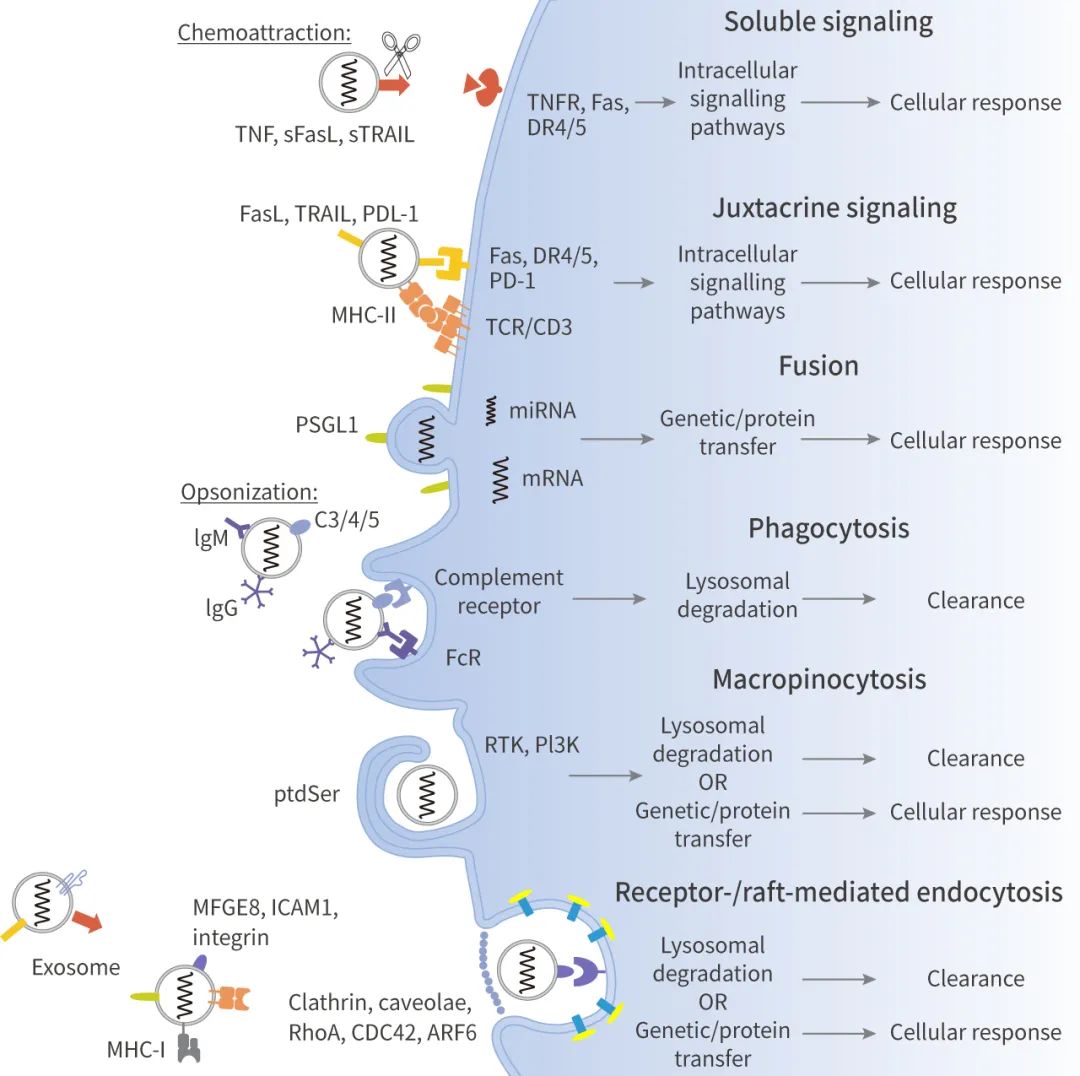
图 4. 外泌体的摄取途径
◎ 可溶性信号通路:对外泌体表面的配体进行蛋白水解切割或选择性剪接。比如:膜结合的 FasL、TRAIL 和 TNF 可以被金属蛋白酶切割,形成可溶性细胞因子。
◎ 近分泌信号通路:外泌体和靶细胞表面的配体和受体邻近,通过信号传导途径发挥作用。比如:培养的胎盘外植体或孕妇血浆中的外泌体膜上具有 FasL 和 TRAIL,并通过 NF-κB、CD3ζ 和 JAK3 的下调,来诱导 Jurkat T 细胞凋亡。
◎ 融合:例如,研究证实单核细胞来源的微泡可以与活化的血小板的质膜融合,并将蛋白转移到受体细胞,如组织因子和 P-选择素糖蛋白配体-1 (PSGL-1)。
◎ 吞噬作用:吞噬是一种肌动蛋白介导的机制,需要特定的调理素蛋白受体 (如 FcR 和补体受体)、清道夫受体或 Toll 样受体的参与。可由巨噬细胞和树突状细胞这类“专业细胞”完成,也可由 γδT 等“非专业”细胞完成。例如,单核/巨噬细胞能够更有效地吞噬内化来自红血球 (K562) 和 T 细胞白血病 (MT4) 细胞的外泌体。外泌体的吞噬作用依赖于肌动蛋白细胞骨架、磷脂酰肌醇 3 激酶 (PI3K) 和 Dynamin2。
◎ 巨胞饮:少突细胞来源的外泌体表面的磷脂酰丝氨酸 (PtdSer) 激活了不具备抗原呈递能力的小胶质细胞/巨噬细胞亚群的大胞吞。外泌体的巨胞饮作用依赖于 Na+ 和 PI3K,EIPA 和 LY294002 分别抑制 Na+-H+ 离子交换和 PI3K 活性,减少外泌体摄取。
◎ 受体和脂筏介导的内吞:这两个途径需要外泌体表面的配体与质膜上的特定受体结合,在细胞质膜上分别需要存在富含胆固醇和鞘脂的微区。前者也称为网格蛋白介导的内吞作用。后者包括小窝介导的内吞作用,以及 RhoA-、CDC42-和 ARF6-调控的、独立于网格蛋白和小窝的内吞作用,它们利用 Dynamin、Flotillin 和/或 Rab 蛋白的不同组合。如大鼠肾上腺髓质 (PC12) 肿瘤细胞释放的外泌体可通过网格蛋白介导的内吞作用部分内化。
参考文献
↓ 下滑查看更多文献
1. Raghu Kalluri, et al. The biology , function , and biomedical applications of exosomes. Science. 2020 Feb 7;367(6478):eaau6977.2. Mathilde Mathieu, et al. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat Cell Biol. 2019 Jan;21(1):9-17.
3. Suresh Mathivanan, et al. Exosomes: extracellular organelles important in intercellular communication. J Proteomics. 2010 Sep 10;73(10):1907-20.
4. Lucio Barile, et al. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacol Ther. 2017 Jun;174:63-78.
5. Kelly J. McKelvey, et al. Exosomes: Mechanisms of Uptake. J Circ Biomark. 2015 Jan-Dec; 4: 7.
6. Marina Colombo, et al. Analysis of ESCRT functions in exosome biogenesis, composition and secretion highlights the heterogeneity of extracellular vesicles. J Cell Sci. 2013 Dec 15;126(Pt 24):5553-65.
7. Rania Ghossoub, et al. Syntenin-ALIX exosome biogenesis and budding into multivesicular bodies are controlled by ARF6 and PLD2. Nat Commun. 2014 Mar 18;5:3477.
8. Caleb M. Richter, et al. Doa4 function in ILV budding is restricted through its interaction with the Vps20 subunit of ESCRT-III. J Cell Sci. 2013 Apr 15; 126(8): 1881–1890.
9. D Michiel Pegtel, et al. Exosomes. Annu Rev Biochem. 2019 Jun 20;88:487-514.
10. Wenchong Zou, et al. Exosome Release Is Regulated by mTORC1. Adv Sci (Weinh). 2018 Dec 11;6(3):1801313.
11. Marina Vietri, et al. The many functions of ESCRTs. Nat Rev Mol Cell Biol. 2020 Jan;21(1):25-42.
12. Matias Ostrowski, et al. Rab27a and Rab27b control different steps of the exosome secretion pathway. Nat Cell Biol. 2010 Jan;12(1):19-30; sup pp 1-13.