阿尔兹海默症发病机制及主流观点
2021-08-27 来源:MedChemExpress 点击次数:3279图 1.《勿忘我》结尾片段
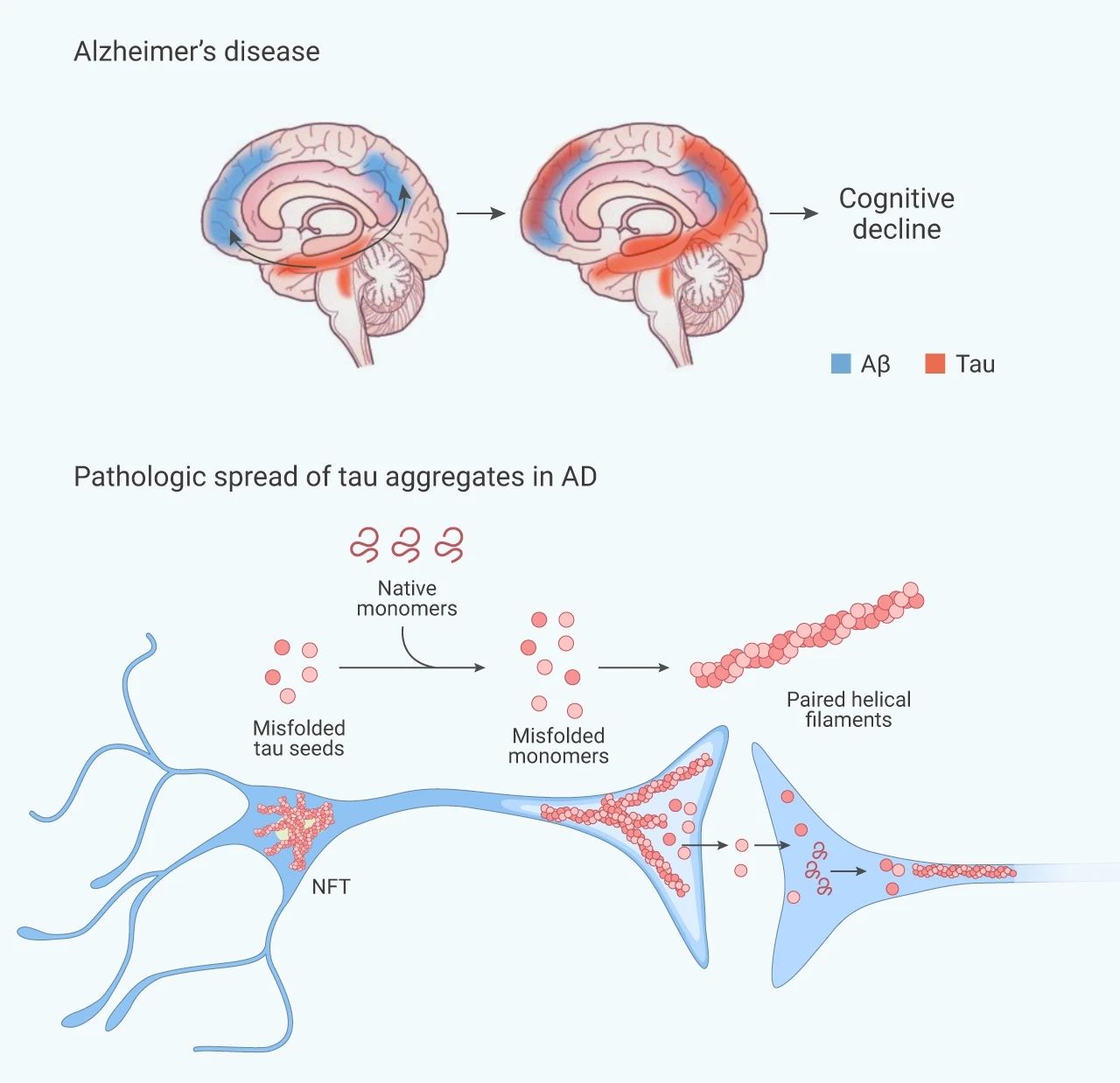
令人遗憾的是,阿尔兹海默症的发病机制复杂,至今仍未完全破译具体机制,目前主流观点是脑内细胞外 β-淀粉样蛋白 (Aβ) 逐渐沉积和细胞内 Tau 蛋白聚集导致的神经元死亡和认知障碍。
■ Aβ 蛋白沉积
Aβ 蛋白是淀粉样神经炎斑块的主要成分,由淀粉样前体蛋白 (APP) 代谢产生的,从 APP 变身 Aβ 蛋白有以下历程
APP 是 I 型跨膜糖蛋白,APP 在膜附近被 α-分泌酶的细胞外蛋白酶裂解,切割释放出可溶性细胞外片段 sAPPα;同时也被 β-分泌酶 1 (BACE1) 的天冬氨酰蛋白酶裂解,释放可溶性细胞外片段 APPβ 与膜结合片段 (C99)。紧接着,C99 在膜内被 γ-分泌酶复合物切割,释放 Aβ 蛋白和细胞内肽 (AICD)。
Aβ 蛋白在神经元活动增强的环境下分泌释放到细胞间质液中,聚集形成寡聚体、原纤维,最终形成斑块 (图 2)。
2021 年 6 月 7 日,FDA 批准阿杜卡努单抗 (Aducanumab) 作为早期阿尔兹海默症的治疗药物。作为近 20 年来首款用于阿尔兹海默症的批准药物,阿杜卡努单抗的主要作用机制是:作为一种高亲和靶向 Aβ 构象的单抗,与阿尔茨海默症 (AD) 患者脑中的淀粉样蛋白结合最终达到清除目的。
图 2. Aβ 蛋白沉积[1][2]
■ Tau 蛋白聚集驱动 AD 发展
Tau 蛋白与认知障碍的进展密切相关。研究表明,随着年龄的增长,即使没有认知能力下降,Tau 病理也会在内嗅皮层和内侧颞叶中积累,即所谓的原发性年龄相关 Tau 病变 (PART)。Tau 蛋白已经被证明在微管组装和神经元轴突的稳定以及微管运输的调节中具有重要作用,Tau 敲除 (KO) 小鼠虽然没有表现严重的发育表型,但在细胞培养中会表现出明显神经元成熟延迟和突触可塑性受损。
在正常情况下,Tau 蛋白通常以其天然单体形式存在,但是在阿尔兹海默症患者的大脑中,Tau 蛋白聚集物以一种固定的方式沿着神经解剖连接线发生。错误折叠的 Tau 蛋白促进天然 Tau 单体的错误折叠,进一步导致新的病理 Tau 蛋白聚集物产生。
图 3. Tau 蛋白聚集[2][3]
Tau 蛋白也受多种翻译后修饰的影响,包括磷酸化、乙酰化、糖化、O-GlcNAcylation 等多种修饰。Tau 在不同位点的磷酸化反映疾病的进程。在 AD 早期,神经原纤维缠结 (NFTs) 尚未形成,Tau 的磷酸化位点主要发生在 Ser199 和 Ser422 等位点,随着疾病的进展,Ser202 和 Thr205 位点的磷酸化将不断增强。Thr231 位点的磷酸化一般标志着有更多的成熟的 p-Tau 组装形成 NFTs,推动疾病进入晚期阶段。乙酰化修饰也有着重要作用,最近发表于 Cell 的文章 Reducing acetylated tau is neuroprotective in brain injury 一文表明,创伤性脑损伤 (TBI) 是 AD 中的非遗传性、非衰老相关风险因素,在有 TBI 史的 AD 患者大脑中的乙酰化位点诱导 tau 乙酰化 (ac-tau)。
阿尔兹海默症的相关发病机制较为复杂,那么用于阿尔兹海默症研究的动物模型有哪些呢
■ 表现 Aβ 病变的小鼠模型
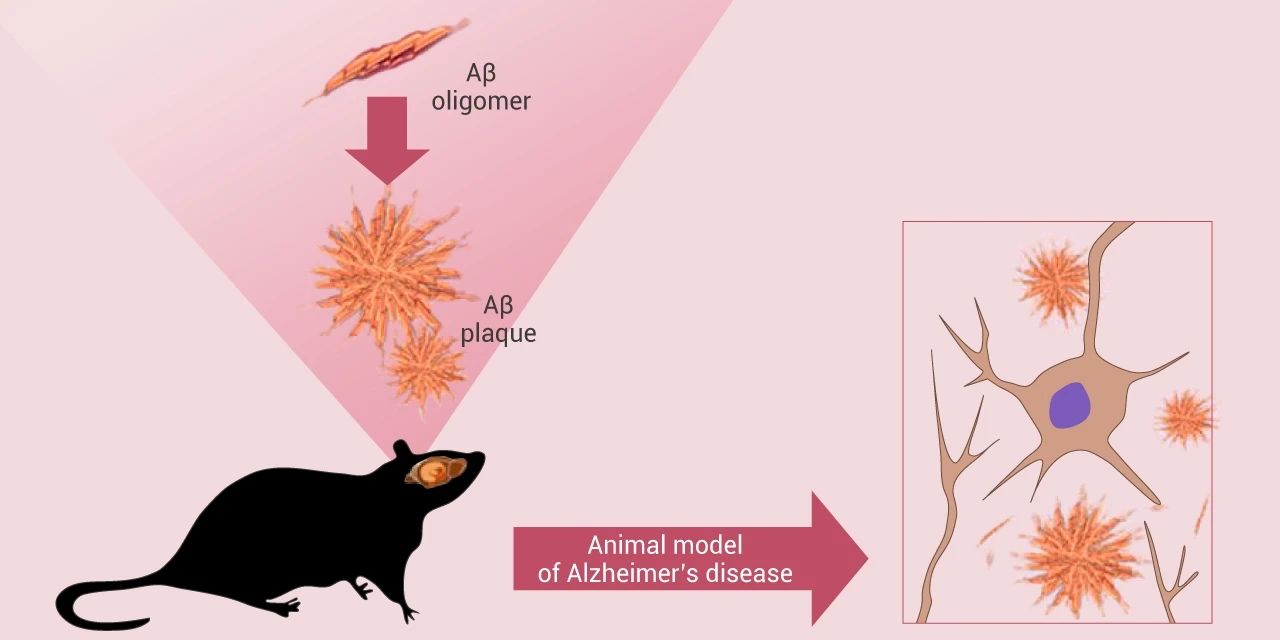
Aβ 蛋白的注射:有很多研究者选择直接向小鼠和大鼠脑内注射毒性 Aβ 多肽来模拟阿尔茨海默病 (图 4)。这种使用注射的方法能够模拟在分子层面以及行为层面上的改变,例如:学习和记忆能力削弱。这种造模方式造模时间短,但个体差异较大,且注射的方法比较考验技巧。
图 4. Aβ 蛋白注射诱导疾病模型[5]
除了上述方法,还有基于人源性 APP 或 PS1 突变基因构建而成的小鼠模型。野生型小鼠与人的 APP 蛋白存在氨基酸位点差异, 一般无法自发生成 Aβ 沉积。因此只有通过转入人源性 APP 基因才能表现出 Aβ 相关的病理改变。例如:PDAPP 小鼠在 PDGF-β 启动子的调节下表达人类 APP Indiana 突变 (APPV717F),使得 APP 表达量上调 (小鼠内源性 APP 的 10 倍)。该模型小鼠在 6~9 月龄时开始出现 Aβ 斑块,在大脑中表现出年龄依赖性淀粉样蛋白沉积以及硫代黄素-S 阳性斑块,包括具有致密核心的致密斑块,这些斑块与人类 AD 中所见的相似。
■ 表现 Tau 病变的转基因小鼠模型
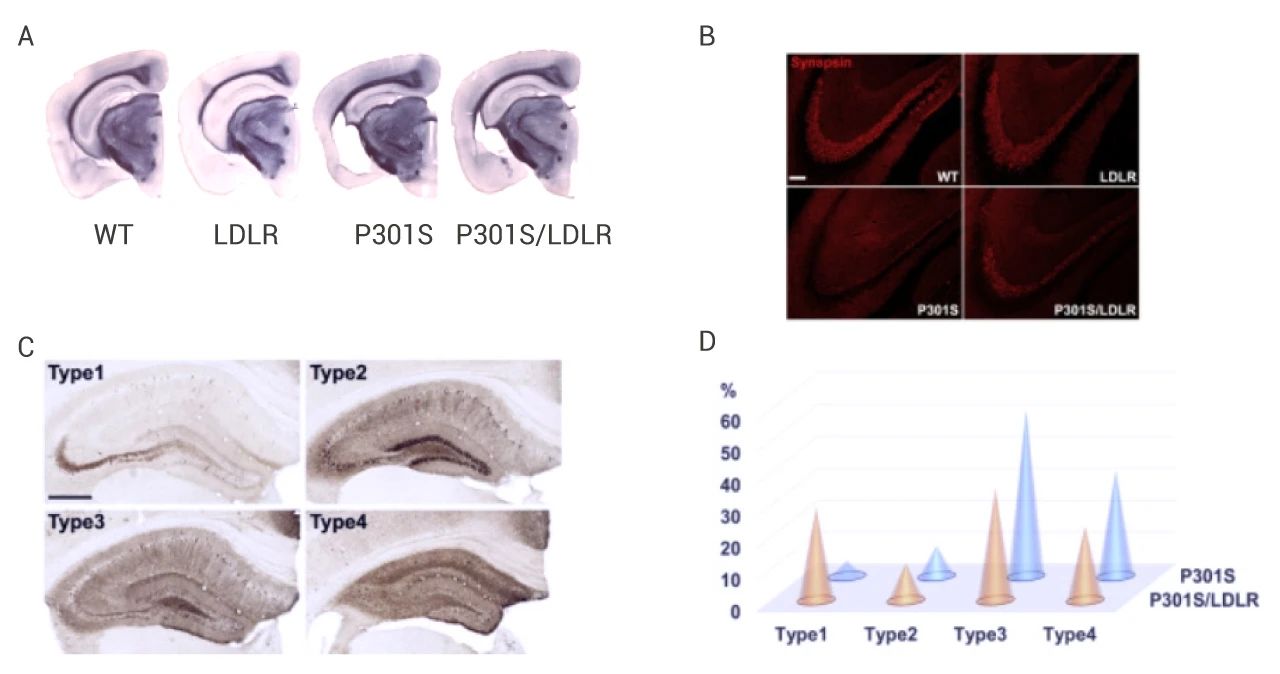
JNPL3 小鼠是最早利用 P301L 突变构建的 Tau 转基因小鼠模型,该模型小鼠可在小脑、海马体,以及脊髓等处过表达人源性 TauP301L 蛋白,并且使得神经原纤维缠结以年龄和基因剂量依赖性方式发展。除 P301L 突变之外,P301S 也是常见的 Tau 转基因小鼠模型。例如,在 6 月 21 日在 Neuron 上发表的 Overexpressing low-density lipoprotein receptor reduces tau-associated neurodegeneration in relation to apoE-linked mechanisms 中,作者团队证明了 LDLR OX 降低 apoE 表达,并减少 P301S 小鼠的 Tau 病理和神经变性。
作者团队将 LDLR 转基因小鼠与 P301S 小鼠杂交,产生 P301S/LDLR 杂交小鼠。研究结果表明,在 P301S 小鼠中,P301S 小鼠的海马和梨状/内嗅皮层表现出严重的脑萎缩 (图 5A),突触蛋白染色结果显示 P301S 小鼠的海马 CA3 区的透明层突触丢失明显 (图 5B)。而 P301S/LDLR 小鼠相对 P301 小鼠,上述症状都有缓解,并且原本由一到四型逐加重的并且将 p-tau 染色也被 LDLR OX 转变至早期模式 (图 5C, 5D)。
图 5. P301S 小鼠中的 LDLR OX 减轻神经变性[6]
A: 苏丹黑染色;B: 突触蛋白染色;C: AT8 染色的四种不同的 p-tau 模式;D. P301S和 P301S/LDLR 小鼠 p-tau 染色模式分布式
■ 同时表现 Aβ 和 Tau 病变的转基因小鼠模型
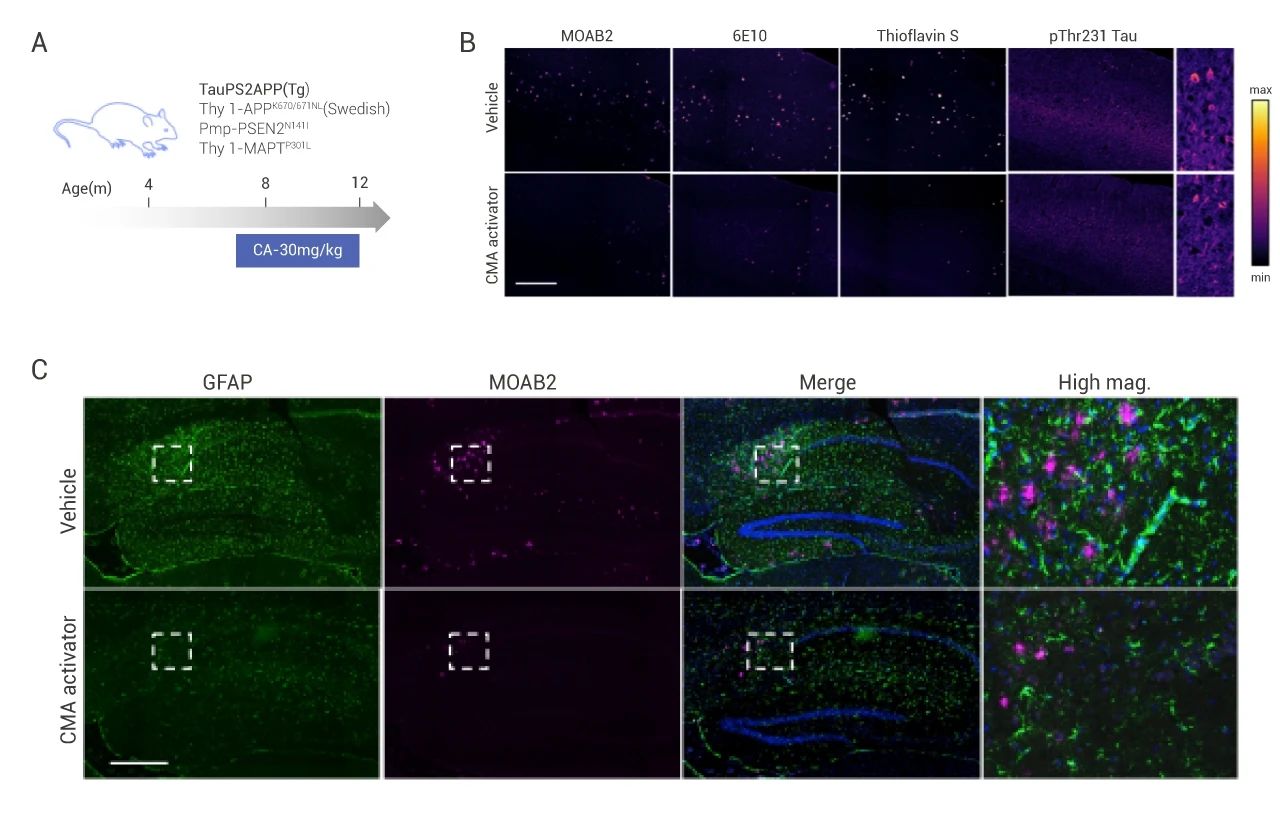
除了上述转基因模型,目前公认的可较为全面模拟 AD 病理改变的模型是 3xTg 小鼠,该模型小鼠同时携带 APPK670N/M671L、TauP301L 以及 PS1M146L 三种 FAD 突变。例如近期在 Cell 上发表的题为 Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome 文章,证明了 CMA 激活对 AD 样病变的改善作用。作者团队使用了 AD (Tg) 三转基因小鼠模型,同时从小鼠第八个月起,开始给 CMA 激动剂 CA77.1 (简称 CA) (图 6A)。Tg 小鼠表现出类似焦虑和抑郁的行为,并且记忆明显下降。
免疫荧光的结果表明 3xTg 小鼠的海马背侧早期 p-T231tau 蛋白水平,未成熟淀粉样斑块 (MOAB2)、成熟淀粉样沉积 (6E10)、β 样折叠蛋白以及 pThr231tau 都发生了显著的上调 (图 6B)。结果还显示海马背侧的小胶质细胞 (Iba 染色) 和星形胶质细胞数量明显增多,胶质细胞与淀粉样斑块样沉积物的共定位染色明显 (图 6C)。而 CA 给药组会明显改善上述状况。总之,这些结果证明了 CA 对 AD 相关病理具有有益的影响。
图 6. 3xTg 小鼠的海马背侧染色[7]
A: 3xTg 模型示意; B: AD 疾病相关指标染色; C: 胶质细胞染色
总结:
在这篇文章中,小 M 给大家介绍了目前关于阿尔兹海默症发病机制的主流观点Aβ 作为斑块或非纤溶、寡聚物形式,最后形成致密的蛋白斑块 (“老年斑”);tau 蛋白错误折叠和组装,不断扩散,最后导致神经并扩散到整个皮质,导致神经系统衰竭、神经退行性变和认知能力下降。
关于阿尔兹海默症的研究,研究者们从未停止探索的脚步,小 M 相信,总有一天,守得云开见月明。
|
BACE1 抑制剂 |
|
血脑屏障的 BACE1 抑制剂,可用于阿尔兹海默症的研究。 |
|
具有口服活性的、可透过大脑屏障的 BACE1 抑制剂,可用于阿尔兹海默症的研究。 |
|
BACE-1 抑制剂,可用于阿尔兹海默症的研究。 |
| γ-secretase 抑制剂 |
|
γ-secretase 抑制剂,抑制 Aβ42 和 Aβ40 的产生,用于阿尔兹海默症的研究。 |
|
γ-secretase 抑制剂,抑制 Aβ42, Aβ38 和 Aβ40 形成,可用于阿尔兹海默症的研究。 |
|
γ-secretase 选择性抑制剂 (IC50: Aβ40=15 nM),可用于阿尔兹海默症的研究。 |
|
β-Amyloid 蛋白相关产品 |
|
由 42 个氨基酸组成的肽,是构成老年斑和神经纤维缠结的主要成分,在阿尔兹海默症的发病机制中起关键作用。 |
|
β-淀粉样蛋白的活性片段,可诱导阿尔兹海默症相关的神经毒性。 |
|
是由 42 个氨基酸组成的肽,有神经毒性作用,可用于阿尔兹海默症的相关研究。 |
|
β-Amyloid (42-1), human 是 β-Amyloid (1-42) 的无活性形式;可用作阴性对照。 |
| 其他产品 |
|
β-Amyloid 聚集,可用于阿尔兹海默症的研究。 |
|
防止 Aβ 沉积,可恢复细胞中铜和锌离子的稳态,可用于阿尔兹海默症的研究。 |
|
(-)-Epigallocatechin Gallate (EGCG) 通过抑制 APP 蛋白水解减少 Aβ 蛋白的形成。 |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务
缩写
AD: Alzheimer's disease
APP: Amyloid precusor protein
NFTs: Neurofibrillary tangles
CMA: Chaperone-mediated autophagy
FAD: Familial Alzheimer's disease
参考文献
下滑查看更多 ↓
1. Francesco Panza, Madia Lozupone, Giancarlo Logroscino, Bruno P Imbimbo, et al. A critical appraisal of amyloid-β-targeting therapies for Alzheimer disease. Nat Rev Neurol. 2019 Feb;15(2):73-88
2. Justin M Long, David M Holtzman, et al. Alzheimer Disease: An Update on Pathobiology and Treatment Strategies. Cell. 2019 Oct 3;179(2):312-339.3. Marc Aurel Busche, Bradley T Hyman, et al. Synergy between amyloid-β and tau in Alzheimer's disease. Nat Neurosci. 2020 Oct;23(10):1183-1193.
4. Jwa-Jin Kim, Minho Moon, et al. Vitamin D-binding protein-loaded PLGA nanoparticles suppress Alzheimer's disease-related pathology in 5XFAD mice. Nanomedicine. 2019 Apr;17:297-307.
5. Min-Kyoo Shin, Edwin Vázquez-Rosa, Yeojung Koh, Feixiong Cheng, James D Reynolds, Andrew A Pieper, et al. Reducing acetylated tau is neuroprotective in brain injury Cell. 2021 May 13;184(10):2715-2732.e23.
6. D Games, D Adams, R Alessandrini, R Barbour, P Berthelette, C Blackwell, T Carr, J Clemens, T Donaldson, F Gillespie, et al. Alzheimer-type neuropathology in transgenic mice overexpressing V717F beta-amyloid precursor protein. Nature. 1995 Feb 9;373(6514):523-7.
7. Mathieu Bourdenx, Evripidis Gavathiotis, Ana Maria Cuervom, et al. Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome. Cell. 2021 May 13;184(10):2696-2714.e25.