AI与空间转录组学助力高级别浆液性癌的空间标志物预后研究
2024-07-29 来源:本站 点击次数:543文章详情
文章题目:Opening the black box: spatial transcriptomics and the relevance of AI-detected prognostic regions in high grade serous carcinoma
中文题目:打开黑盒子:高级别浆液性癌的空间转录组和AI预后研究
发表时间:2024.05.03
期刊名称:Modern Pathology
影响因子:7.5
实验平台: Visium空间转录组学、深度学习模型
DOI:10.1016/j.modpat.2024.100508
研究背景
高度浆液性癌症(HGSC)是卵巢癌中最常见且最致命的类型,其特点是高度的肿瘤异质性和对化疗的抵抗性。这种肿瘤的遗传异质性不仅在不同患者间存在显著差异,而且在单个患者的肿瘤组织内部也表现出高度的变异性,这对于治疗的有效性构成了重大挑战。尽管HGSC的发病率相对较高,但对其发病机制、发展过程以及治疗反应的理解仍然有限。传统的形态学方法无法准确地区分与不同疗效相关的肿瘤区域,因此迫切需要新技术来识别这些关键区域。本研究通过结合空间转录组学和人工智能(AI)技术,探索肿瘤组织中与预后相关的生物标志物,以期提高对HGSC复杂生物行为的认识并指导未来的临床治疗策略。
技术路线
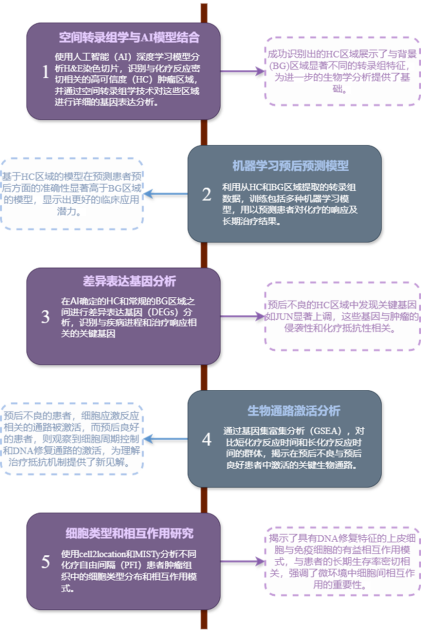
研究结果
1. 利用AI检测空间转录组数据的高可信度(HC)肿瘤区域
研究者从16名未经治疗的HGSC患者中收集了空间转录组(ST)数据。在应用AI模型的训练过程中,AI成功地识别出与患者化疗反应时间密切相关的高可信度(HC)肿瘤区域。AI检测的高可信区域展示了独特的基因表达模式,与治疗响应的预后有显著关联。通过比较这些AI标记的HC区域与未被AI标记的BG区域,研究揭示了两者在分子层面上的显著差异。此外,AI检测的HC区域在预测疾病预后方面具有更高的区分度。这意味着这些区域的分子特征可能更准确地反映了患者对化疗的响应性,从而为未来的个性化治疗策略提供了潜在的生物标志物。通过细致的分析,该部分结果强调了AI与空间转录组学结合使用在精准医疗中的应用价值,尤其是在难以治疗的高级浆液性卵巢癌中。
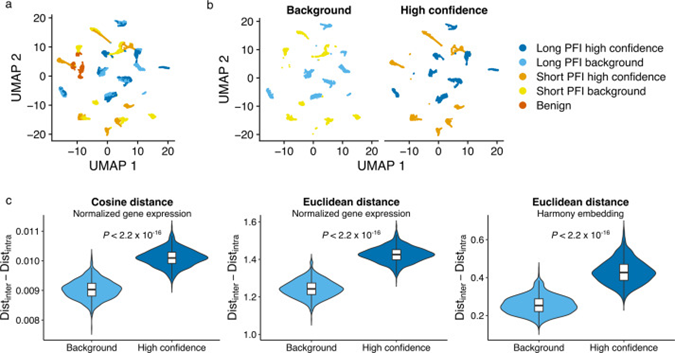
图2. 来自HC和BG肿瘤区域的空间转录组学图谱。
2. 基于空间转录组数据的预后预测
研究者利用从HC区域和BG区域收集的空间转录组数据来训练多种机器学习模型,包括梯度提升机、通用线性模型、深度神经网络和随机森林。HC区域由于被AI工具识别为与病程进展和患者预后密切相关,因此预计含有更具代表性和预测价值的生物标记。发现使用HC区域数据训练的模型在预测患者预后方面的准确性显著高于仅利用BG区域数据训练的模型,表明HC区域的转录组特征能更有效地反映患者的疾病状态和预后,突显了AI识别的HC区域在未来临床应用中辨识患者群体和指导治疗决策的潜力。通过这种方法,研究者能够在分子水平上识别出哪些肿瘤区域是真正影响患者预后的关键区域,进而帮助医生和研究人员更精准地理解和应对高级浆液性卵巢癌这一复杂疾病。此外,这些发现还有助于进一步优化个体化的治疗方案,通过精准医疗提高治疗效果,最终提升患者的生存率和生活质量。
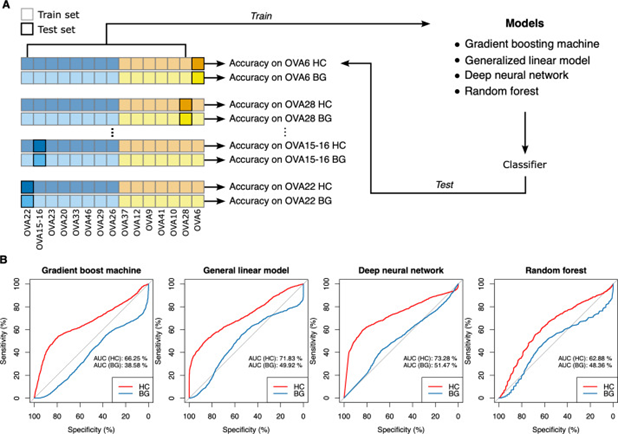
图3. 利用HC或BG区域的转录组数据预测患者结果。
3. AI检测的HC区域中的差异基因表达
研究者通过对HC区域与背景BG区域间的转录组数据进行差异表达基因(DEGs)分析,探寻与HGSC的疾病严重程度相关的基因表达变化。结果显示,在预后不良的患者中,某些关键基因如JUN表现出显著上调。JUN基因表达的增加与细胞增殖、存活和抗凋亡机制直接相关,是肿瘤侵袭性和治疗抗性的关键因子。JUN在HGSC中的显著上调可能提示其在肿瘤细胞中扮演重要角色,特别是在化疗药物抵抗性的形成过程中。研究还发现,与预后良好的HC区域相比,预后不良的HC区域在分子层面显示出不同的表达模式。这一差异不仅有助于理解HGSC的生物学机制,也为开发新的治疗策略提供了可能。因此,这一部分的研究结果不仅强调了AI技术在识别与疾病严重程度相关的关键肿瘤区域的有效性,还提供了针对HGSC潜在新治疗靶点的重要见解,为未来的临床应用和治疗开发指明了方向。
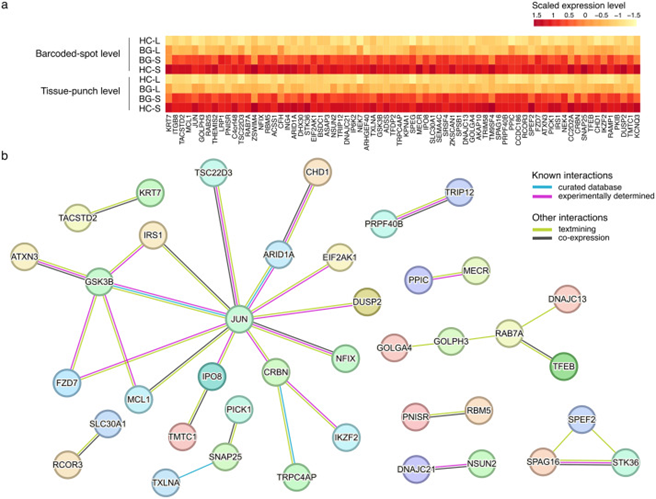
图4. 差异基因表达
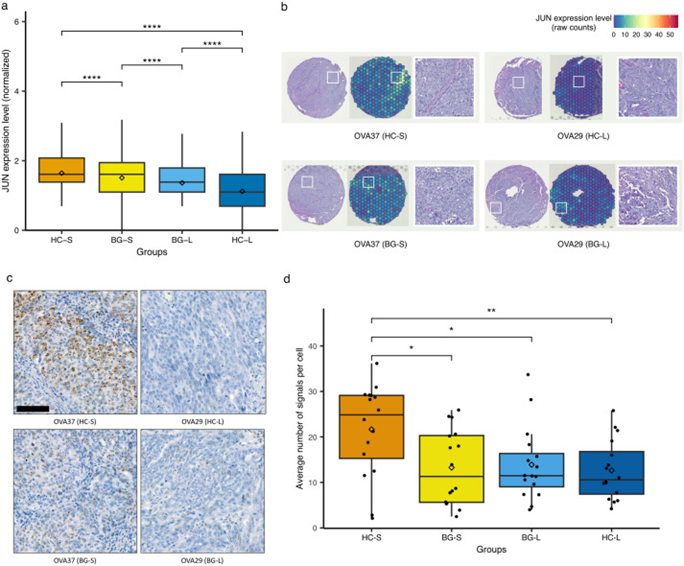
图5. JUN在不同结果组中的表达
4. 通路功能分析
通过基因集富集分析(GSEA)对比了短化疗反应时间和长化疗反应时间的HGSC患者群体中活跃的生物学通路。结果表明,在预后不良的患者的HC区域中,与细胞应激反应相关的通路被显著激活。这些通路包括与细胞应对DNA损伤和氧化压力的反应有关的通路。这类通路的激活可能与肿瘤细胞为适应化疗压力而激发的防御机制有关。相反,对于预后较好的患者,发现细胞周期控制和DNA修复通路被激活。这些通路的激活有助于维持细胞的基因稳定性和防止癌变,这可能是这些患者能够更好响应化疗和拥有较长生存时间的原因。这些发现为深入理解HGSC在不同患者中化疗反应差异的分子机制提供了新的见解,强调了个性化医疗在治疗策略中的重要性。通过识别与化疗反应密切相关的生物通路,未来的治疗可能更加针对性地调节这些通路,以提高治疗效果和患者的生存率。
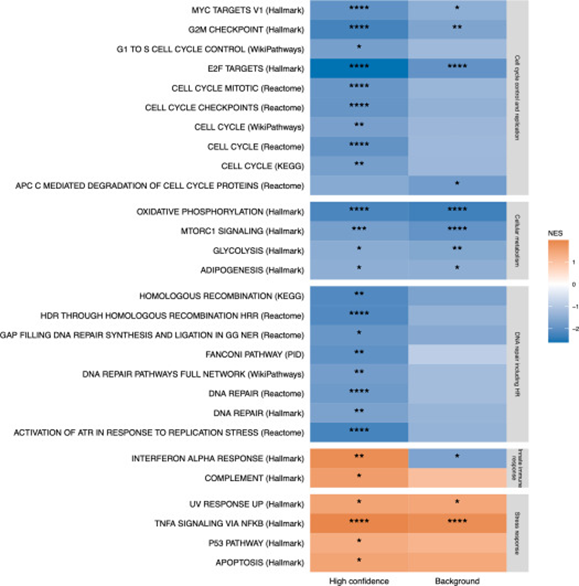
图6. HC与BG区域的基因集富集
5. 空间组织中细胞类型的分布和相互作用
研究者使用了cell2location工具来评估不同化疗自由间隔(PFI)患者组织中的细胞类型比例,并应用了MISTy分析方法来揭示不同预后区域中的细胞类型组成模式。通过这种方法,研究者能够深入探究HGSC中细胞的空间分布和相互作用如何影响疾病的进程和患者的预后。研究发现,在预后较好的HC区域中,一种具有DNA修复特征的上皮细胞亚型与巨噬细胞和浆细胞之间存在明显的相互作用模式。这种相互作用模式表明,这些区域的细胞微环境可能有助于维持组织的稳定性和功能性,从而提高了对化疗的响应性和患者的长期生存率。这些细胞相互作用模式的识别不仅为理解HGSC的复杂肿瘤微环境提供了重要的生物学信息,还可能指导未来的疾病管理策略,例如通过调节特定细胞类型的相互作用或功能来优化治疗效果。此外,这种细胞相互作用的深入理解还有助于开发新的靶向治疗策略,可能通过改变肿瘤微环境中的细胞组成或功能来提高患者的生存率。
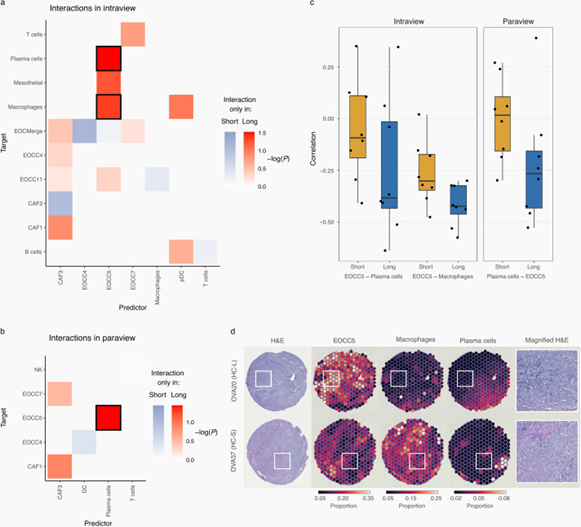
图7. HC区域中的条件特异性细胞类型相互作用。
主要结论
本研究展示了AI与空间转录组学结合在HGSC中的应用,明确了这些技术在识别与治疗反应相关的肿瘤区域中的重要性。通过深度学习模型,能够识别出预后与化疗反应密切相关的高可信区域,这些区域在基因表达上与背景区域显著不同,提供了新的生物标志物和治疗靶点。此外,机器学习模型基于这些数据提高了预后预测的准确性。通过分析差异表达的基因和相关的生物通路,揭示了影响化疗效果的关键分子机制,尤其是在预后不良的患者中细胞应激反应通路的活化以及在预后良好的患者中细胞周期控制和DNA修复通路的活化。最终,通过分析细胞间的相互作用,进一步了解了肿瘤微环境如何影响治疗响应。这些结论为未来的临床应用提供了有价值的洞见,指明了通过调整治疗策略来优化治疗效果的可能路径。

