用阵列式SPR传感器ProteOn XPR36系统进行抗体开发和研究
2010-01-12 来源:Bio-Rad 点击次数:6773 现在Bio-Rad公司推出的一种新型阵列式SPR生物传感器技术有望彻底打破现有方法的各种瓶颈,做到较高通量的基础上同时获得浓度、亲和力以及反应动力学等相关数据。这种新型阵列式SPR生物传感器叫ProteOn XPR36系统。如下图所示,它具有可90°旋转的6通道流动池,可在芯片上产生纵向或者横向的通道各6条。首先,流动池旋转成纵向,在纵向的6个通道里可以标记最多6种不同的ligand在芯片上,随后流动池旋转90°变成横向,流过6个analyte,当analyte溶液接触原先标记的ligand时发生的相互作用即可被检测并记录下来。通过这样的分析方式可以实现高通量平行分析。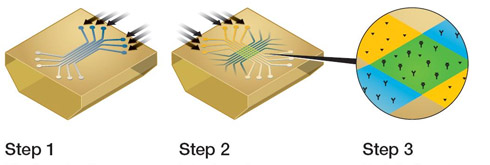
使用ProteOn XPR36系统进行抗体筛选和优化,Bio-Rad公司给出了一个完全不同于传统方法的新工作流程,如下图所示。
第一步,横向6个通道上标记捕获试剂,即可以和单抗结合的分子,如Anti-mouse IgG、Protein A/G等,如果筛选抗体Fab段,可以标记Anti-(Fab’)2。标记完成后,通道旋转90°变成纵向,进入第二步。
第二步是从细胞培养液中捕获单抗,一次最多流过6个克隆。如果表达有单抗,仪器会显示出一条向上的曲线,并且浓度越高,曲线上升得越快。如果定义了标准曲线,可以把浓度数值算出来。这一步完成后,抗体或抗体片段就结合在了捕获试剂上。
第三步,通道再转回横向,流过5个不同浓度的抗原分子加一个缓冲液作为阴性对照。这一步可以得出下图右下方所示的6幅动力学反应曲线,分别代表6个克隆的单抗和抗原反应的结果,我们可以据此计算出6个抗体和抗原的动力学数据和亲和力常数。
第四步,用磷酸或pH2.0的甘氨酸溶液再生,把抗原连同抗体一块儿从捕获试剂上洗下来,为检测下一批单抗做准备。
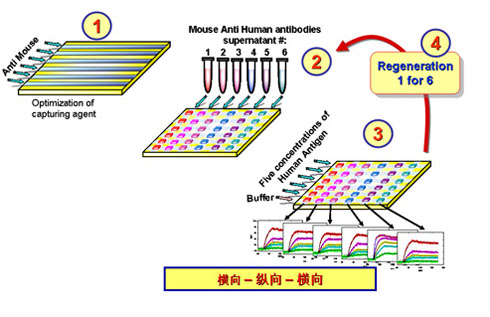
按照这一流程,每个循环可以测定6个克隆的表达水平和动力学数据。当所有克隆都检测完毕后,我们可以绘制一张包含所有克隆的动力学分布图,如下图所示。
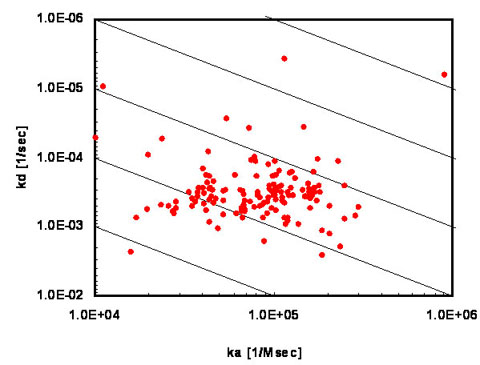
上图纵坐标代表解离速率常数(koff),横坐标代表结合速率常数(kon),斜线是等亲和力线,也就是说分布在同一条等亲和力线上的克隆亲和力是一样的。我们可以根据需要挑选特定区域内的克隆,然后进行抗体特性分析。
这一流程的好处是初步筛选得到大量的抗体信息,基本不需要再挑克隆进行第二步筛选就可以直接把我们需要的克隆挑出来纯化或者进行进一步分析,确定其亚型、抗原识别表位等。
有人也许会问一些问题,现在就这些问题回答如下:
1.这样做一天能筛选多少克隆?
答:200个左右。这个数字听起来似乎令人沮丧,但别忘了,这是包含大量信息的筛选,一步能顶传统方法多步的工作,其实更省时间。
2.需要耗费的捕获试剂和抗原量很多吗?
答:一点也不多,捕获试剂大约消耗数微克,抗原消耗则需要根据筛选的克隆数来定,如果筛1000个克隆,抗原消耗通常不超过1毫克。
3.整个流程的成本高吗?
答:一点也不高,只需一块芯片就能完成上千克隆的筛选,和其它消耗加在一起的总成本只比ELISA高一点。如果考虑传统方法筛选完成后可能还需测定动力学数据,其实这样做的成本会更低

