标准细胞冷冻、解冻方法指南-–实现重现性更高的细胞复苏结果
2021-06-24 来源:本站 点击次数:6954摘要
在细胞研究和生产的各个领域,将冷冻的细胞解冻是一项必不可少的操作,但在一些情况下这一操作要素被低估了。超低温保存过程的标准化 — 包括标准化的细胞解冻方案 — 有助于最大限度地保证细胞冻存效果,从而获得既可重现又可靠的结果。
内容概览
> 简介
> 如何解冻细胞
> 细胞解冻方法
> 选择解冻方法前的注意事项
> 总结
简介
在细胞生物学中,细胞的冷冻和解冻一直是其中一项标准技术。这一过程也被称为超低温保存,能够有效地停止细胞衰亡,因为这一过程允许几乎近似的细胞批次在数月、数年甚至数十年之后使用(图 1),可大幅提高在不同时间进行的实验的重现性,还有助于节省时间、资源和成本 [1]。
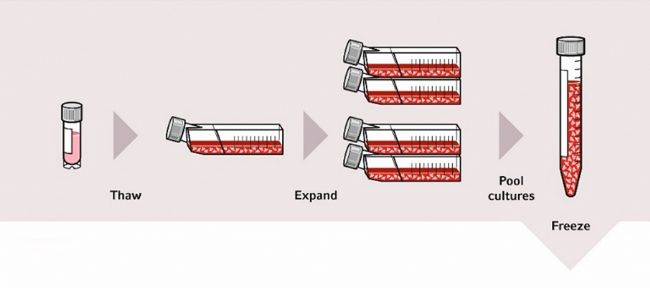
图 1: 二级细胞库系统概要示意图:建立主细胞库和工作细胞库,包括最低传代所需细胞的超低温保存,是一种良好的细胞培养方法
在整个冷冻 - 储存 - 解冻过程中,面临的一项关键性挑战是确保高细胞存活率,或许更重要的是确保超低温保存细胞行为的可预测性和重现性。为此,人们制定了许多不同的指导方针和方案。
在超低温保存过程中,造成细胞死亡的主要原因是胞内冰晶的形成。以错误的方式冷冻时,会在细胞内形成冰晶,这可能会损坏细胞膜和细胞器,从而大幅降低细胞恢复的可能性。
为了帮助防止形成胞内冰晶,每个细胞冷冻方案都有两项基本要求。第一项基本要求是在冷冻剂中加入低温保护剂,二甲亚砜(DMSO) 或甘油等化合物会穿透细胞膜,这通常会降低培养基的凝固点和玻璃转换温度,从而防止在细胞内形成冰晶 [2,3]。
在超低温保存过程中,造成细胞死亡的主要原因是胞内冰晶的形成。以错误的方式冷冻时,会在细胞内形成冰晶,这可能会损坏细胞膜和细胞器,从而大幅降低细胞恢复的可能性。
为了帮助防止形成胞内冰晶,每个细胞冷冻方案都有两项基本要求。第一项基本要求是在冷冻剂中加入低温保护剂,二甲亚砜(DMSO) 或甘油等化合物会穿透细胞膜,这通常会降低培养基的凝固点和玻璃转换温度,从而防止在细胞内形成冰晶 [2,3]。
第二项要求是缓慢冷却。在 4 到 –70 °C 之间的临界温度范围内,以每分钟 1 °C 的速率冷却细胞悬液通常被视为最适宜于细胞存活,无论是哪种细胞类型 [3]。这是因为,以较慢的速度冷却细胞可确保首先在细胞外部形成低溶质冰晶,从而增加剩余培养基中的溶质浓度,并在渗透作用下排出细胞。这反过来可减少细胞内形成的冰晶 [3]。
在受控冷冻至至少 –70 °C 的温度后,可将冻存管移入液氮储存区(–150 至 –196 °C,图 2)或在 –150 °C 下运行的深低温冰箱内长期保存 [4]。
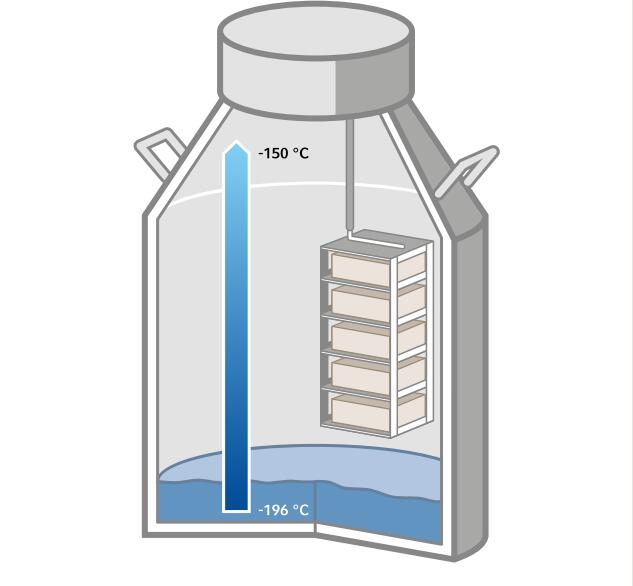
图 2: 建议使用液氮储存区长期储存细胞。
有很多教科书和在线资源中都详细介绍了帮助科学家实现标准化的可靠细胞冷冻的原理和步骤,但是对细胞解冻过程相关的注意事项几乎没有讲解。下文概述了细胞解冻的原理,描述了不同的方法,并讨论了改进细胞解冻方案标准化的注意事项。
如何解冻细胞
冷冻细胞需要以缓慢而可控的速率进行,但是将冷冻的细胞解冻时最好采用较快的速度。细胞周围冰晶的消失不会产生与冰晶形成相同的破坏效应,因此最好尽快使细胞恢复到正常培养条件,以便(对于粘附细胞)能够锚固在表面上。
典型的细胞解冻方案通常是从液氮储存区中取出冻存管开始。在这一步骤中,必须熟悉操作液氮的所有常见预防措施(图 3)[5]。此外,如果冻存管未能正确密封并且储存在液相中,则随着时间的推移,液氮可能会渗入管中,导致在从液氮中取出后不久,管内的压力迅速增大 — 因此,务必佩戴适当的面部防护装置。

图 3: 从液氮储存区收集细胞时应注意防护。
图片来源: Minerva Studio/shutterstock.com
图片来源: Minerva Studio/shutterstock.com
接下来,必须将冻存管解冻。一个常用的经验法则是,在一个含有 1 mL 细胞悬液的标准冻存管中开始解冻细胞时,所有冰晶都会在几分钟内消失,快速加热可防止在解冻过程中出现局部再结晶,否则可能导致细胞损伤 [6]。
有时,由于寻找不同的冻存管所花费的时间或由于液氮储存区的位置等因素,无法在几分钟内完成解冻。在这种情况下,将缓慢解冻和将细胞留在解冻的冷冻剂中超过所需的时间相比,那么冻存管置于尽可能低的温度下然后快速解冻的做法更加可取 [7]。
当所有的冰晶都消失后,需要尽量减小低温保护剂对细胞的任何进一步的不利影响。有两种方法可实现这一点。首先,可以直接培养细胞,例如在方瓶中培养,同时确保用正常培养基将冷冻剂稀释至少 10 倍。或者,也可以用普通培养基稀释冷冻剂,把试管离心,移除培养基,然后在新鲜培养基中重新培养细胞 [1,4,7]。
为了检查细胞解冻方案是否成功,建议测定存活细胞的百分比(例如,使用台盼蓝染色法和细胞计数器) [8]。为了改善标准,最好持续几天观察培养液中的细胞形态或生长速率有无任何异常。生长不良或不一致可能表示细胞制备或超低温保存过程中出现问题,因此早期检测可能有助于减少实验误差。
有时,由于寻找不同的冻存管所花费的时间或由于液氮储存区的位置等因素,无法在几分钟内完成解冻。在这种情况下,将缓慢解冻和将细胞留在解冻的冷冻剂中超过所需的时间相比,那么冻存管置于尽可能低的温度下然后快速解冻的做法更加可取 [7]。
当所有的冰晶都消失后,需要尽量减小低温保护剂对细胞的任何进一步的不利影响。有两种方法可实现这一点。首先,可以直接培养细胞,例如在方瓶中培养,同时确保用正常培养基将冷冻剂稀释至少 10 倍。或者,也可以用普通培养基稀释冷冻剂,把试管离心,移除培养基,然后在新鲜培养基中重新培养细胞 [1,4,7]。
为了检查细胞解冻方案是否成功,建议测定存活细胞的百分比(例如,使用台盼蓝染色法和细胞计数器) [8]。为了改善标准,最好持续几天观察培养液中的细胞形态或生长速率有无任何异常。生长不良或不一致可能表示细胞制备或超低温保存过程中出现问题,因此早期检测可能有助于减少实验误差。

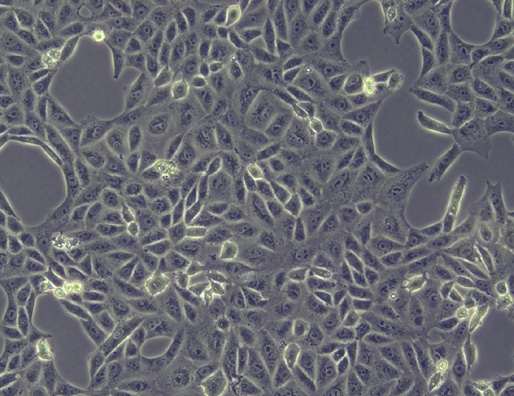
图 4: 观察解冻后培养液中细胞的形态是否异常。
正常(a)和异常(b)的细胞形态示例(Vero细胞, 10 x)
正常(a)和异常(b)的细胞形态示例(Vero细胞, 10 x)

下载“细胞配置文件”模板,清晰、一致地记录培养的重要细节
细胞解冻方法
表 1.不同细胞解冻方法的优缺点概览

在实验室最常用的解冻冷冻细胞的方法可能是使用公用水浴槽(图 4)。水具有良好的导热性,可以保证快速加热,同时也可以防止冻存管内部局部过热。水浴槽也是细胞培养实验室日常使用的标准设备的之一,因此无需额外的准备或投资。
使用水浴槽或任何其他解冻方法加热细胞时,切勿将细胞暴露在高于 37 °C 的温度下。尽管加热过程中的温度总变化可能超过 200 °C,但如果管内的局部温度超过 37 °C,这会迅速诱发不良影响,甚至是细胞死亡 [9]。
然而,水浴槽的一个主要缺点是水和样品接触可能造成污染。由于水位、持续检查冻存管的需要以及搅拌样品以防止产生温度梯度的要求,在解冻过程中很难保持冻存管顶部的干燥 [6]。

手动加热
通过手动加热冻存管将细胞解冻是一种广受欢迎的方法,因为它不需要任何设备,主体温度与水浴槽相似,而且使用户能够连续监测并轻柔摇动冻存管。但必须注意,与将冻存管浸没在水中相比,传热效率要低得多,变数也很多,这使得手动加热冻存管的速度可能较慢,重现性也较低。
同时解冻两个以上的冻存管时,手动加热也不实用,还会导致冷却速率减慢。此外,将皮肤暴露在接近–196 °C 的温度下,即使佩戴了丁腈手套也会造成严重伤害。出于这些原因,不建议进行手动加热。
同时解冻两个以上的冻存管时,手动加热也不实用,还会导致冷却速率减慢。此外,将皮肤暴露在接近–196 °C 的温度下,即使佩戴了丁腈手套也会造成严重伤害。出于这些原因,不建议进行手动加热。

金属珠浴恒温箱
当加热细胞培养基或在培养箱外保持培养液的温度时,可以使用金属珠浴恒温箱代替水浴槽。但是,与手动加热或空气加热(例如在培养箱中)类似,珠子并不具备水浴槽的高效传热能力,因为与容器接触的表面积较小,导致无法可靠地或足够快速地解冻细胞。通常情况下推广使用珠浴恒温箱,因为珠浴恒温箱不需要换水,但随着时间的推移,灰尘和溢出物的积聚就需要清洁和重新安装,以防止污染。
选择解冻方法前的注意事项
实验室特有的注意事项
比较不同的细胞解冻方法时,不可避免地要考虑到许多实验室特有的注意事项。其中一个要注意的事项是在洁净室进行细胞培养时。在这种环境下,水浴槽可能成为空气污染的来源,因此应考虑采用替代方法 [10]。
影响解冻方法选择的另一个具体情况是,在细胞培养实验室中工作时,需要记录和跟踪每一个工作步骤,或者需要保持恒定的加热速率 [6,11]。当然,在选择使用现有设备或使用专用装置进行细胞解冻时,可用的实验室设备预算具有关键性的影响。
影响解冻方法选择的另一个具体情况是,在细胞培养实验室中工作时,需要记录和跟踪每一个工作步骤,或者需要保持恒定的加热速率 [6,11]。当然,在选择使用现有设备或使用专用装置进行细胞解冻时,可用的实验室设备预算具有关键性的影响。
专用装置
在过去的十年中,一些制造商开发了可以不使用水浴槽而实现所需的快速加热解冻的专用装置。大多数装置都是专为冻存管设计的,当然也有可以处理更大体积的系统。专用装置可以设置程序执行解冻过程。在对解冻过程的标准化和文档化有更高要求的情况下,这将带来许多好处。这些装置也非常适合于不能实行水浴加热的情况 [6]。专用解冻装置最重要的缺点是需要前期投资。水浴槽解冻通常不需要额外的投资,而专用的解冻设备增加了细胞培养工作流的额外成本。另外,有些装置一次只能解冻一个冻存管,导致可能与某些细胞培养方案不相容。
细胞解冻的标准化
不管选择哪一种方法,标准化都会大幅改善结果 — 无论是在监管环境下工作还是基础研究。例如,保持一致的细胞存活率可以减少解冻过量细胞的需要,从而可确保拥有足够的细胞储备,当细胞量较少时这就尤为重要。
方案标准化也会影响细胞在平板培养后的行为。例如,当长时间暴露于 DMSO 时,一些类型的细胞更有可能发生分化 [12]。因此,冷冻或解冻方案的变化可能会导致超低温保存后细胞表型的差异和结果的变化。
方案标准化也会影响细胞在平板培养后的行为。例如,当长时间暴露于 DMSO 时,一些类型的细胞更有可能发生分化 [12]。因此,冷冻或解冻方案的变化可能会导致超低温保存后细胞表型的差异和结果的变化。
细胞类型特定的注意事项
有许多冷冻和解冻方面适用于所有细胞类型,但必须注意,一些方面可能因某些细胞类型而异,因此应尽可能使用适合特定细胞类型的解冻方案。许多商业细胞系已经过全面的研究并且优化了超低温保存方案,但对于不常见的细胞类型,建议进行文献检索或进行小规模的优化研究。
每种细胞类型的细胞解冻都各不相同,需要密切关注细胞恢复正常生长和正常响应刺激物所需的时间。例如,如果增殖速率是研究的一个关键参数,很重要的一点是,不要从尚未完全从解冻过程中恢复的细胞开始实验 — 因为不同类型的细胞之间可能存在较大差异。比如,当测量特定蛋白的表达时,细胞需要完全恢复产生这种蛋白的能力 [7]。
总结每种细胞类型的细胞解冻都各不相同,需要密切关注细胞恢复正常生长和正常响应刺激物所需的时间。例如,如果增殖速率是研究的一个关键参数,很重要的一点是,不要从尚未完全从解冻过程中恢复的细胞开始实验 — 因为不同类型的细胞之间可能存在较大差异。比如,当测量特定蛋白的表达时,细胞需要完全恢复产生这种蛋白的能力 [7]。
为了在细胞培养实验室获得一致的结果,务必在细胞培养的每一步实现高水平的标准化。细胞解冻有多种不同的方法可供使用 — 在设定可靠数据和可靠产品的正确标准时,选择适合每种特定的细胞类型、实验室或应用的细胞解冻方案是关键。
参考文献
[1]https://www.lgcstandards-atcc.org/Documents/Marketing_Literature /Animal_Cell_Culture_Guide/Cryopreservation.aspx

[3] Oishi, K et al. Cryopreservation of Mouse Adipose Tissue-Derived Stem/Progenitor Cells.
Cell Transplantation 2008; 17: 35–41.
[4] https://www.lgcstandards-atcc.org/How_to_Revive_Cultures.aspx
[5] https://www.labmanager.com/lab-health-and-safety/keeping-cool-under-pressure-5552
[6] Hunt, CJ. Technical Considerations in the Freezing, Low-Temperature Storage and Thawing of Stem Cells for Cellular Therapies. Transfusion Medicine and Hemotherapy 2019; 46: 134–149.
[7] Baust, JM et al. Best practices for cryopreserving, thawing, recovering, and assessing cells.
In Vitro Cellular & Developmental Biology – Animal 2017.
[8] Strober, W. Trypan Blue Exclusion Test of Cell Viability. Current Protocols in Immunology 2019.
[9]https://www.biocompare.com/Editorial-Articles/358505-Cryopreservation-Freezing-Solutions
[10] https://www.news-medical.net/life-sciences/What-are-Cleanrooms.aspx
[11]https://www.bioprocessonline.com/doc/cell-thawing-are-you-risking-gmp-compliance-with-the-water-bath-method-0001
[12] Best, BP. Cryoprotectant Toxicity: Facts, Issues, and Questions. Rejuvenation Research 2015; 18(5): 422–436.
相关文章
更多 >

