Nature:Biospace高端小动物活体成像系统助力肿瘤干细胞研究
2023-06-13 来源:本站 点击次数:1990
癌症干细胞(Cancer Stem Cells,CSCs),又称癌干细胞、肿瘤干细胞,是指具有干细胞性质的癌细胞。通常这类的细胞被认为有形成肿瘤,发展成癌症的潜力,特别是随着癌症转移后,产生新型癌症的来源。癌干细胞存在于癌细胞中,是癌症复发和转移的“元凶”。由于存在数量极少,因此很难被发现。在大多数恶性肿瘤中,仍然缺乏结论性的实验证据来证明它们的功能相关性。
结直肠癌的发展是由于特定基因的改变,包括肿瘤抑制因子如APC、TP53和SMAD4的功能丧失,以及致癌基因如KRAS2的激活突变。在这些肿瘤中,只有一小部分细胞具有致瘤潜能,即CSCs,其被认为是肿瘤的克隆生成核心,可以通过特定的标记物来识别,包括富含亮氨酸的重复序列g蛋白偶联受体5 (LGR5)。
Felipe等人在国际顶尖期刊Nature发表了题为“A distinct role for Lgr5+ stem cells in primary and metastatic colon cancer”的文章,该文章的实验数据提供了对Lgr5标记的CSCs进行了全面分析,包括它们在肿瘤起始、生长和转移中的作用。 
为了研究Lgr5+ CSCs在转移过程中的重要性,作者在肿瘤类器官(红色荧光)植入结肠粘膜两周后开始DT治疗,DT治疗三周后,分析了原位肿瘤负荷相当的动物肝脏组织。值得注意的是,尽管DT治疗没有损害肿瘤细胞侵袭粘膜下层的能力,但生物发光成像和组织病理学分析均显示肝脏转移负担大幅减少。此外,酶解肝脏的免疫染色和荧光活化细胞分选(FACS)分析显示,DT治疗后红色荧光的肿瘤细胞的绝对数量显著减少。证实了CSCs在转移起始中起着重要的作用。
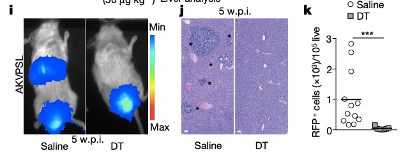
另外,作者还评估了Lgr5+ CSCs对维持已建立的肝转移的需求。在没有原发肿瘤的情况下,将类器官直接注射到门静脉导致肝转移的形成。值得注意的是,DT治疗大大减轻了肝脏中的肿瘤负担,在最后一次给药后两周内几乎没有发现肿瘤转移的证据。对照组小鼠的肝脏显示出广泛的转移灶,而dt治疗动物的残留疾病仅限于偶尔的转移灶。强调了CSCs在原发肿瘤的维持和肿瘤初始转移中的功能贡献。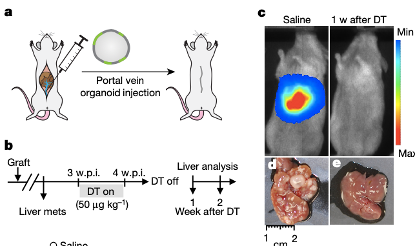
文中作者使用了法国Biospace Lab公司的PhotonIMAGER Optima来进行体内肿瘤的光学成像,清晰的记录了肿瘤的转移过程及其在体内的分布。法国Biospace Lab公司的PhotonIMAGER Optima小动物活体光学成像系统,是全球唯一可实现清醒动物成像的活体光学成像系统。得益于第三代增强型CCD (Intensified CCD, ICCD)的采用,在超高分辨率二维成像基础上,可进行实时采集和实时定量成像、完全清醒动物成像。特殊的设计使其具有4-View成像功能,并进而实现三维光学成像。除此之外,还可以升级X-ray成像、Macrolens微聚焦放大、Tomofluo激光精确断层扫描成像等功能,实现多模块多功能成像。
Biospace高端小动物活体成像系统
原文链接:https://www.nature.com/articles/nature21713
结直肠癌的发展是由于特定基因的改变,包括肿瘤抑制因子如APC、TP53和SMAD4的功能丧失,以及致癌基因如KRAS2的激活突变。在这些肿瘤中,只有一小部分细胞具有致瘤潜能,即CSCs,其被认为是肿瘤的克隆生成核心,可以通过特定的标记物来识别,包括富含亮氨酸的重复序列g蛋白偶联受体5 (LGR5)。
Felipe等人在国际顶尖期刊Nature发表了题为“A distinct role for Lgr5+ stem cells in primary and metastatic colon cancer”的文章,该文章的实验数据提供了对Lgr5标记的CSCs进行了全面分析,包括它们在肿瘤起始、生长和转移中的作用。


另外,作者还评估了Lgr5+ CSCs对维持已建立的肝转移的需求。在没有原发肿瘤的情况下,将类器官直接注射到门静脉导致肝转移的形成。值得注意的是,DT治疗大大减轻了肝脏中的肿瘤负担,在最后一次给药后两周内几乎没有发现肿瘤转移的证据。对照组小鼠的肝脏显示出广泛的转移灶,而dt治疗动物的残留疾病仅限于偶尔的转移灶。强调了CSCs在原发肿瘤的维持和肿瘤初始转移中的功能贡献。

文中作者使用了法国Biospace Lab公司的PhotonIMAGER Optima来进行体内肿瘤的光学成像,清晰的记录了肿瘤的转移过程及其在体内的分布。法国Biospace Lab公司的PhotonIMAGER Optima小动物活体光学成像系统,是全球唯一可实现清醒动物成像的活体光学成像系统。得益于第三代增强型CCD (Intensified CCD, ICCD)的采用,在超高分辨率二维成像基础上,可进行实时采集和实时定量成像、完全清醒动物成像。特殊的设计使其具有4-View成像功能,并进而实现三维光学成像。除此之外,还可以升级X-ray成像、Macrolens微聚焦放大、Tomofluo激光精确断层扫描成像等功能,实现多模块多功能成像。

Biospace高端小动物活体成像系统
原文链接:https://www.nature.com/articles/nature21713
相关文章
更多 >

