Nature:自私基因促进玉米的驯化和多样性
2024-09-10 来源:本站 点击次数:1692自私的基因最早由英国生物学家理查德·道金斯(Richard Dawkins)在其1976年出版的著作《自私的基因》中提出。该理论认为,基因是自然选择和进化的基本单位,其通过影响个体的行为和生理特征来提高自身的生存和繁殖概率。最新的遗传研究证明,这种自私的遗传因子常造成杂交不亲和,偏倚或“驱动”它们自身的传递。众所周知,通过杂交引入遗传变异可以提高后代对环境的适应性,但不同基因组的组合经常造成杂交不育或衰退,Bateson-Dobzhansky-Muller (BDM) 模型将这种症状归因于不同种群中有害突变的相互作用,至少部分不兼容性源于由自私遗传元素触发的基因组内冲突。这一过程是通过自私的遗传因子对减数分裂的影响产生效应的。染色体水平的驱动通常发生在不对称的雌性减数分裂中,而基因驱动通常发生在减数分裂后,且主要出现在雄性配子中。由于这些自私的遗传因子经常影响育性和适应性,因此在进化过程中具有较高的选择压,因此尽管驱动系统已经被广泛预测存在,但大多数驱动系统仍处在未知状态,缺少明确的实验证明其机制及如何通过遗传连锁影响种群的基因分布。
近期,冷泉港实验室 Robert A. Martienssen团队发现一个来自于大刍草中名为“Teosinte Pollen Drive”(TPD)的基因,在玉米(Zea mays ssp. mays)和其野生近缘种墨西哥大刍草(Z. mays ssp. mexicana)杂交后代中依赖于RNA干扰(RNAi)的基因驱动实现自私基因传递的实例。该文章题为“Teosinte Pollen Drive guides maize diversification and domestication by RNAi”。研究通过对TPD系统单分子和单花粉基因组测序描述了玉米与大刍草杂交过程中的基因驱动,证明了来自大刍草的非编码小RNA依赖于Dicer-like 2(Dcl2),并靶向玉米驱动响应基因1(Tdr1),该基因编码一种对花粉活力至关重要的脂肪酶。Dcl2、Tdr1和发夹在染色体5上紧密连锁,但仅在雄性传递时才表现出作用。同时,揭示了TPD在玉米传播和驯化过程中的作用。

首先,研究人员通过遗传分析发现,存在两个负责花粉活性的非连锁位点,且仅通过花粉遗传给后代(图1)。与此同时,TPD中的减数分裂进程直到四分体阶段都是正常的,之后花粉粒才停止发育。通过对两个纯合的TPD株系(BC8S3 and BC5S2)以及TPD单个活性花粉粒进行基因组测序发现,5在号和6号染色体上可以重复检测到基因渗入区段 (图1 h,i)。于是,将两个位点命名为TPD1和TPD2。
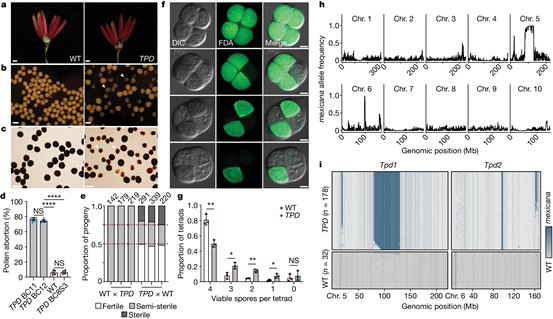
图1 回交系及单花粉测序揭示TPD自私的遗传模式
进一步的遗传分析以及混池测序显示,TPD1是“毒害”花粉的罪魁祸首。TPD不同寻常的遗传方式让研究者想到之前描述的一种通过减数分裂后配子杀死作用的自私遗传因子。这些基因通常编码一种毒素,它反式调控的方式,破坏正常的生殖发育。只有含有细胞自主解毒剂的配子才在配子体中抑制毒性效应。通过对TPD1;TPD2基因型的BC8S3幼苗基因组从头组装,结合单花粉测序数据在候选区段鉴定到了10个基因,DCL2基因在保守结构域中存在多个错义替换。DCL2编码一个Dicer-like蛋白,负责22-nt siRNA的合成,并可以与RDR6和SGS3协同产生次级小RNA。
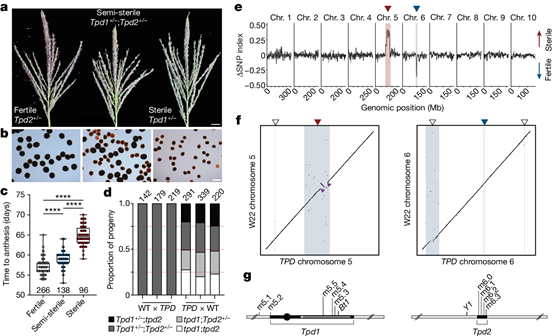
图2 一个从大刍草中转育来的毒素-解毒剂系统被定位在5号和6号染色体上
通过观察DCL2及突变基因的表型发现,22-nt小RNA合成的突变(dcl2-mu1)可以阻止毒素的产生,而次级22-nt小RNA合成的突变体(dcl2T和rgd1)以及可能在小RNA产生起作用的突变体(ago1a和ago1b),则起到了解毒剂的作用(图3)。
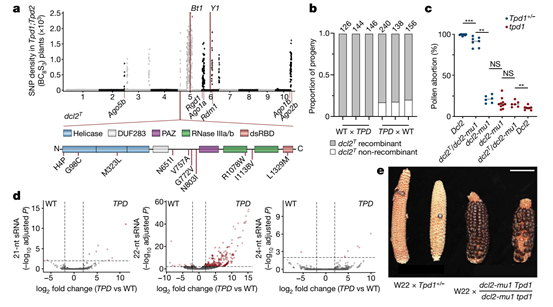
图3 来自于大刍草的Dcl2 是一个与毒性22-nt siRNA连锁的解毒剂
为了进一步鉴定DCL依赖的小RNA的来源以及靶标,研究人员对野生型,dcl2T和dcl2-mu1材料进行了小RNA测序,发现siRNA显著富集在一个编码GDSL 脂肪酶的基因Zm00004b012122(图4)。免疫印记结果显示,GDSL脂肪酶蛋白在野生型的5mm花药和成熟花粉中显著积累,但在叶片以及TPD花药和花粉中缺失,这一结果支持了22-nt siRNAs介导翻译抑制的结论(图5,该蛋白的抗体以及羊抗兔二抗PHY6000由PhytoAB Inc.提供)。GO分析以及基因表达模式分析均显示,GDSL 脂肪酶基因可能是对Tpd1驱动败育的“响应者”。基于所有这些观察,研究者将Zm00004b012122定义为Tpd1毒素活性的主要靶标候选基因,命名为Teosinte drive responder 1 (TDR1)。在此基础上,研究人员利用改进的TPD花粉降解组测序技术,确定了TDR1可能触发沉默的位点,并在TPD1单倍型中找到了能产生触发沉默的siRNA的非编码RNA。
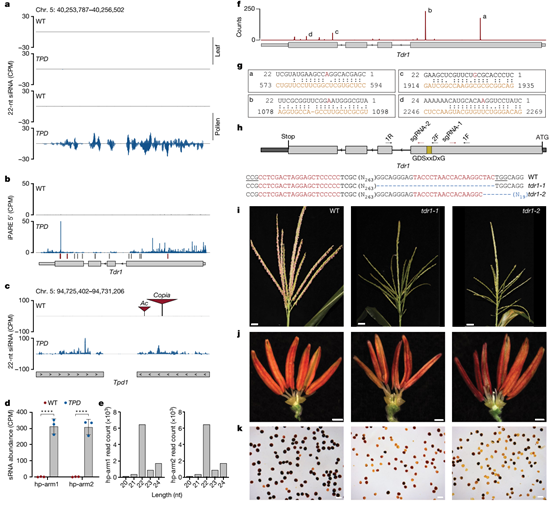
图4 来自于大刍草的 22nt siRNAs 靶向一个必需的花药基因Tdr1
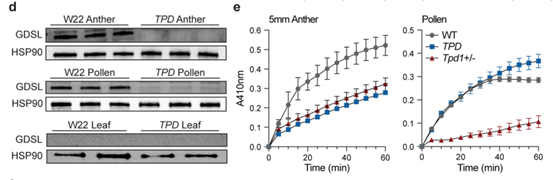
图5 Western检测GDSL蛋白的积累(抗体由PhytoAB公司提供)
基于上述结果,研究人员提出了一个Teosinte Pollen Drive的机制模型(图6):Tpd1编码一个在减数分裂前表达的大刍草特异的发夹结构,它可以产生大量的22nt hp-siRNAs。这些hp-siRNAs在在四分体晚期阶段,通过RDR6和SGS3/RGD1触发次级siRNAs的扩增,进而针对Tdr1进行翻译抑制(红色核糖体)。在存活的小孢子(深黄色背景)中,Tpd2和dcl2T抑制次级siRNAs的加工,恢复蛋白翻译和育性(绿色核糖体)。只有基因型为dcl2T Tpd1; Tpd2的花粉粒是可育的,所有其他竞争的配子都被降解掉。其他RNAi相关基因(Sgs3/Rgd1, Ago1, Ago2, Ago5)可以通过影响siRNAs的水平来作为有部分功能的抑制因子(图6)。
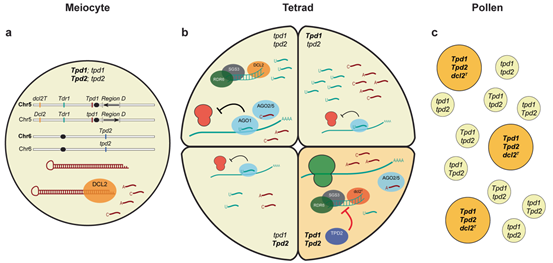
图6 TPD机理模型
最后,进化研究显示,大刍草的基因渗入被认为对玉米在美洲的扩散至关重要(图7)。对传统玉米品种和同域的大刍草的调查显示,在至少四条染色体上,未连锁的RNAi所需基因表现出相关的混合模式,这些基因也在合成杂交体的花粉中受到基因驱动。Teosinte Pollen Drive可能在玉米的驯化和多样化中发挥了重要作用,并为植物和动物精细胞“自私”小RNA的广泛存在提供了解释。
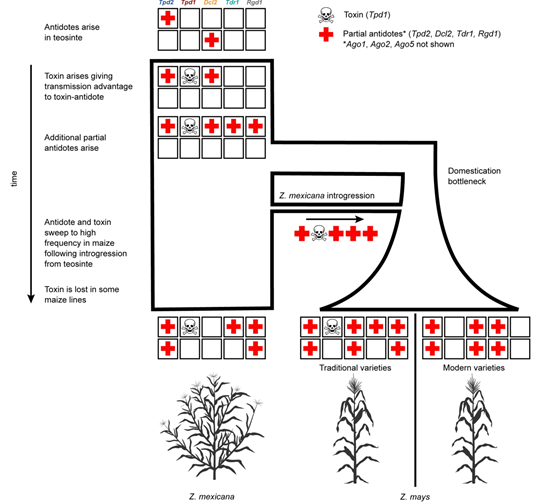
图7 Teosinte Pollen Drive的进化模型:在祖先类蜀黍种群中出现解毒剂之后,Tpd1毒素出现并与解毒剂基因连锁时获得了传播优势。在现存的大刍草和玉米种群中,一些解毒剂被固定下来,而其他一些则具有更广泛的多态性或已经丢失。
超越实验室,PhytoAB抗体改变科研规则
对于全球顶尖科研人员来说,抗体质量的好坏往往决定实验成败。PhytoAB的抗体以其卓越的稳定性、精准的靶向性和一致性,在无数科研项目中扮演了至关重要的角色。科研人员对PhytoAB的信赖并非偶然——每一款抗体都经过严格的筛选和测试,确保在各种实验条件下都能保持高效发挥。
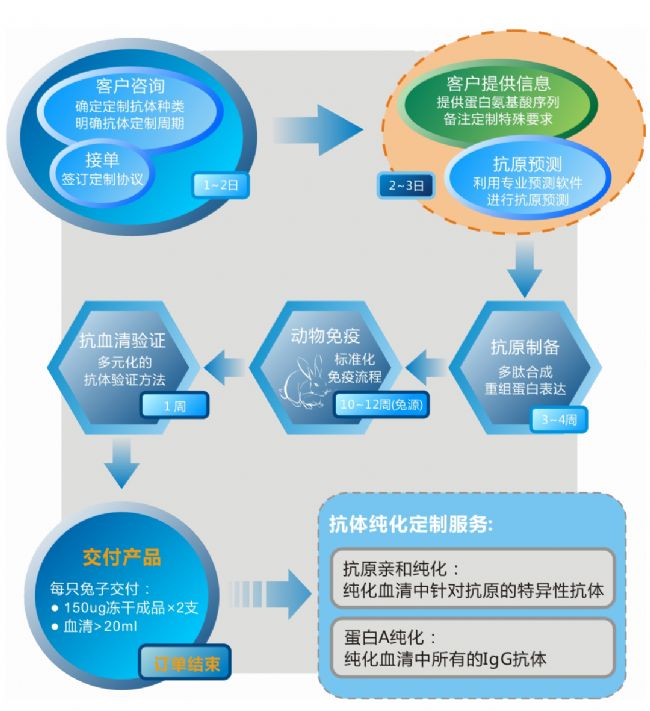
PhytoAB抗体定制流程及周期: