文献解读:首项关联GPCR与铁死亡的研究揭示新型抗铁死亡途径
2024-10-17 来源:本站 点击次数:2394
G蛋白偶联受体(GPCRs)是人类基因组中最大的膜蛋白家族,根据序列和结构相似性可分为五大类,其中,粘附类GPCRs(aGPCRs)作为GPCRs的第二大类,在调节细胞功能和介导许多生理过程中发挥关键作用。近日,有研究发现aGPCRs参与了铁死亡的调控。
铁死亡(Ferroptosis)是一种铁依赖性的调节性细胞死亡形式,由过度的脂质过氧化所引起,与神经系统疾病、肿瘤(特别是乳腺癌、弥漫性大B细胞淋巴瘤)、缺血再灌注损伤、肾损伤、动脉粥样硬化、糖尿病、心脏病以及多种肝损伤相关疾病有关。
2024年10月9日,山东大学初波教授研究团队,孙金鹏教授团队,于晓教授团队,联合东南大学的柴人杰教授和山东大学齐鲁医院徐云飞教授团队,在 Cell Metabolism 发表了题为:Sensing steroid hormone 17a-hydroxypregnenolone by GPR56 enables protection from ferroptosis-induced liver injury 的研究论文。
研究揭示了 17-OH PREG-GPR56 轴介导的信号传导作为一种新的抗铁死亡途径,维持肝脏稳态,为肝损伤的潜在治疗提供了新的见解,并筛选发现 17-OH PREG(17α-羟基孕烯醇酮) 可作为GRP56的激动剂,能够抵抗铁死亡,有效减轻肝损伤。研究还使用了TargetMol的 Sulfosuccinimidyl oleate sodium 以及 CCK-8,让我们一起跟随 T 仔来看看吧~
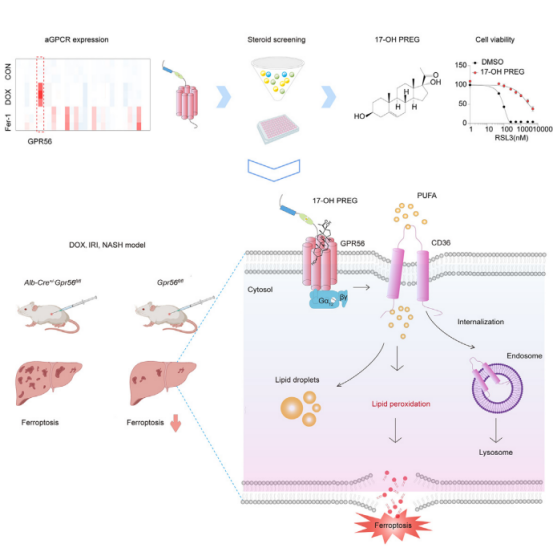
▲研究概览
新型铁死亡抑制因子——GPR56
该团队首先在 阿霉素(DOX)诱导的小鼠肝损伤模型中检测了 DOX 处理后 aGPCR 的 mRNA 水平。发现,三种 aGPCR——GPR56、GPR64 和 GPR97 的 mRNA 水平迅速上升,铁死亡标志物 Ptgs2 的 mRNA 水平显著升高。其中,GPR56 缺失加剧了 DOX 诱导的脂质过氧化和铁死亡,铁死亡抑制剂 Ferrostatin-1(Fer-1)的使用能逆转这一现象。
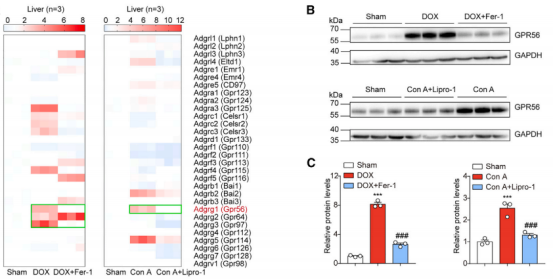 ▲在小鼠肝脏中,aGPCRs 的 mRNA 表达水平以及不同情况下GPR56表达情况的蛋白质印迹分析
▲在小鼠肝脏中,aGPCRs 的 mRNA 表达水平以及不同情况下GPR56表达情况的蛋白质印迹分析
进一步,通过在易感铁死亡的人纤维肉瘤 HT1080 和肝癌 SNU-387 细胞系中进行 aGPCR cDNA 文库筛选,结果显示过表达 GPR56 显著保护细胞免受 Erastin/RSL3 诱导的铁死亡,而其他 aGPCRs 没有表现出类似效果。
此外,GPR56 敲除实验进一步验证了 GPR56 作为铁死亡抑制因子的作用。无论是敲低 GPR56/补充 GPR56 拮抗剂 Deguelin 均会使细胞对铁死亡更加敏感。
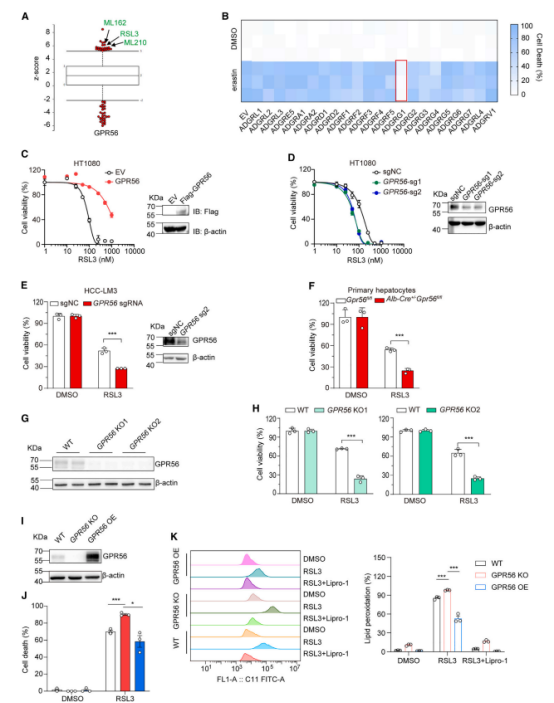
(B) 测量表达空载体或 aGPCR 载体的 HT1080 细胞在处理了 1 mM erastin 24 小时后的细胞死亡情况(n = 3)。
(C) 表达空载体或 GPR56 载体的 HT1080 细胞在处理了不同浓度 RSL3 后的细胞活力(n = 3)。
(D) 表达 GPR56 sgRNA 的 HT1080 细胞在处理了不同浓度 RSL3 后的细胞活力(n = 3)。
(E) 表达 GPR56 sgRNA 的 HCCLM3 细胞在处理了 5 mM RSL3 12 小时后的细胞活力(n = 3)。
(F) 从 Gpr56fl/fl 小鼠或 Alb-Cre+/Gpr56fl/fl 小鼠分离的原代肝细胞在处理了 500 nM RSL3 16 小时后的细胞活力(n = 3)。
(G) HT1080 WT 和 GPR56 KO 细胞中 GPR56 的免疫印迹分析。
(H) 在处理了 100 nM RSL3 24 小时后的 HT1080 WT 和 GPR56 KO 细胞的细胞活力(n = 3)。
(I) HT1080 WT、GPR56 KO 和转染了 GPR56 载体的 GPR56 KO 细胞中 GPR56 的免疫印迹分。
(J 和 K) 转染了空载体或 GPR56 载体的 HT1080 WT 和 HT1080 GPR56 KO 细胞的细胞死亡(J)和脂质过氧化(K)测定(n = 3)。
接下来,研究探讨了 GPR56 介导的铁死亡抑制的分子机制。
研究者首先检查了 GPR56 是否影响铁死亡的经典或非经典途径。结果表明,GPR56 的缺失并未调节铁死亡相关基因的状态,且未降低谷胱甘肽(GSH)的水平。此外,GPR56 的缺失对线粒体活动、活性氧(ROS)水平和能量代谢几乎没有影响。
由于脂质代谢是驱动铁死亡的关键因素,它们进一步进行了非靶向脂质组学分析,发现 GPR56 通过促进 CD36 的内吞 - 溶酶体降解的途径,从而降低了含有游离多不饱和脂肪酸(PUFA)的磷脂的丰度,从而有效地抑制铁死亡。
鉴定GPR56激动剂——17-OH PREG
为了寻找能够激活 GPR56 的激动剂,研究团队筛选了一系列类固醇代谢物,最终发现 17-OH PREG 是唯一能够激活 GPR56 的类固醇衍生物。
17-OH PREG 显著抑制铁死亡,并有效消除脂质过氧化反应。即使在缺乏 GPX4 或 FSP1 的细胞中,17-OH PREG 仍表现出强大的抗铁死亡作用。
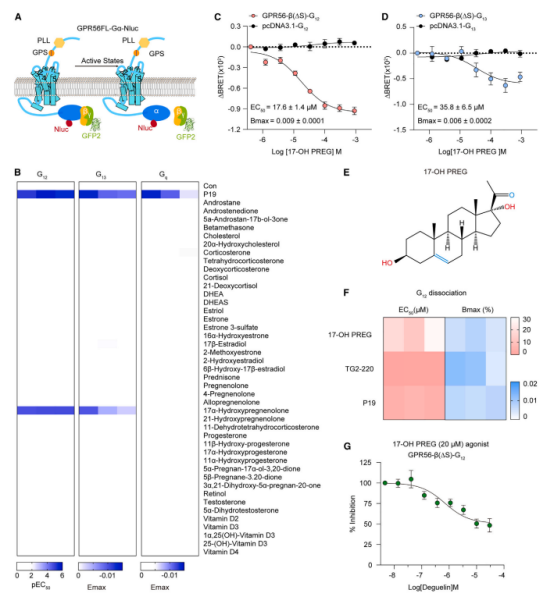
(A) GPR56-G 蛋白融合复合物解离测定的示意图。
(B) 热图表示 GPR56 在 GPR56-b(DS)-G12、GPR56-b(DS)-G13 或 GPR56-b(DS)-Gq 融合蛋白过表达的 HEK293 细胞中对类固醇配体刺激的激活反应,使用 Stachel 肽(P19)作为阳性对照,通过 G 蛋白解离测定获得。热图显示 G12 信号的 EC50(左)、G13 和 Gq 信号的 Emax(中间和右侧,类固醇配体 100 μM)。热图是根据图 S4C–S4I 中的数据生成的(n = 3)。
(C 和 D) GPR56-b(DS)-G12 (C) 或 GPR56-b(DS)-G13 (D) 融合蛋白对 17-OH PREG 的浓度依赖性曲线,使用过表达 pcDNA3.1-G12/13 的 HEK293 细胞作为阴性对照。数值表示均值 ± 标准误差(SEM)(n = 3)。
(E) 17-OH PREG 的化学结构。
(F) 配体诱导的 GPR56 活性的热图表示。热图显示 EC50(左侧)和 Bmax(右侧)值。数据是根据图 S4O 中的数据生成的。
(G) 在 GPR56-b(DS)-G12 融合蛋白过表达的 HEK293 细胞中,20 μM 17-OH PREG 联合刺激下 deguelin 的浓度依赖性曲线。数值表示均值 ± 标准误差(SEM)(n = 3)。
体内实验表明,17-OH PREG 可显著减轻急性和慢性肝损伤。在 DOX 诱导的肝损伤模型中,铁死亡抑制剂 Fer-1 能明显缓解 DOX 诱导的肝损伤,同时,给予 17-OH PREG 的小鼠肝脏中,脂质过氧化水平和组织损伤均大幅降低。然而,在肝脏特异性缺失 GPR56 的小鼠中,17-OH PREG 的保护作用显著削弱,表明其抗铁死亡功能与 GPR56 受体密切相关。在 IR 诱导的肝损伤模型中,17-OH PREG 同样展现出强效的组织保护作用。
实验还发现,即使在 DOX 或 IR 诱导损伤 24 小时后给予 17-OH PREG,仍能显著减轻由铁死亡引发的肝损伤。类似的保护作用在 IR 诱导的急性肾损伤模型中也得到了验证,表明 17-OH PREG 对多种组织损伤具有广泛的保护效果。
此外,研究团队测试了 17-OH PREG 在代谢相关性脂肪肝病(MAFLD)和代谢功能障碍相关性脂肪性肝炎(MASH)中的作用。结果显示,MASH 模型中,17-OH PREG 显著延缓了 MASH 的进展、铁死亡以及肝损伤。相较之下,GPR56 基因敲除的小鼠表现出更严重的脂质积累和肝损伤。进一步分析显示,在 MASH 模型和 MAFLD 患者中,17-OH PREG 和 GPR56 水平显著上调,而 CD36 水平下降,表明 GPR56/17-OH PREG-CD36 轴在 MASH 的进展中起到了关键作用。
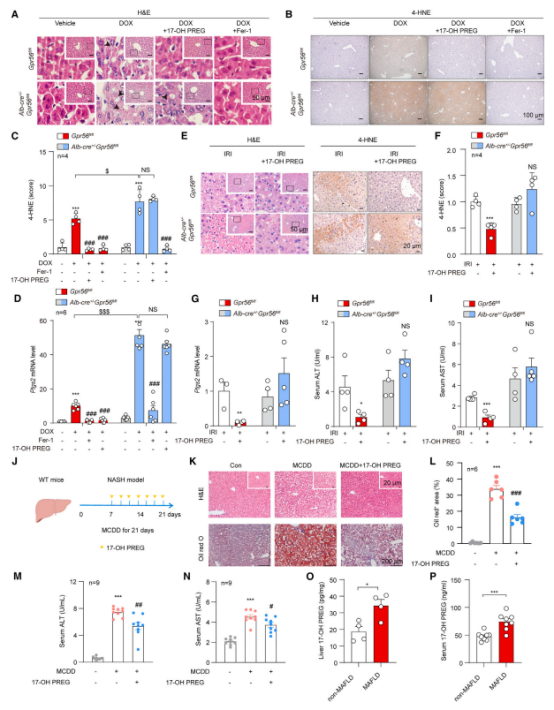
(A) 来自 Gpr56fl/fl 或 Alb-Cre+/Gpr56fl/fl 小鼠在指定处理下的肝脏组织的代表性 H&E 图像。比例尺,50 μm。
(B–D) 代表性的免疫组织化学图像 (B) 和 免疫组织化学评分 (C) 4-HNE 染色(n = 4)以及来自肝脏组织的相对 Ptgs2 mRNA 水平 (D)(n = 6) 的 Gpr56fl/fl 或 Alb-Cre+/Gpr56fl/fl 小鼠在指定处理下的结果。比例尺,100 μm。
(E 和 F) 来自 Gpr56fl/fl 或 Alb-Cre+/Gpr56fl/fl 小鼠在 IR 处理下的肝脏组织的代表性 H&E 图像、免疫组织化学图像 (E) 和免疫组织化学评分 (F) 4-HNE。H&E 图像比例尺,50 μm。4-HNE 免疫化学图像比例尺,20 μm。每组 n = 4 只小鼠。
(G–I) 相对 Ptgs2 mRNA 水平 (G) 和来自 Gpr56fl/fl 或 Alb-Cre+/Gpr56fl/fl 小鼠肝脏组织的相对血清 ALT (H) 或 AST (I) 水平。每组 n = 3–5 只小鼠。
(J) 在小鼠中进行慢性肝损伤实验的策略示意图,包含指定的处理。小鼠在注射 17-OH PREG 之前先用 MCDD 喂养 1 周,然后每隔一天注射一次 17-OH PREG,并继续喂养 2 周。收集血样和肝脏组织进行分析。
(K) 来自 WT 小鼠在指定处理下的肝脏组织的代表性 H&E 图像(上)和油红 O 染色(下)。H&E 图像比例尺,20 μm。油红 O 染色比例尺,200 μm。
(L) WT 小鼠在指定处理下肝脏组织的油红 O 染色定量分析。每组 n = 6 只小鼠。
(M 和 N) WT 小鼠在指定处理下的相对血清 ALT (M) 或 AST (N) 水平。每组 n = 9 只小鼠。
(O 和 P) 由 LC-MS 分析确定的来自非 MAFLD 和 MAFLD 患者的血清 (O) 和肝脏 (P) 中的 17-OH PREG 浓度。血清 (n = 8) 和肝脏 (n = 4)。
小结
综上,该研究首次揭示了GPR56 在铁死亡和肝损伤中的重要作用。研究发现,肝脏特异性缺失GPR56的小鼠表现出严重的铁死亡和肝损伤特征。GPR56通过抑制多不饱和脂肪酸(PUFA)的摄取及下调CD36的表达来阻断铁死亡。这一机制并不依赖经典的蛋白降解途径,而是通过内吞-溶酶体途径发挥作用。
此外,研究通过筛选类固醇代谢物,发现17α-羟基孕烯醇酮(17-OH PREG)是GPR56的内源性配体,能够激活GPR56,抑制铁死亡,并在体内外模型中显著减轻肝损伤。该研究为铁死亡相关疾病的治疗提供了潜在的靶点,具有重要的临床应用前景。
科研助力
除了以上研究中提到的 17-OH PREG 、Sulfosuccinimidyl oleate sodium、CCK-8、阿霉素(DOX)、 Ferrostatin-1(Fer-1)以及 deguelin 外,还可为您提供:
TargetMol GPCR 靶向化合物库,由 2223 种与 G 蛋白及其耦联受体相关的生物活性小分子化合物的特有集合。用于GPCR 靶向的药物研发,GPCR 相关科学研究和药物筛选,可用于高通量、高内涵筛选。
TargetMol 铁死亡化合物库,收集了 779 种与铁死亡通路相关的化合物,靶点包括 GPX4、ROS、p53、Nrf2等,另外还包含了铁螯合剂、抗氧化剂等多种类型小分子,助力您铁死亡通路相关的靶点鉴定和药物研发。
铁死亡(Ferroptosis)是一种铁依赖性的调节性细胞死亡形式,由过度的脂质过氧化所引起,与神经系统疾病、肿瘤(特别是乳腺癌、弥漫性大B细胞淋巴瘤)、缺血再灌注损伤、肾损伤、动脉粥样硬化、糖尿病、心脏病以及多种肝损伤相关疾病有关。
2024年10月9日,山东大学初波教授研究团队,孙金鹏教授团队,于晓教授团队,联合东南大学的柴人杰教授和山东大学齐鲁医院徐云飞教授团队,在 Cell Metabolism 发表了题为:Sensing steroid hormone 17a-hydroxypregnenolone by GPR56 enables protection from ferroptosis-induced liver injury 的研究论文。
研究揭示了 17-OH PREG-GPR56 轴介导的信号传导作为一种新的抗铁死亡途径,维持肝脏稳态,为肝损伤的潜在治疗提供了新的见解,并筛选发现 17-OH PREG(17α-羟基孕烯醇酮) 可作为GRP56的激动剂,能够抵抗铁死亡,有效减轻肝损伤。研究还使用了TargetMol的 Sulfosuccinimidyl oleate sodium 以及 CCK-8,让我们一起跟随 T 仔来看看吧~


▲研究概览
新型铁死亡抑制因子——GPR56
该团队首先在 阿霉素(DOX)诱导的小鼠肝损伤模型中检测了 DOX 处理后 aGPCR 的 mRNA 水平。发现,三种 aGPCR——GPR56、GPR64 和 GPR97 的 mRNA 水平迅速上升,铁死亡标志物 Ptgs2 的 mRNA 水平显著升高。其中,GPR56 缺失加剧了 DOX 诱导的脂质过氧化和铁死亡,铁死亡抑制剂 Ferrostatin-1(Fer-1)的使用能逆转这一现象。

进一步,通过在易感铁死亡的人纤维肉瘤 HT1080 和肝癌 SNU-387 细胞系中进行 aGPCR cDNA 文库筛选,结果显示过表达 GPR56 显著保护细胞免受 Erastin/RSL3 诱导的铁死亡,而其他 aGPCRs 没有表现出类似效果。
此外,GPR56 敲除实验进一步验证了 GPR56 作为铁死亡抑制因子的作用。无论是敲低 GPR56/补充 GPR56 拮抗剂 Deguelin 均会使细胞对铁死亡更加敏感。

▲.GPR56 保护细胞免受铁死亡影响
(A) 从 CTRP 数据库中,GPR56 表达与 RSL3、ML162 和 ML210 的敏感性相关。根据 Pearson 相关系数绘制基因图。(B) 测量表达空载体或 aGPCR 载体的 HT1080 细胞在处理了 1 mM erastin 24 小时后的细胞死亡情况(n = 3)。
(C) 表达空载体或 GPR56 载体的 HT1080 细胞在处理了不同浓度 RSL3 后的细胞活力(n = 3)。
(D) 表达 GPR56 sgRNA 的 HT1080 细胞在处理了不同浓度 RSL3 后的细胞活力(n = 3)。
(E) 表达 GPR56 sgRNA 的 HCCLM3 细胞在处理了 5 mM RSL3 12 小时后的细胞活力(n = 3)。
(F) 从 Gpr56fl/fl 小鼠或 Alb-Cre+/Gpr56fl/fl 小鼠分离的原代肝细胞在处理了 500 nM RSL3 16 小时后的细胞活力(n = 3)。
(G) HT1080 WT 和 GPR56 KO 细胞中 GPR56 的免疫印迹分析。
(H) 在处理了 100 nM RSL3 24 小时后的 HT1080 WT 和 GPR56 KO 细胞的细胞活力(n = 3)。
(I) HT1080 WT、GPR56 KO 和转染了 GPR56 载体的 GPR56 KO 细胞中 GPR56 的免疫印迹分。
(J 和 K) 转染了空载体或 GPR56 载体的 HT1080 WT 和 HT1080 GPR56 KO 细胞的细胞死亡(J)和脂质过氧化(K)测定(n = 3)。
接下来,研究探讨了 GPR56 介导的铁死亡抑制的分子机制。
研究者首先检查了 GPR56 是否影响铁死亡的经典或非经典途径。结果表明,GPR56 的缺失并未调节铁死亡相关基因的状态,且未降低谷胱甘肽(GSH)的水平。此外,GPR56 的缺失对线粒体活动、活性氧(ROS)水平和能量代谢几乎没有影响。
由于脂质代谢是驱动铁死亡的关键因素,它们进一步进行了非靶向脂质组学分析,发现 GPR56 通过促进 CD36 的内吞 - 溶酶体降解的途径,从而降低了含有游离多不饱和脂肪酸(PUFA)的磷脂的丰度,从而有效地抑制铁死亡。
鉴定GPR56激动剂——17-OH PREG
为了寻找能够激活 GPR56 的激动剂,研究团队筛选了一系列类固醇代谢物,最终发现 17-OH PREG 是唯一能够激活 GPR56 的类固醇衍生物。
17-OH PREG 显著抑制铁死亡,并有效消除脂质过氧化反应。即使在缺乏 GPX4 或 FSP1 的细胞中,17-OH PREG 仍表现出强大的抗铁死亡作用。

▲17-OH PREG 被鉴定为 GPR56 的激动剂
(A) GPR56-G 蛋白融合复合物解离测定的示意图。
(B) 热图表示 GPR56 在 GPR56-b(DS)-G12、GPR56-b(DS)-G13 或 GPR56-b(DS)-Gq 融合蛋白过表达的 HEK293 细胞中对类固醇配体刺激的激活反应,使用 Stachel 肽(P19)作为阳性对照,通过 G 蛋白解离测定获得。热图显示 G12 信号的 EC50(左)、G13 和 Gq 信号的 Emax(中间和右侧,类固醇配体 100 μM)。热图是根据图 S4C–S4I 中的数据生成的(n = 3)。
(C 和 D) GPR56-b(DS)-G12 (C) 或 GPR56-b(DS)-G13 (D) 融合蛋白对 17-OH PREG 的浓度依赖性曲线,使用过表达 pcDNA3.1-G12/13 的 HEK293 细胞作为阴性对照。数值表示均值 ± 标准误差(SEM)(n = 3)。
(E) 17-OH PREG 的化学结构。
(F) 配体诱导的 GPR56 活性的热图表示。热图显示 EC50(左侧)和 Bmax(右侧)值。数据是根据图 S4O 中的数据生成的。
(G) 在 GPR56-b(DS)-G12 融合蛋白过表达的 HEK293 细胞中,20 μM 17-OH PREG 联合刺激下 deguelin 的浓度依赖性曲线。数值表示均值 ± 标准误差(SEM)(n = 3)。
体内实验表明,17-OH PREG 可显著减轻急性和慢性肝损伤。在 DOX 诱导的肝损伤模型中,铁死亡抑制剂 Fer-1 能明显缓解 DOX 诱导的肝损伤,同时,给予 17-OH PREG 的小鼠肝脏中,脂质过氧化水平和组织损伤均大幅降低。然而,在肝脏特异性缺失 GPR56 的小鼠中,17-OH PREG 的保护作用显著削弱,表明其抗铁死亡功能与 GPR56 受体密切相关。在 IR 诱导的肝损伤模型中,17-OH PREG 同样展现出强效的组织保护作用。
实验还发现,即使在 DOX 或 IR 诱导损伤 24 小时后给予 17-OH PREG,仍能显著减轻由铁死亡引发的肝损伤。类似的保护作用在 IR 诱导的急性肾损伤模型中也得到了验证,表明 17-OH PREG 对多种组织损伤具有广泛的保护效果。
此外,研究团队测试了 17-OH PREG 在代谢相关性脂肪肝病(MAFLD)和代谢功能障碍相关性脂肪性肝炎(MASH)中的作用。结果显示,MASH 模型中,17-OH PREG 显著延缓了 MASH 的进展、铁死亡以及肝损伤。相较之下,GPR56 基因敲除的小鼠表现出更严重的脂质积累和肝损伤。进一步分析显示,在 MASH 模型和 MAFLD 患者中,17-OH PREG 和 GPR56 水平显著上调,而 CD36 水平下降,表明 GPR56/17-OH PREG-CD36 轴在 MASH 的进展中起到了关键作用。

▲17-OH PREG 通过 GPR56 缓解 DOX、IRI 或 MCDD 诱导的肝损伤
(A) 来自 Gpr56fl/fl 或 Alb-Cre+/Gpr56fl/fl 小鼠在指定处理下的肝脏组织的代表性 H&E 图像。比例尺,50 μm。
(B–D) 代表性的免疫组织化学图像 (B) 和 免疫组织化学评分 (C) 4-HNE 染色(n = 4)以及来自肝脏组织的相对 Ptgs2 mRNA 水平 (D)(n = 6) 的 Gpr56fl/fl 或 Alb-Cre+/Gpr56fl/fl 小鼠在指定处理下的结果。比例尺,100 μm。
(E 和 F) 来自 Gpr56fl/fl 或 Alb-Cre+/Gpr56fl/fl 小鼠在 IR 处理下的肝脏组织的代表性 H&E 图像、免疫组织化学图像 (E) 和免疫组织化学评分 (F) 4-HNE。H&E 图像比例尺,50 μm。4-HNE 免疫化学图像比例尺,20 μm。每组 n = 4 只小鼠。
(G–I) 相对 Ptgs2 mRNA 水平 (G) 和来自 Gpr56fl/fl 或 Alb-Cre+/Gpr56fl/fl 小鼠肝脏组织的相对血清 ALT (H) 或 AST (I) 水平。每组 n = 3–5 只小鼠。
(J) 在小鼠中进行慢性肝损伤实验的策略示意图,包含指定的处理。小鼠在注射 17-OH PREG 之前先用 MCDD 喂养 1 周,然后每隔一天注射一次 17-OH PREG,并继续喂养 2 周。收集血样和肝脏组织进行分析。
(K) 来自 WT 小鼠在指定处理下的肝脏组织的代表性 H&E 图像(上)和油红 O 染色(下)。H&E 图像比例尺,20 μm。油红 O 染色比例尺,200 μm。
(L) WT 小鼠在指定处理下肝脏组织的油红 O 染色定量分析。每组 n = 6 只小鼠。
(M 和 N) WT 小鼠在指定处理下的相对血清 ALT (M) 或 AST (N) 水平。每组 n = 9 只小鼠。
(O 和 P) 由 LC-MS 分析确定的来自非 MAFLD 和 MAFLD 患者的血清 (O) 和肝脏 (P) 中的 17-OH PREG 浓度。血清 (n = 8) 和肝脏 (n = 4)。
小结
综上,该研究首次揭示了GPR56 在铁死亡和肝损伤中的重要作用。研究发现,肝脏特异性缺失GPR56的小鼠表现出严重的铁死亡和肝损伤特征。GPR56通过抑制多不饱和脂肪酸(PUFA)的摄取及下调CD36的表达来阻断铁死亡。这一机制并不依赖经典的蛋白降解途径,而是通过内吞-溶酶体途径发挥作用。
此外,研究通过筛选类固醇代谢物,发现17α-羟基孕烯醇酮(17-OH PREG)是GPR56的内源性配体,能够激活GPR56,抑制铁死亡,并在体内外模型中显著减轻肝损伤。该研究为铁死亡相关疾病的治疗提供了潜在的靶点,具有重要的临床应用前景。
科研助力
除了以上研究中提到的 17-OH PREG 、Sulfosuccinimidyl oleate sodium、CCK-8、阿霉素(DOX)、 Ferrostatin-1(Fer-1)以及 deguelin 外,还可为您提供:
TargetMol GPCR 靶向化合物库,由 2223 种与 G 蛋白及其耦联受体相关的生物活性小分子化合物的特有集合。用于GPCR 靶向的药物研发,GPCR 相关科学研究和药物筛选,可用于高通量、高内涵筛选。
TargetMol 铁死亡化合物库,收集了 779 种与铁死亡通路相关的化合物,靶点包括 GPX4、ROS、p53、Nrf2等,另外还包含了铁螯合剂、抗氧化剂等多种类型小分子,助力您铁死亡通路相关的靶点鉴定和药物研发。
相关文章
更多 >

