液滴微流控技术相较于光导技术在跨膜靶点抗体开发中的优势
2024-12-04 来源:达普生物 点击次数:496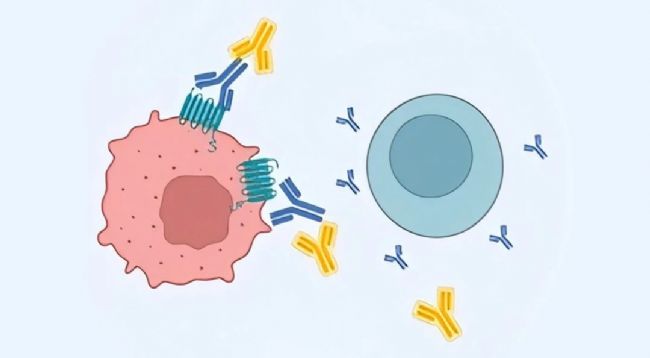 在抗体开发中,多次跨膜靶点因结构复杂而带来诸多挑战,使用表达抗原蛋白的细胞系进行筛选是一种常见方法,但传统流式技术往往难以满足需求。在此背景下,光导技术和 CytoSpark 液滴微流控技术成为了两种热门选择,为跨膜靶点抗体筛选提供不同方案。
在抗体开发中,多次跨膜靶点因结构复杂而带来诸多挑战,使用表达抗原蛋白的细胞系进行筛选是一种常见方法,但传统流式技术往往难以满足需求。在此背景下,光导技术和 CytoSpark 液滴微流控技术成为了两种热门选择,为跨膜靶点抗体筛选提供不同方案。
筛选原理:小室 vs. 液滴 殊途同归
光导技术以单细胞操作的高精度见长,适合中等通量筛选,其光导芯片在处理大量细胞时受限,影响筛选效率增加筛选成本。而 CytoSpark 液滴微流控技术将每个 B 细胞封装在独立 pL 体积液滴中,10 分钟可生成数百万液滴,不仅提升了筛选通量在短时间内筛选出多样性更为丰富的特异性抗体,更可有效应对低阳性率细胞样品的挑战。
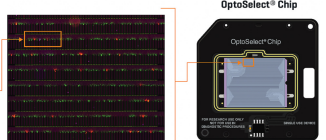


光导芯片单次可导入约上万个待筛选细胞 微流控液滴生成芯片单次可包裹数百万细胞用于高通量筛选
筛选策略:多轮筛选 vs. 高灵敏流式筛选
光导技术:通过多轮筛选建立其特异性优势,首先以过表达细胞系进行阳性筛选,再使用空载细胞系进行阴性筛选,排除非靶点相关的假阳性抗体。这种策略适合在去除无关背景信号方面有较高需求的开发项目。

binders none-specific binders
在浆 B 细胞导入小室后,首先在流道中流入过表达抗原细胞系手动标记所有荧光 booming 小室;随后继续在流道中流入空载细胞系通过非靶点特异的结合产生的荧光 booming,取消假阳性的标记;最后过夜将标记的小室细胞导入 96 孔板中用于 BCR 扩增与重组表达验证。
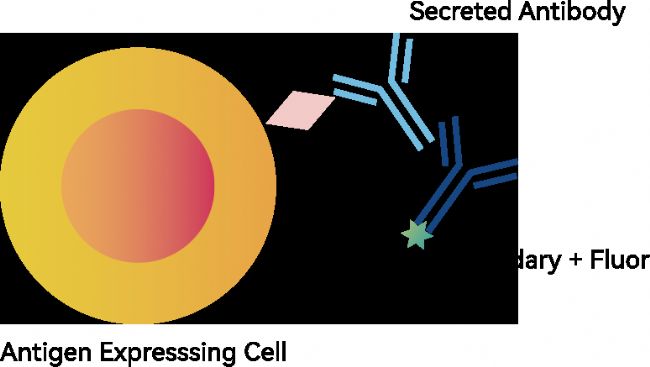
CytoSpark 荧光激活液滴分选:CytoSpark 利用高灵敏度的荧光激活筛选(FADS),直接使用肿瘤细胞系作为筛选源,以保持膜表面抗原的天然特性,从而确保筛选出的抗体更贴合实际临床需求。这一策略减少了因过表达引入的抗原构象偏差,是保持抗体天然结合特性的理想方案。
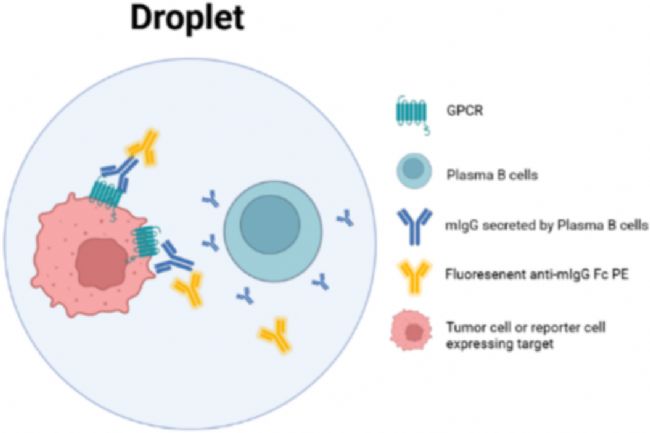

分选前,荧光显微镜下结合了特异性抗体的肿瘤细胞被 PE 二抗着色清晰可见
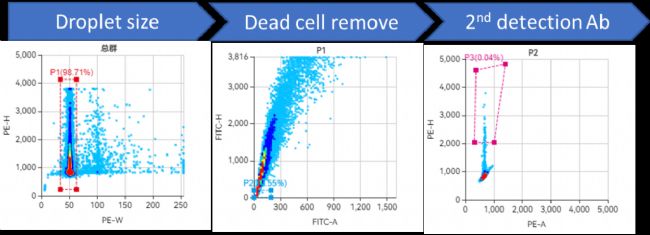
荧光显微镜下质检看到典型的阳性液滴之后,CytoSpark 高通量分选仪进行分选,排除可能造成假阳性的死细胞后,采用 96 孔板打印的形式回收二抗识别的阳性液滴进行 BCR 扩增与重组表达验证
头对头数据比较:
在针对相同七次跨膜靶点的头对头测试中,光导技术与 CytoSpark 微流控技术在 BCR 回收抗体重链扩增效率上表现出色,均可达到接近 100% 扩增成功率,表明了两大平台的稳定性。
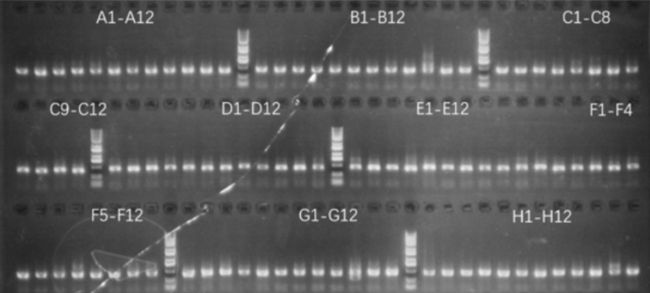
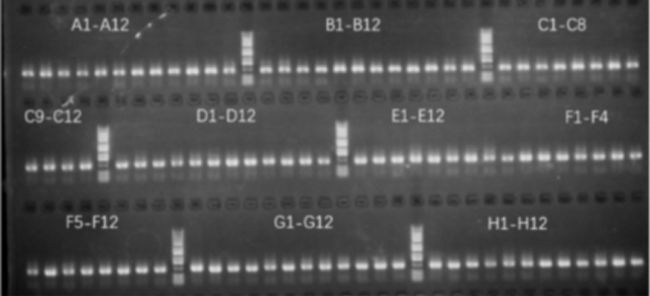
BCR 扩增完成后使用用户技术自主的快速表达方案,一步将扩增的 cDNA 克隆到表达构建体中,在一周内完成抗体表达与结合活性验证。流式分析展示,从 CytoSpark 筛选的 96 株抗体中获得 77 株结合活性抗体,而光导筛选出的抗体中 59 株具备结合活性。

 Cytospark 液滴微流控 光导技术
Cytospark 液滴微流控 光导技术hit rate%: 77/96≈80.2% hit rate%: 59/96≈61.4%
结语:
与光导技术的对比表明,CytoSpark 液滴微流控高通量筛选系统不仅在筛选通量上具有显著优势,还凭借其高灵敏度的特点,可灵活使用天然肿瘤细胞系作为筛选源。这不仅优化了实验材料的准备,更有效保留了跨膜抗原的天然特性。在复杂跨膜靶点的抗体筛选中展现出更高的筛选准确性和稳定性,成为跨膜靶点抗体开发的理想选择。

