小动物跑步机助力BMC Bio / DHA通过信号通路改善骨骼肌功能
2025-03-11 来源:本站 点击次数:1281研究背景:
- 肥胖与骨骼肌功能:肥胖导致骨骼肌纤维类型从慢肌(氧化型)向快肌(糖酵解型)转变,降低运动耐力和代谢功能。
- DHA的作用:DHA(二十二碳六烯酸)作为ω-3多不饱和脂肪酸,被报道可改善肌肉功能,但其分子机制尚不明确。
- m6A修饰的作用:N6-甲基腺苷(m6A)是mRNA的主要表观遗传修饰,参与调控基因表达,但其在DHA调节骨骼肌中的作用未知。
浙江大学动物科学学院在《BMC Biology》 发表文章“DHA alleviates diet-induced skeletal muscle fiber remodeling via FTO/m ⁶ A/DDIT4/PGC1α signaling “,研究发现DHA通过FTO/m ⁶A/DDIT4/PGC1α信号通路改善骨骼肌功能,为肥胖相关肌肉功能障碍的营养干预提供了新的思路和潜在靶点。

研究方法:
1. 动物模型
- 高脂饮食(HFD)诱导肥胖小鼠:分为正常饮食(NFD)、HFD、HFD+DHA三组,持续10周。
- 功能评估:体重、脂肪积累、葡萄糖耐量(GTT)、胰岛素敏感性(ITT)、运动耐力(倒置筛网和跑步机测试)。
2. 细胞模型
- C2C12肌母细胞分化:不同浓度DHA处理,检测肌管形成、线粒体含量及基因表达。
3. 分子机制
- m6A修饰分析:LC-MS/MS检测总m6A水平,MeRIP-qPCR验证特定基因(如Ddit4)的m6A修饰。
- 基因沉默与过表达:siRNA敲低FTO或Ddit4,质粒过表达FTO-WT/MUT,分析对PGC1α和线粒体的影响。
- 蛋白互作:RIP-qPCR验证YTHDF2与Ddit4的结合,mRNA稳定性实验分析Ddit4半衰期。
主要结果:
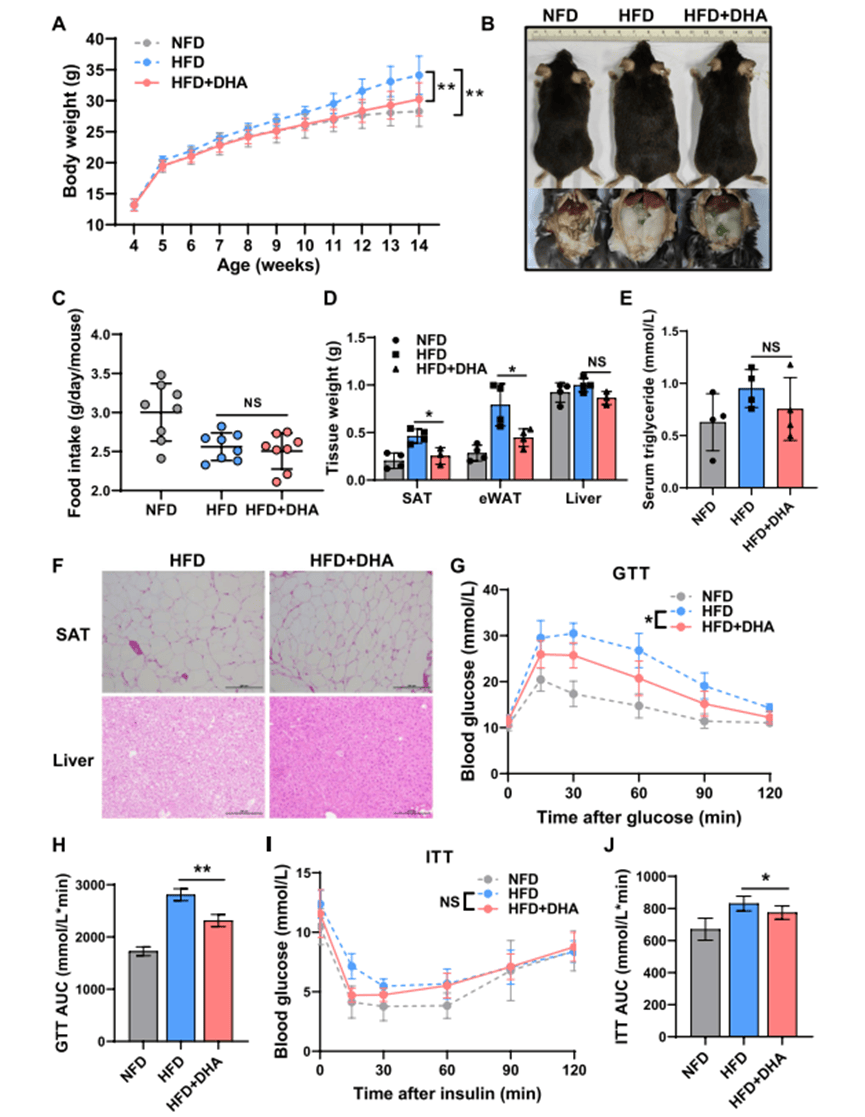
1. DHA改善肥胖相关代谢异常
- 体重与脂肪:HFD+DHA组体重、脂肪量显著低于HFD组,肝脂沉积减少。
- 代谢功能:GTT和ITT结果显示DHA改善葡萄糖耐量和胰岛素敏感性。
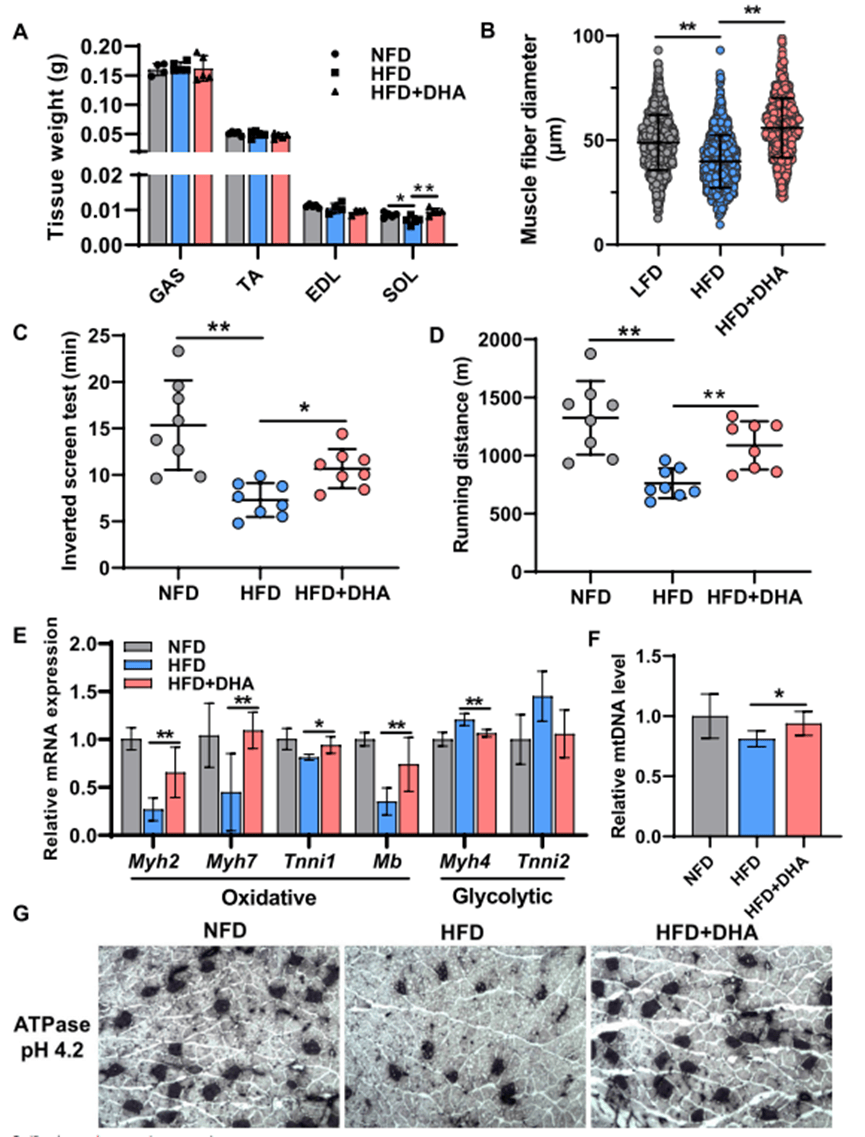
2. DHA促进慢肌纤维转换
- 肌肉结构:HFD+DHA组比目鱼肌(SOL)重量增加,腓肠肌(GAS)纤维直径增大。
- 纤维类型:慢肌基因(Myh7、Tnni1)上调,快肌基因(Myh4)下调,线粒体DNA含量增加。
- 运动耐力:倒置筛网和跑步机测试显示DHA组运动时间和距离显著延长。
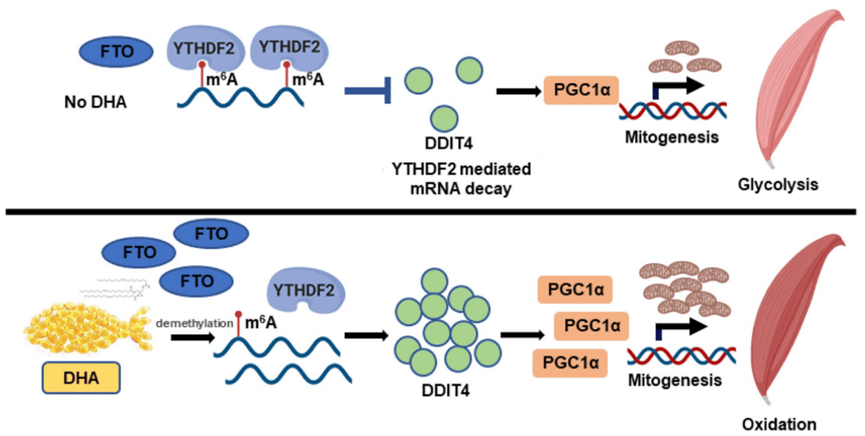
3. 分子机制
- FTO/m ⁶A轴:DHA上调FTO(m6A去甲基化酶),降低Ddit4 mRNA的m ⁶A修饰。
- DDIT4稳定:低m ⁶A的Ddit4 mRNA避免被YTHDF2识别降解,促进其翻译。
- PGC1α激活:DDIT4蛋白积累激活PGC1α,促进线粒体生物合成和慢肌纤维形成。

机制示意图:
DHA → 上调FTO → 降低Ddit4 mRNA的m ⁶A修饰 → 抑制YTHDF2介导的降解 → DDIT4蛋白积累 → 激活PGC1α → 线粒体生成↑ + 慢肌纤维转换↑
实验中骨骼肌功能测试:
为了进行倒置网格测试,小鼠被直立放置在网格上,随后网格被旋转180°。记录小鼠掉下来的时间。对于跑步距离测试,小鼠被禁食2小时,并在跑步机上适应(南京卡尔文生物科技有限公司,KW-PT)1周,速度逐渐增加(5-10米/分钟)10分钟。跑步距离测试在10°坡度上进行,小鼠以10米/分钟的速度跑前10分钟,然后每10分钟增加2米/分钟,直到无法在跑步机上停留超过5秒(0.5mA)为止,小鼠在疲劳后立即被移除。
结论与意义:
1. 创新性发现
- 首次揭示DHA通过FTO/m ⁶A/DDIT4/PGC1α通路调控骨骼肌纤维类型转换,为肥胖相关肌肉功能障碍提供新机制。
2. 应用价值
- DHA可能作为潜在营养干预手段,通过调节RNA甲基化改善肌肉代谢,延缓肥胖相关肌肉退化。
3. 研究局限
- 需进一步验证DHA对FTO的直接调控机制及长期安全性。
- 探索其他m ⁶A修饰基因在肌肉功能中的作用。

