PCR反应程序优化的方法总结
2025-05-23 来源:本站 点击次数:1233一个成熟、稳定的PCR反应成形之前必会经历许多的坎坷,优质模板的获取、高特异性引物的设计、反应体系各组分的优化、反应程序的优化等等。今天我们来聊聊反应程序优化的那些事儿。
首先,优质的模板是PCR成败的前提,没有优质的模板后续工作做得再好也是巧妇难为无米之炊。优质的模板除了浓度和纯度外,模板的完整性也是一个关键因素。不能仅以纯度(260/280、260/230的比值)来衡量模板的优劣,一定要跑个胶确认下。
例如石蜡切片核酸的提取,即使比值堪称完美,没有胶图参考的情况下也不建议直接进行后续的扩增实验,因为极易翻车。解交联后核酸会片段化,一不注意都碎成了几十bp的长度……那之前检测的浓度和纯度就成了摆设,一点意义也无。
再说引物的特异性,这方面常见的是去NCBI检索现成的引物或者依靠引物设计软件自行设计。将设计好的引物序列去基因库比对一下,没有重合就可以找合成公司去合成了(常用Primer 5设计引物,Oligo 7对引物进行评价。评分高的引物特异性高、引物二聚体的概率也低)。
反应体系优化这里简单介绍一下镁离子浓度的优化。dNTP可以结合镁离子,被结合的镁离子无法维持Taq酶的活性,所以镁离子的摩尔浓度一定要比dNTP的总浓度要高。但是过高的镁离子浓度又会增加Taq酶的错配率,所以镁离子的浓度是关乎扩增效果的一个重要参数。
反应程序则多集中于优化退火温度。退火温度常设置在引物对的Tm值附近,若想得到较高的保真率,退火温度就略高于Tm值;若想得到较高的产物,退火温度就略低于Tm值。教材中常用的55℃退火72℃延伸,便是因为55℃处于大多引物的Tm值附近(或略低),这一设定也许不是最适的退火温度但一般能扩增出产物(72℃是Taq酶最适温度)。
最后聊一下反应程序优化中经常被忽略的一个环节-变温速率。变温速率,尤其是变性-退火这一环节的变温速率尤其重要。相对缓慢的变温速率,有助于碱基严格按照碱基互补配对原则进行反应,这一点不论是从HRM实验中非沃森-克里克结构的形成及消除还是DNA oligo的退火实验都有体现,甚至可以说是极端体现。当我们实验时遇到了熔解曲线主峰前有杂峰、测序结果套峰等不良结果时不妨把退火的降温速率下调一些,缓一缓,或许能看到另一番风景。
最后的最后分享两张图:模板,反应程序、反应体系一致,只调试了退火降温速率。
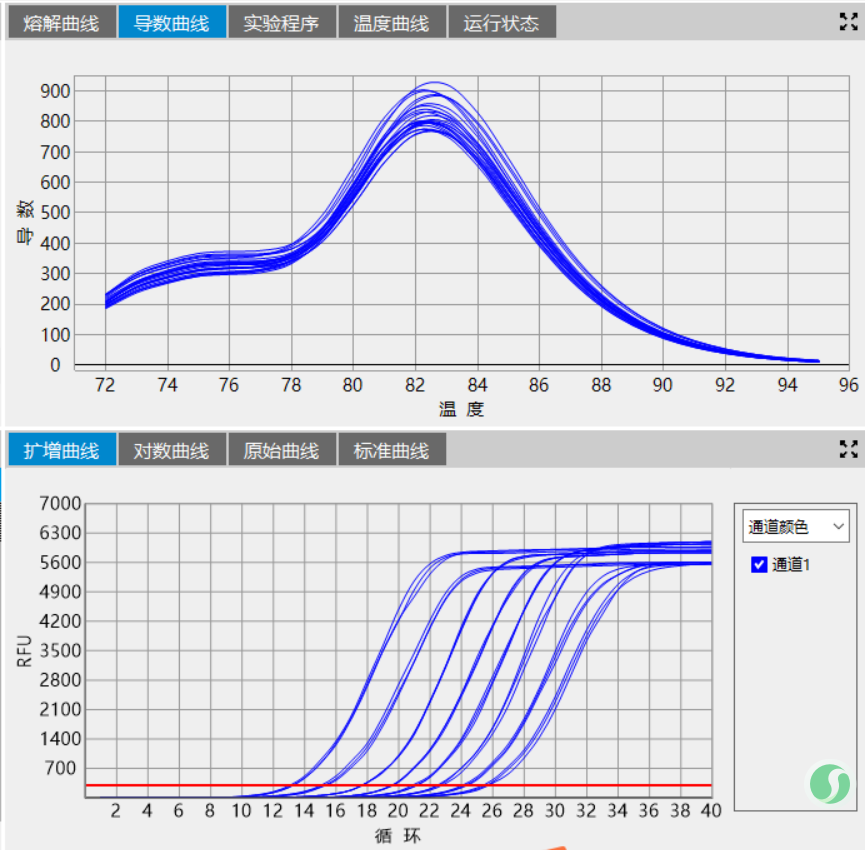 图1:变温速率2℃/sec
图1:变温速率2℃/sec
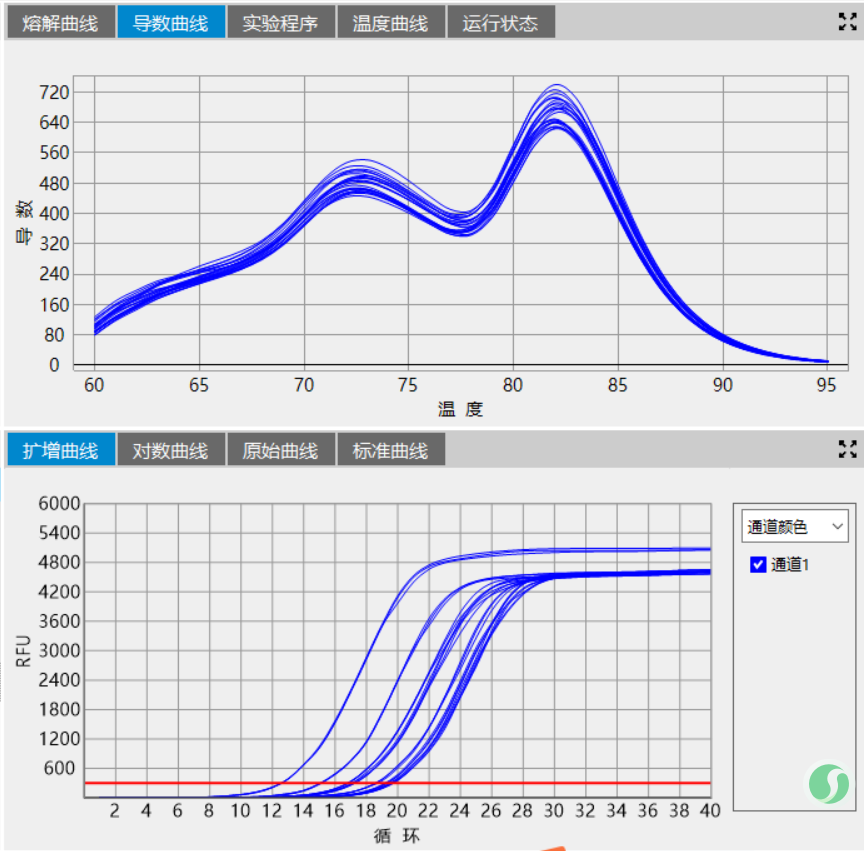 图2:变温速率4℃/sec
图2:变温速率4℃/sec

