DNA甲基化技术助力揭示IRF1在创伤性颅脑损伤中的表观调控机制
2025-07-15 来源:本站 点击次数:76
近日,空军军医大学唐都医院神经外科崔文兴博士为第一作者,白浩博士和郭成铉硕士为共同第一作者;屈延教授为论文通讯作者,葛顺楠教授、刘海啸副研究员为共同通讯作者在Science子刊《Science Translational Medicine》转化医学领域顶刊上发表题为《Interferon regulatory factor-1-expressing astrocytes are epigenetically controlled and exacerbate TBI-associated pathology in mice》的科研成果。研究讨论了干扰素调节因子1(Interferon Regulatory Factor-1,IRF1)在创伤性颅脑损伤(Traumatic Brain Injury,TBI)中的作用及其调控机制。研究团队通过DNA甲基化/羟甲基化及多组学分析、基因敲除小鼠模型以及药物筛选等方法,揭示了IRF1在TBI中通过表观遗传机制调控星形胶质细胞(astrocytes)的促炎表型,并加剧TBI相关的病理变化。

标题:Interferon regulatory factor-1-expressing astrocytes are epigenetically controlled and exacerbate TBI-associated pathology in mice(IRF1星形胶质细胞受表观遗传调控并加剧小鼠创伤性颅脑损伤相关病理变化)
发表时间:2025年5月28日
发表期刊:Science Translational Medicine(SCI TRANSL MED)
影响因子:IF14.6/Q1
技术平台:scRNA-seq、RRBS、oxRRBS等

星形胶质细胞异质性与创伤性颅脑损伤(TBI)病理生理学密切相关,尤其是在TBI患者发病和死亡主要原因之一的脑水肿进展中。目前对于某些星形胶质细胞亚群如何促发急性脑损伤后的脑水肿知之甚少。本研究通过多组学方法鉴定出一个与TBI患者的临床严重程度和预后相关的IRF1阳性(IRF1+)星形胶质细胞簇(cluster)。在机制上,星形胶质细胞中的IRF1能够结合促炎细胞因子基因的启动子,促进神经毒性并破坏内皮紧密连接的完整性。通过使用Aldh1/1CreERT2; Irf1flox/flox小鼠模型验证了星形胶质细胞特异性敲除Irf1能够减轻星形胶质细胞介导的病理活动,改善血脑屏障(lood-Brain Barrier,BBB)破坏,并降低TBI后的脑水肿。此外,星形胶质细胞中IRF1活性增强通过释放C-X-C基序趋化因子配体10(CXCL10)促进了CD8+ T细胞招募,从而加剧BBB破坏和脑水肿。此外TET3(Tet Methylcytosine Dioxygenase 3)介导的DNA羟甲基化是上调星形胶质细胞中IRF1表达的关键表观遗传机制,从而激活促炎转录。本研究最后开发了一种IRF1拮抗因子8003-3282,其在TBI小鼠模型中有效减轻炎症,保持BBB完整性,缓解脑水肿,并改善神经学结果。这些发现强调了IRF1+星形胶质细胞是TBI相关病理的关键介质,并表明靶向这一星形胶质细胞簇(cluster)可能是减轻TBI炎症、BBB损伤和脑水肿的潜在治疗策略。
易小结
本研究通过揭示IRF1在TBI中的作用机制,为开发靶向TBI的精准治疗策略提供了新靶点。未来可以进一步探索IRF1在其他神经系统疾病中的作用,并开发更多的IRF1靶向药物。
RRBS和oxRRBS技术在本研究中发挥了关键作用。通过这些技术,研究者精确分析IRF1启动子区域的DNA甲基化和DNA羟甲基化水平,揭示了TET3在调控IRF1表达中的表观遗传机制。这些技术的应用为理解TBI中星形胶质细胞的表观遗传调控提供了重要的分子基础,并为开发靶向TBI的表观遗传治疗策略提供了新思路。
技术更多应用场景:
项目文章 | oxBS-seq揭示了宫颈癌发生过程中的表观遗传特征变化
项目文章 | oxBS揭示复发性膀胱癌的DNA甲基化和羟甲基化变化并鉴定预测PD-L1表达标记物
研究方法
结果图形
一、TBI患者脑水肿组织中细胞身份的鉴定
通过scRNA-seq分析,研究者鉴定出TBI患者脑水肿组织中的主要细胞类型,包括小胶质细胞、少突胶质细胞、星形胶质细胞等,并发现这些细胞类型均表现出炎症反应,其中星形胶质细胞和小胶质细胞的炎症反应最为显著。通过差异基因表达分析,发现TBI组中炎症相关基因(如IL-1β、IL-6、CXCL10等)显著上调。通过GO分析,进一步揭示了这些细胞类型在TBI中的功能变化,如星形胶质细胞和小胶质细胞在炎症反应中的关键作用。

图1:有或无TBI患者脑水肿组织中细胞群落的鉴定
(A) 对6例TBI患者围损伤皮层水肿组织中的42696个细胞以及4例无TBI对照个体皮层组织中的28974个细胞进行UMAP降维分析,展示整合分析鉴定出的主要细胞类型。
(B) 热图显示基于(A)中scRNA-seq数据所得各细胞类型关键标记基因的表达情况。
(C) 差异基因表达分析突出显示TBI患者皮层组织中主要细胞类型内上调(红色)和下调(蓝色)基因。
(D) 柱状图展示基于(C)中差异表达基因对各主要脑细胞类型进行的GO通路富集分析结果。
(E) UMAP可视化展示TBI患者与对照组中的星形胶质细胞亚群分布。
(F) 对TBI组与对照组星形胶质细胞的比例聚类分析。
二、促炎星形胶质细胞亚群的鉴定
通过分析星形胶质细胞的基因表达,研究者鉴定出一个与TBI病理相关的IRF1阳性星形胶质细胞亚群。这些IRF1+星形胶质细胞表现出促炎和神经毒性表型,与TBI的严重程度和不良预后密切相关。通过伪时间分析(Pseudotime Analysis),研究者揭示星形胶质细胞从静止状态向促炎状态的转变过程。

(B) 对cluster 2星形胶质细胞进行的GO功能富集分析。
(C) 对各星形胶质细胞亚群进行神经毒性和促炎性星形胶质细胞基因集评分。所用基因集包括:C3、IL1B、MX1、CD44、CXCL10、GBP2、CCL2、CHI3L1、PSMB8、SRGN、SERPING1、IFIT3、ISG15 和 CCL20。
(D) 重建星形胶质细胞从cluster 3向cluster 2的分化轨迹。
(E) 对星形胶质细胞分化状态的估计,虚线框突出显示cluster 2。
(F) 沿(E)所示分化轨迹的可变基因伪时间表达谱热图。颜色表示各基因的标准化表达水平。
(G) 在TBI患者围损伤水肿组织及正常人脑组织中,对C3、CD44 和 GBP2(绿色)在星形胶质细胞(GFAP,红色)中的免疫荧光染色(每组n=6)。
三、IRF1是促炎星形胶质细胞激活的关键驱动因子
通过SCENIC分析,研究者发现IRF1是调控星形胶质细胞促炎表型的关键转录因子。在体外实验中,IRF1过表达显著诱导促炎和神经毒性相关基因表达,而IRF1敲低则抑制这些基因表达。通过免疫荧光染色,研究者在TBI患者的脑组织中发现了IRF1+星形胶质细胞显著增加,且IRF1表达与格拉斯哥昏迷评分(GCS)和长期神经功能预后呈负相关。
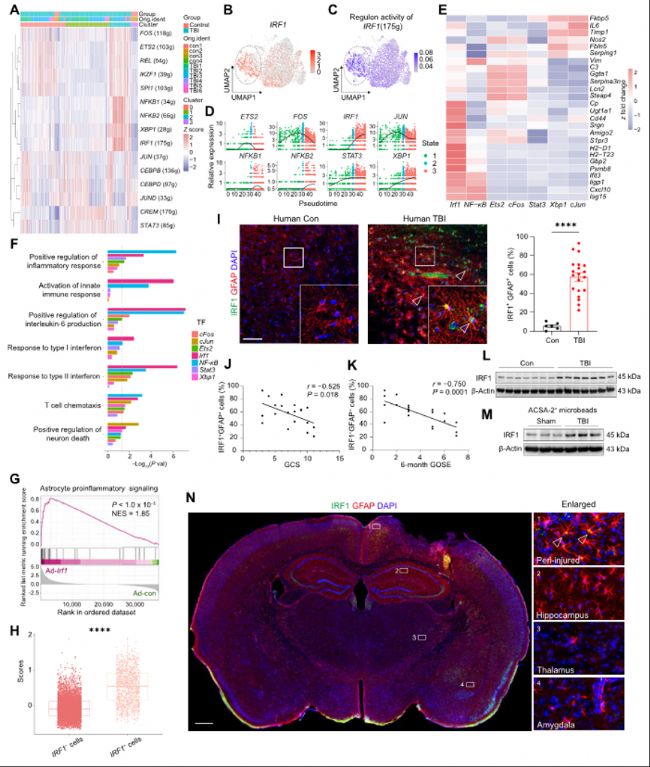
(B) UMAP降维图展示IRF1在各星形胶质细胞亚群中的表达,突出显示cluster 2。
(C) UMAP可视化IRF1调控子(175个靶基因)活性,重点标记cluster 2。
(D) 沿推断的伪时间轨迹展示的转录因子(TF)表达模式;颜色对应图2D所示伪时间排序后细胞状态。
(E) 热图显示在体外原代小鼠星形胶质细胞中过表达各TF后,促炎基因表达差异影响(每组n=3)。
(F) 在原代小鼠星形胶质细胞中过表达TF后的GO通路富集分析。
(G) 原代小鼠星形胶质细胞RNA-seq数据(Ad-Irf1 vs Ad-con)的GSEA分析展示促炎信号通路激活。
(H) 基于患者TBI与对照scRNA-seq数据对IRF1+与IRF1-星形胶质细胞的神经毒性及促炎基因集评分。
(I) 左:代表性免疫荧光图像显示TBI患者围损伤水肿组织与未损伤对照皮层组织中IRF1(绿色)在星形胶质细胞(GFAP,红色)中的表达。右:TBI患者(n=20)与对照(n=6)IRF1+GFAP+细胞比例免疫荧光定量。
(J) TBI患者(n=20)中IRF1+GFAP+细胞比例与GCS评分的相关性分析。
(K) TBI患者(n=20)中IRF1+GFAP+细胞比例与GOSE预后评分评估的长期神经学结局相关性分析。
(L) Western blot显示TBI患者围损伤水肿组织与对照组织中IRF1表达(每组n=7)。
(M) Western blot显示TBI及假手术小鼠在损伤后第3天的星形胶质细胞中IRF1表达(每组n=6)。
(N) 损伤后第3天,TBI小鼠围损伤水肿、海马、丘脑及杏仁核样本中IRF1(绿色)在星形胶质细胞(GFAP,红色)表达的免疫荧光最大强度投影(每组n=6)。
四、IRF1在体外驱动星形胶质细胞的促炎和神经毒性表型
通过ChIP实验研究者发现IRF1直接结合到多个促炎和神经毒性基因的启动子区域,包括C3、Nos2、Gbp2等。在体外实验中,IRF1过表达的星形胶质细胞培养基(ACM)显著增加了神经元死亡率,并降低神经元树突分支和长度。通过共培养实验,研究者发现IRF1过表达的星形胶质细胞培养基能够破坏脑微血管内皮细胞的紧密连接,增加炎症标志物的表达。

(B) qPCR检测ad-con或ad-Irf1转染星形胶质细胞中指定基因表达。
(C-D) Western blot及定量检测指定蛋白表达水平。
(E) ChIP-qPCR检测ad-Irf1转染星形胶质细胞中IRF1与指定基因启动子区的结合。
(F) qPCR检测siIrf1或siScrmbl转染并经TIC(TNF/IL-1α/C1q)处理后星形胶质细胞中指定基因表达。
(G) TIC刺激后,敲低Irf1或乱序siRNA处理的星形胶质细胞中促炎与神经保护基因表达RNA-seq热图。
(H) RNA-seq的急性炎症反应Go term的GSEA基因集富集分析。
(I-J) 原代神经元(MAP2标记)暴露于不同浓度ad-Irf1转染星形胶质细胞条件培养基后的TUNEL阳性细胞代表性图像及定量。
(K-L) 原代神经元暴露于25μg/ml ad-Irf1转染星形胶质细胞ACM后的树突分支数及总树突长度定量。
(M) 左侧:bEnd.3内皮细胞经25μg/ml ad-Irf1转染星形胶质细胞ACM或对照培养基处理后的代表性图像,紧密连接蛋白ZO-1红色标记。右侧:ZO-1荧光强度定量。
(N) Western blot检测bEnd.3内皮细胞经递增浓度ad-Irf1转染星形胶质细胞ACM处理后ZO-1、occludin及VCAM-1的表达。
五、星形胶质细胞特异性Irf1敲除抑制促炎表型并减轻TBI小鼠模型中的BBB损伤
研究者对过Aldh1/1CreERT2; Irf1flox/flox小鼠模型的星形胶质细胞进行特异性IRF1基因敲除(Irf1AKO)。在TBI后,Irf1AKO小鼠表现出显著减少的促炎星形胶质细胞激活、降低的脑水肿、减少的脑损伤体积和改善的神经功能恢复。通过免疫荧光染色和流式细胞术,研究者发现Irf1AKO小鼠中CD8+ T细胞的浸润显著减少,而其他免疫细胞的浸润未受影响。

(C) 假手术与TBI处理的Irf1fl/fl 与Irf1AKO小鼠的星形胶质细胞分支计数定量分析。
(D) 与(C)相同处理组的星形胶质细胞总分支长度定量分析。
(E) 以星形胶质细胞胞体为中心,随距离增加的交点数变化Sholl 分析。
(F) TBI后围损伤水肿区NOS2、IL-6 和 IL-1β 浓度ELISA 分析。
(G) TBI与假手术组脑含水量检测。
(H-I) 代表性T2加权MRI图像及脑损伤体积定量。
(J) TBI后脑组织H&E染色。上:全脑观;下:围损伤区放大图。
(K) TBI后脑组织尼氏(Nissl)染色切片(每组 n = 6)。上:全脑观;下:围损伤区放大图。
(L) 尼氏阳性细胞定量分析对(K)图像围损伤区进行计数。
(M-N) 染色及染料外渗定量Evans Blue 渗漏实验评估BBB通透性。
(O-P) Irf1fl/fl 与Irf1AKO的Western blot 分析围损伤水肿区及对照区ZO-1与occludin表达。
(Q) 水迷宫(MWM)学习(伤后20天)与记忆阶段(伤后21天)代表性游泳轨迹。
(R) 训练5天(伤后16–20天)逃逸潜伏期。
(S) 记忆阶段(伤后21天)目标象限停留时间。
六、IRF1通过CXCL10/CXCR3轴调控CD8+ T细胞浸润
通过细胞间互作分析,研究发现IRF1+星形胶质细胞与CD8+ T细胞之间存在显著CXCL10/CXCR3互作。在TBI小鼠模型中,IRF1敲除显著降低CXCL10表达,减少了CD8+ T细胞的浸润,并减轻脑水肿。通过免疫荧光染色,研究者确认CXCL10在TBI患者和小鼠模型中的表达,并发现其主要由星形胶质细胞分泌。

(B) TBI或假手术小鼠围损伤水肿区星形胶质细胞(GFAP,红色)与CD8+ T细胞(CD8a,绿色)的免疫荧光染色。
(C) 促炎星形胶质细胞(cluster 2)与CD8+ T细胞间的分子配体-受体互作图。
(D) 围损伤水肿区CCL2、CXCL10、CXCL14浓度:TBI或假手术Irf1fl/fl 与Irf1AKO小鼠ELISA分析。
(E) scRNA-seq数据中各星形胶质细胞亚群的CXCL10表达,突出cluster 2。
(F) TBI患者与对照组星形胶质细胞(GFAP标记)中CXCL10表达的代表性免疫荧光(左)及定量(右)。
(G) TBI或假手术小鼠围损伤水肿区星形胶质细胞(GFAP标记)中CXCL10表达免疫荧光染色及定量。
(H) TBI后给予αCXCL10或同型IgG处理的小鼠围损伤水肿区CD8+ T细胞代表性流式图及定量。
(I) TBI后脑含水量测定。
(J) 代表性MRI图像及脑损伤体积定量。
(K) ChIP-qPCR检测ad-Irf1转染星形胶质细胞中IRF1与CXCL10启动子区不同位点的结合:位点1(-1629/-1615,TTGGaaaGTGaaaCT);位点2(-1241/-1227,aaaTaaaaTaaaaCT);位点3(-216/-201,TTGGaaaGTGaaaCT)。
(L) 突变型CXCL10启动子构建体与pcDNA-Irf1共转染星形胶质细胞,鉴定IRF1响应区域荧光素酶报告实验。
七、DNA去甲基化酶TET3介导星形胶质细胞中DNA的羟甲基化并促进IRF1表达
通过scRNA-seq和scATAC-seq分析,研究者发现TET3在TBI后星形胶质细胞中的表达显著增加,并且与IRF1启动子区域的DNA羟甲基化水平相关。通过RRBS和oxRRBS分析,研究者确认了TET3在IRF1启动子区域的DNA羟甲基化作用,并发现TET3的敲低显著抑制了IRF1表达。在TBI小鼠模型中,TET3敲低显著减少促炎星形胶质细胞激活、CD8+ T细胞的浸润和脑损伤体积。

(B) 点图展示各星形胶质细胞亚群中促炎标记基因的表达情况。
(C) scATAC-seq峰图展示cluster 2与cluster 3星形胶质细胞中Irf1位点的染色质可及性;X轴为染色体位置,上方标注Irf1基因位点。
(D) 经TIC(TNF/IL-1α/C1q)或溶剂处理的原代星形胶质细胞中DNA甲基化/去甲基化关键酶表达qPCR。
(E) 与假手术对照,TBI后第3天围损伤水肿区星形胶质细胞(GFAP标记)中TET3表达免疫荧光染色。
(F) TIC或溶剂处理的原代星形胶质细胞Irf1启动子区5-羟甲基化(5hmC)水平RRBS+oxRRBS分析;柱高表示羟甲基化读段数,下方标注Irf1基因位点。
(G) hMeDIP-qPCR检测TIC或溶剂处理星形胶质细胞Irf1启动子区的羟甲基化强度。
(H) RRBS+oxRRBS分析siTet3或siScrmbl转染后经TIC刺激的星形胶质细胞Irf1启动子5hmC水平。
(I) hMeDIP-qPCR检测siTet3或siScrmbl转染后经TIC刺激的星形胶质细胞Irf1启动子羟甲基化强度。
(J) qPCR检测TET3敲低后星形胶质细胞在TIC或溶剂作用下Irf1 mRNA表达。
(K) Western blot分析与(J)相同处理组的IRF1蛋白表达。
(L) qPCR检测TET3敲低后星形胶质细胞促炎基因表达。
(M) qPCR检测在TIC或溶剂刺激下,过表达不同TET3结构域的星形胶质细胞中Irf1 mRNA表达。
(N) Western blot分析TIC刺激过表达不同TET3结构域的星形胶质细胞中HA-TET3与IRF1蛋白水平。
(O) Western blot分析TBI或假手术后第3天,经shTet3 AAV或对照AAV转导的分离星形胶质细胞中IRF1蛋白表达。
(P) 免疫荧光染色与定量分析TBI后第3天围损伤区星形胶质细胞(GFAP,红色)中C3(白色)表达。
(Q) 代表性MRI及脑损伤体积定量。
八、IRF1选择性拮抗因子的设计与鉴定
通过计算机辅助药物设计,研究者从1667101个化合物中筛选出IRF1拮抗因子8003-3282,并通过表面等离子体共振(SPR)分析确认其与IRF1的高亲和力。在体外实验中,8003-3282显著抑制了星形胶质细胞的促炎表型,并减轻了神经毒性。在TBI小鼠模型中,8003-3282干预显著减少了促炎星形胶质细胞的激活、CD8+ T细胞的浸润、脑水肿和脑损伤体积,并改善了神经功能恢复。

(B) 对结合亲和力最高的三种先导化合物(6646-0021、8003-3282、S451-0769)进行多浓度SPR传感图分析。
(C) 8003-3282与IRF1结合构象:左侧为整体视图;右上为8003-3282与IRF1结构结合的三维特写;右下为8003-3282在IRF1结构上的二维放大定位图。
(D) 原代星形胶质细胞预先经8003-3282(10μM)处理后,再经TIC刺激24 h,qPCR检测促炎基因表达变化。
(E) TBI后接受8003-3282(10mg/kg)或溶媒处理的小鼠,免疫荧光染色与定量分析星形胶质细胞(GFAP标记)中C3表达。
(F) ELISA分析围损伤水肿区NOS2、IL-6、IL-1β表达水平。
(G) 流式细胞术代表性图及定量分析围损伤水肿区CD8+ T细胞浸润。
(H) 评估BBB通透性,染色及定量Evans Blue外渗实验。
(I) Western blot分析围损伤水肿区ZO-1与occludin表达。
(J) 代表性T2加权MRI及脑损伤体积定量。
(K) 代表性H&E染色分析TBI后全脑(上)及围损伤区放大图(下)。
(L) 代表性Nissl染色切片及尼氏阳性细胞计数。
(M) TBI后8003-3282或溶媒处理的脑含水量分析。所有检测均于TBI后第3天完成。
讨论和启示
本研究通过多组学分析和基因敲除小鼠模型,揭示了IRF1在TBI中的关键作用及其调控机制。研究结果表明,IRF1通过调控星形胶质细胞的促炎表型,加剧了TBI后的炎症反应、BBB损伤和脑水肿。此外,研究还发现TET3介导的DNA羟甲基化是调控IRF1表达的重要表观遗传机制。通过筛选IRF1拮抗因子,本研究为TBI的治疗提供了新策略。
参考文献:
Cui W, Bai H, Guo C, Zhou J, Feng D, Zhang S, Gao F, Han L, Tian Y, Dong J, Wei F, Bai J, Wu X, Shi Y, Guo H, Wang L, Li Z, Guo W, Zhao T, Heng L, Cai Q, Liu H, Ge S, Qu Y. Interferon regulatory factor-1-expressing astrocytes are epigenetically controlled and exacerbate TBI-associated pathology in mice. Sci Transl Med. 2025 May 28;17(800):eadr5300. doi: 10.1126/scitranslmed.adr5300.

标题:Interferon regulatory factor-1-expressing astrocytes are epigenetically controlled and exacerbate TBI-associated pathology in mice(IRF1星形胶质细胞受表观遗传调控并加剧小鼠创伤性颅脑损伤相关病理变化)
发表期刊:Science Translational Medicine(SCI TRANSL MED)
影响因子:IF14.6/Q1
技术平台:scRNA-seq、RRBS、oxRRBS等

星形胶质细胞异质性与创伤性颅脑损伤(TBI)病理生理学密切相关,尤其是在TBI患者发病和死亡主要原因之一的脑水肿进展中。目前对于某些星形胶质细胞亚群如何促发急性脑损伤后的脑水肿知之甚少。本研究通过多组学方法鉴定出一个与TBI患者的临床严重程度和预后相关的IRF1阳性(IRF1+)星形胶质细胞簇(cluster)。在机制上,星形胶质细胞中的IRF1能够结合促炎细胞因子基因的启动子,促进神经毒性并破坏内皮紧密连接的完整性。通过使用Aldh1/1CreERT2; Irf1flox/flox小鼠模型验证了星形胶质细胞特异性敲除Irf1能够减轻星形胶质细胞介导的病理活动,改善血脑屏障(lood-Brain Barrier,BBB)破坏,并降低TBI后的脑水肿。此外,星形胶质细胞中IRF1活性增强通过释放C-X-C基序趋化因子配体10(CXCL10)促进了CD8+ T细胞招募,从而加剧BBB破坏和脑水肿。此外TET3(Tet Methylcytosine Dioxygenase 3)介导的DNA羟甲基化是上调星形胶质细胞中IRF1表达的关键表观遗传机制,从而激活促炎转录。本研究最后开发了一种IRF1拮抗因子8003-3282,其在TBI小鼠模型中有效减轻炎症,保持BBB完整性,缓解脑水肿,并改善神经学结果。这些发现强调了IRF1+星形胶质细胞是TBI相关病理的关键介质,并表明靶向这一星形胶质细胞簇(cluster)可能是减轻TBI炎症、BBB损伤和脑水肿的潜在治疗策略。
易小结
本研究通过揭示IRF1在TBI中的作用机制,为开发靶向TBI的精准治疗策略提供了新靶点。未来可以进一步探索IRF1在其他神经系统疾病中的作用,并开发更多的IRF1靶向药物。
RRBS和oxRRBS技术在本研究中发挥了关键作用。通过这些技术,研究者精确分析IRF1启动子区域的DNA甲基化和DNA羟甲基化水平,揭示了TET3在调控IRF1表达中的表观遗传机制。这些技术的应用为理解TBI中星形胶质细胞的表观遗传调控提供了重要的分子基础,并为开发靶向TBI的表观遗传治疗策略提供了新思路。
技术更多应用场景:
项目文章 | oxBS-seq揭示了宫颈癌发生过程中的表观遗传特征变化
项目文章 | oxBS揭示复发性膀胱癌的DNA甲基化和羟甲基化变化并鉴定预测PD-L1表达标记物
研究方法
- RNA测序(RNA-seq):通过对38个人类脑组织样本(22例TBI患者和16例对照)进行scRNA-seq和bulk RNA-seq分析,研究者鉴定了与TBI病理相关的星形胶质细胞亚群。
- 基因敲除小鼠模型:利用Aldh1/1CreERT2; Irf1flox/flox小鼠模型,对星形胶质细胞特异性IRF1基因敲除,以评估IRF1在TBI中的作用。
- 表观基因组学分析:通过RRBS(Reduced Representation Bisulfite Sequencing)和oxRRBS(Oxidative RRBS)技术,研究者分析了IRF1启动子区域的DNA甲基化和DNA羟甲基化水平,揭示了TET3在调控IRF1表达中的作用。
- 药物筛选:通过计算机辅助药物设计,筛选出靶向IRF1的特异性拮抗因子8003-3282,并在体外和体内验证其效果。
结果图形
一、TBI患者脑水肿组织中细胞身份的鉴定
通过scRNA-seq分析,研究者鉴定出TBI患者脑水肿组织中的主要细胞类型,包括小胶质细胞、少突胶质细胞、星形胶质细胞等,并发现这些细胞类型均表现出炎症反应,其中星形胶质细胞和小胶质细胞的炎症反应最为显著。通过差异基因表达分析,发现TBI组中炎症相关基因(如IL-1β、IL-6、CXCL10等)显著上调。通过GO分析,进一步揭示了这些细胞类型在TBI中的功能变化,如星形胶质细胞和小胶质细胞在炎症反应中的关键作用。

图1:有或无TBI患者脑水肿组织中细胞群落的鉴定
(B) 热图显示基于(A)中scRNA-seq数据所得各细胞类型关键标记基因的表达情况。
(C) 差异基因表达分析突出显示TBI患者皮层组织中主要细胞类型内上调(红色)和下调(蓝色)基因。
(D) 柱状图展示基于(C)中差异表达基因对各主要脑细胞类型进行的GO通路富集分析结果。
(E) UMAP可视化展示TBI患者与对照组中的星形胶质细胞亚群分布。
(F) 对TBI组与对照组星形胶质细胞的比例聚类分析。
二、促炎星形胶质细胞亚群的鉴定
通过分析星形胶质细胞的基因表达,研究者鉴定出一个与TBI病理相关的IRF1阳性星形胶质细胞亚群。这些IRF1+星形胶质细胞表现出促炎和神经毒性表型,与TBI的严重程度和不良预后密切相关。通过伪时间分析(Pseudotime Analysis),研究者揭示星形胶质细胞从静止状态向促炎状态的转变过程。

图2:促炎星形胶质细胞亚群的鉴定
(A) 点图展示TBI患者与对照组星形胶质细胞亚群中典型标记基因的表达。(B) 对cluster 2星形胶质细胞进行的GO功能富集分析。
(C) 对各星形胶质细胞亚群进行神经毒性和促炎性星形胶质细胞基因集评分。所用基因集包括:C3、IL1B、MX1、CD44、CXCL10、GBP2、CCL2、CHI3L1、PSMB8、SRGN、SERPING1、IFIT3、ISG15 和 CCL20。
(D) 重建星形胶质细胞从cluster 3向cluster 2的分化轨迹。
(E) 对星形胶质细胞分化状态的估计,虚线框突出显示cluster 2。
(F) 沿(E)所示分化轨迹的可变基因伪时间表达谱热图。颜色表示各基因的标准化表达水平。
(G) 在TBI患者围损伤水肿组织及正常人脑组织中,对C3、CD44 和 GBP2(绿色)在星形胶质细胞(GFAP,红色)中的免疫荧光染色(每组n=6)。
三、IRF1是促炎星形胶质细胞激活的关键驱动因子
通过SCENIC分析,研究者发现IRF1是调控星形胶质细胞促炎表型的关键转录因子。在体外实验中,IRF1过表达显著诱导促炎和神经毒性相关基因表达,而IRF1敲低则抑制这些基因表达。通过免疫荧光染色,研究者在TBI患者的脑组织中发现了IRF1+星形胶质细胞显著增加,且IRF1表达与格拉斯哥昏迷评分(GCS)和长期神经功能预后呈负相关。

图3: scRNA-seq验证IRF1是TBI中促炎星形胶质细胞激活的关键调控因子
(A) 患者TBI围损伤水肿组织与对照星形胶质细胞亚群中调控子(regulon)活性热图。(B) UMAP降维图展示IRF1在各星形胶质细胞亚群中的表达,突出显示cluster 2。
(C) UMAP可视化IRF1调控子(175个靶基因)活性,重点标记cluster 2。
(D) 沿推断的伪时间轨迹展示的转录因子(TF)表达模式;颜色对应图2D所示伪时间排序后细胞状态。
(E) 热图显示在体外原代小鼠星形胶质细胞中过表达各TF后,促炎基因表达差异影响(每组n=3)。
(F) 在原代小鼠星形胶质细胞中过表达TF后的GO通路富集分析。
(G) 原代小鼠星形胶质细胞RNA-seq数据(Ad-Irf1 vs Ad-con)的GSEA分析展示促炎信号通路激活。
(H) 基于患者TBI与对照scRNA-seq数据对IRF1+与IRF1-星形胶质细胞的神经毒性及促炎基因集评分。
(I) 左:代表性免疫荧光图像显示TBI患者围损伤水肿组织与未损伤对照皮层组织中IRF1(绿色)在星形胶质细胞(GFAP,红色)中的表达。右:TBI患者(n=20)与对照(n=6)IRF1+GFAP+细胞比例免疫荧光定量。
(J) TBI患者(n=20)中IRF1+GFAP+细胞比例与GCS评分的相关性分析。
(K) TBI患者(n=20)中IRF1+GFAP+细胞比例与GOSE预后评分评估的长期神经学结局相关性分析。
(L) Western blot显示TBI患者围损伤水肿组织与对照组织中IRF1表达(每组n=7)。
(M) Western blot显示TBI及假手术小鼠在损伤后第3天的星形胶质细胞中IRF1表达(每组n=6)。
(N) 损伤后第3天,TBI小鼠围损伤水肿、海马、丘脑及杏仁核样本中IRF1(绿色)在星形胶质细胞(GFAP,红色)表达的免疫荧光最大强度投影(每组n=6)。
四、IRF1在体外驱动星形胶质细胞的促炎和神经毒性表型
通过ChIP实验研究者发现IRF1直接结合到多个促炎和神经毒性基因的启动子区域,包括C3、Nos2、Gbp2等。在体外实验中,IRF1过表达的星形胶质细胞培养基(ACM)显著增加了神经元死亡率,并降低神经元树突分支和长度。通过共培养实验,研究者发现IRF1过表达的星形胶质细胞培养基能够破坏脑微血管内皮细胞的紧密连接,增加炎症标志物的表达。

图4:IRF1在体外促进星形胶质细胞的促炎和神经毒性反应
(A) 感染腺病毒对照组(ad-con)或IRF1过表达组(ad-Irf1)的原代星形胶质细胞(GFAP标记,红色)免疫荧光染色检测。(B) qPCR检测ad-con或ad-Irf1转染星形胶质细胞中指定基因表达。
(C-D) Western blot及定量检测指定蛋白表达水平。
(E) ChIP-qPCR检测ad-Irf1转染星形胶质细胞中IRF1与指定基因启动子区的结合。
(F) qPCR检测siIrf1或siScrmbl转染并经TIC(TNF/IL-1α/C1q)处理后星形胶质细胞中指定基因表达。
(G) TIC刺激后,敲低Irf1或乱序siRNA处理的星形胶质细胞中促炎与神经保护基因表达RNA-seq热图。
(H) RNA-seq的急性炎症反应Go term的GSEA基因集富集分析。
(I-J) 原代神经元(MAP2标记)暴露于不同浓度ad-Irf1转染星形胶质细胞条件培养基后的TUNEL阳性细胞代表性图像及定量。
(K-L) 原代神经元暴露于25μg/ml ad-Irf1转染星形胶质细胞ACM后的树突分支数及总树突长度定量。
(M) 左侧:bEnd.3内皮细胞经25μg/ml ad-Irf1转染星形胶质细胞ACM或对照培养基处理后的代表性图像,紧密连接蛋白ZO-1红色标记。右侧:ZO-1荧光强度定量。
(N) Western blot检测bEnd.3内皮细胞经递增浓度ad-Irf1转染星形胶质细胞ACM处理后ZO-1、occludin及VCAM-1的表达。
五、星形胶质细胞特异性Irf1敲除抑制促炎表型并减轻TBI小鼠模型中的BBB损伤
研究者对过Aldh1/1CreERT2; Irf1flox/flox小鼠模型的星形胶质细胞进行特异性IRF1基因敲除(Irf1AKO)。在TBI后,Irf1AKO小鼠表现出显著减少的促炎星形胶质细胞激活、降低的脑水肿、减少的脑损伤体积和改善的神经功能恢复。通过免疫荧光染色和流式细胞术,研究者发现Irf1AKO小鼠中CD8+ T细胞的浸润显著减少,而其他免疫细胞的浸润未受影响。

图5:星形胶质细胞条件性敲除Irf1降低促炎表型、缓解BBB破坏与脑水肿,并促进TBI后神经功能恢复
(A-B) TBI后Irf1fl/fl 与Irf1AKO小鼠围损伤水肿区星形胶质细胞(GFAP,红色)中C3(绿色)表达免疫荧光染色及定量分析。(C) 假手术与TBI处理的Irf1fl/fl 与Irf1AKO小鼠的星形胶质细胞分支计数定量分析。
(D) 与(C)相同处理组的星形胶质细胞总分支长度定量分析。
(E) 以星形胶质细胞胞体为中心,随距离增加的交点数变化Sholl 分析。
(F) TBI后围损伤水肿区NOS2、IL-6 和 IL-1β 浓度ELISA 分析。
(G) TBI与假手术组脑含水量检测。
(H-I) 代表性T2加权MRI图像及脑损伤体积定量。
(J) TBI后脑组织H&E染色。上:全脑观;下:围损伤区放大图。
(K) TBI后脑组织尼氏(Nissl)染色切片(每组 n = 6)。上:全脑观;下:围损伤区放大图。
(L) 尼氏阳性细胞定量分析对(K)图像围损伤区进行计数。
(M-N) 染色及染料外渗定量Evans Blue 渗漏实验评估BBB通透性。
(O-P) Irf1fl/fl 与Irf1AKO的Western blot 分析围损伤水肿区及对照区ZO-1与occludin表达。
(Q) 水迷宫(MWM)学习(伤后20天)与记忆阶段(伤后21天)代表性游泳轨迹。
(R) 训练5天(伤后16–20天)逃逸潜伏期。
(S) 记忆阶段(伤后21天)目标象限停留时间。
六、IRF1通过CXCL10/CXCR3轴调控CD8+ T细胞浸润
通过细胞间互作分析,研究发现IRF1+星形胶质细胞与CD8+ T细胞之间存在显著CXCL10/CXCR3互作。在TBI小鼠模型中,IRF1敲除显著降低CXCL10表达,减少了CD8+ T细胞的浸润,并减轻脑水肿。通过免疫荧光染色,研究者确认CXCL10在TBI患者和小鼠模型中的表达,并发现其主要由星形胶质细胞分泌。

图6:星形胶质细胞分泌的CXCL10介导TBI后CD8+ T细胞浸润与组织损伤
(A) TBI后Irf1fl/fl 与Irf1AKO小鼠围损伤水肿区内浸润的中性粒细胞、单核/巨噬细胞、CD4+ T细胞、CD8+ T细胞及NK细胞的流式细胞术定量分析。(B) TBI或假手术小鼠围损伤水肿区星形胶质细胞(GFAP,红色)与CD8+ T细胞(CD8a,绿色)的免疫荧光染色。
(C) 促炎星形胶质细胞(cluster 2)与CD8+ T细胞间的分子配体-受体互作图。
(D) 围损伤水肿区CCL2、CXCL10、CXCL14浓度:TBI或假手术Irf1fl/fl 与Irf1AKO小鼠ELISA分析。
(E) scRNA-seq数据中各星形胶质细胞亚群的CXCL10表达,突出cluster 2。
(F) TBI患者与对照组星形胶质细胞(GFAP标记)中CXCL10表达的代表性免疫荧光(左)及定量(右)。
(G) TBI或假手术小鼠围损伤水肿区星形胶质细胞(GFAP标记)中CXCL10表达免疫荧光染色及定量。
(H) TBI后给予αCXCL10或同型IgG处理的小鼠围损伤水肿区CD8+ T细胞代表性流式图及定量。
(I) TBI后脑含水量测定。
(J) 代表性MRI图像及脑损伤体积定量。
(K) ChIP-qPCR检测ad-Irf1转染星形胶质细胞中IRF1与CXCL10启动子区不同位点的结合:位点1(-1629/-1615,TTGGaaaGTGaaaCT);位点2(-1241/-1227,aaaTaaaaTaaaaCT);位点3(-216/-201,TTGGaaaGTGaaaCT)。
(L) 突变型CXCL10启动子构建体与pcDNA-Irf1共转染星形胶质细胞,鉴定IRF1响应区域荧光素酶报告实验。
七、DNA去甲基化酶TET3介导星形胶质细胞中DNA的羟甲基化并促进IRF1表达
通过scRNA-seq和scATAC-seq分析,研究者发现TET3在TBI后星形胶质细胞中的表达显著增加,并且与IRF1启动子区域的DNA羟甲基化水平相关。通过RRBS和oxRRBS分析,研究者确认了TET3在IRF1启动子区域的DNA羟甲基化作用,并发现TET3的敲低显著抑制了IRF1表达。在TBI小鼠模型中,TET3敲低显著减少促炎星形胶质细胞激活、CD8+ T细胞的浸润和脑损伤体积。

图7:TET3通过调节Irf1的DNA羟甲基化,促进星形胶质细胞促炎表型
(A) scRNA-seq数据的UMAP降维可视化展示假手术与TBI小鼠围损伤皮层组织中分离的星形胶质细胞。(B) 点图展示各星形胶质细胞亚群中促炎标记基因的表达情况。
(C) scATAC-seq峰图展示cluster 2与cluster 3星形胶质细胞中Irf1位点的染色质可及性;X轴为染色体位置,上方标注Irf1基因位点。
(D) 经TIC(TNF/IL-1α/C1q)或溶剂处理的原代星形胶质细胞中DNA甲基化/去甲基化关键酶表达qPCR。
(E) 与假手术对照,TBI后第3天围损伤水肿区星形胶质细胞(GFAP标记)中TET3表达免疫荧光染色。
(F) TIC或溶剂处理的原代星形胶质细胞Irf1启动子区5-羟甲基化(5hmC)水平RRBS+oxRRBS分析;柱高表示羟甲基化读段数,下方标注Irf1基因位点。
(G) hMeDIP-qPCR检测TIC或溶剂处理星形胶质细胞Irf1启动子区的羟甲基化强度。
(H) RRBS+oxRRBS分析siTet3或siScrmbl转染后经TIC刺激的星形胶质细胞Irf1启动子5hmC水平。
(I) hMeDIP-qPCR检测siTet3或siScrmbl转染后经TIC刺激的星形胶质细胞Irf1启动子羟甲基化强度。
(J) qPCR检测TET3敲低后星形胶质细胞在TIC或溶剂作用下Irf1 mRNA表达。
(K) Western blot分析与(J)相同处理组的IRF1蛋白表达。
(L) qPCR检测TET3敲低后星形胶质细胞促炎基因表达。
(M) qPCR检测在TIC或溶剂刺激下,过表达不同TET3结构域的星形胶质细胞中Irf1 mRNA表达。
(N) Western blot分析TIC刺激过表达不同TET3结构域的星形胶质细胞中HA-TET3与IRF1蛋白水平。
(O) Western blot分析TBI或假手术后第3天,经shTet3 AAV或对照AAV转导的分离星形胶质细胞中IRF1蛋白表达。
(P) 免疫荧光染色与定量分析TBI后第3天围损伤区星形胶质细胞(GFAP,红色)中C3(白色)表达。
(Q) 代表性MRI及脑损伤体积定量。
八、IRF1选择性拮抗因子的设计与鉴定
通过计算机辅助药物设计,研究者从1667101个化合物中筛选出IRF1拮抗因子8003-3282,并通过表面等离子体共振(SPR)分析确认其与IRF1的高亲和力。在体外实验中,8003-3282显著抑制了星形胶质细胞的促炎表型,并减轻了神经毒性。在TBI小鼠模型中,8003-3282干预显著减少了促炎星形胶质细胞的激活、CD8+ T细胞的浸润、脑水肿和脑损伤体积,并改善了神经功能恢复。

图8:高选择性IRF1拮抗因子8003-3282的筛选及其在TBI中的治疗潜力
(A) 表面等离子共振(SPR)检测50种候选化合物(10μM)与IRF1蛋白的结合亲和力。(B) 对结合亲和力最高的三种先导化合物(6646-0021、8003-3282、S451-0769)进行多浓度SPR传感图分析。
(C) 8003-3282与IRF1结合构象:左侧为整体视图;右上为8003-3282与IRF1结构结合的三维特写;右下为8003-3282在IRF1结构上的二维放大定位图。
(D) 原代星形胶质细胞预先经8003-3282(10μM)处理后,再经TIC刺激24 h,qPCR检测促炎基因表达变化。
(E) TBI后接受8003-3282(10mg/kg)或溶媒处理的小鼠,免疫荧光染色与定量分析星形胶质细胞(GFAP标记)中C3表达。
(F) ELISA分析围损伤水肿区NOS2、IL-6、IL-1β表达水平。
(G) 流式细胞术代表性图及定量分析围损伤水肿区CD8+ T细胞浸润。
(H) 评估BBB通透性,染色及定量Evans Blue外渗实验。
(I) Western blot分析围损伤水肿区ZO-1与occludin表达。
(J) 代表性T2加权MRI及脑损伤体积定量。
(K) 代表性H&E染色分析TBI后全脑(上)及围损伤区放大图(下)。
(L) 代表性Nissl染色切片及尼氏阳性细胞计数。
(M) TBI后8003-3282或溶媒处理的脑含水量分析。所有检测均于TBI后第3天完成。
讨论和启示
本研究通过多组学分析和基因敲除小鼠模型,揭示了IRF1在TBI中的关键作用及其调控机制。研究结果表明,IRF1通过调控星形胶质细胞的促炎表型,加剧了TBI后的炎症反应、BBB损伤和脑水肿。此外,研究还发现TET3介导的DNA羟甲基化是调控IRF1表达的重要表观遗传机制。通过筛选IRF1拮抗因子,本研究为TBI的治疗提供了新策略。
参考文献:
Cui W, Bai H, Guo C, Zhou J, Feng D, Zhang S, Gao F, Han L, Tian Y, Dong J, Wei F, Bai J, Wu X, Shi Y, Guo H, Wang L, Li Z, Guo W, Zhao T, Heng L, Cai Q, Liu H, Ge S, Qu Y. Interferon regulatory factor-1-expressing astrocytes are epigenetically controlled and exacerbate TBI-associated pathology in mice. Sci Transl Med. 2025 May 28;17(800):eadr5300. doi: 10.1126/scitranslmed.adr5300.
相关文章
更多 >

