成纤维细胞生长因子FGF-9在原代细胞、干细胞及类器官培养中的应用
2025-08-08 来源:本站 点击次数:26
成纤维细胞生长因子9(FGF-9)作为多功能信号蛋白,属于FGF家族中重要的成员之一,它参与神经发育、肌肉和软骨发育和修复、以及血管生成等。重组FGF-9蛋白(FGF-9,AbMole,M15032)则在科研领域尤其是原代细胞培养、干细胞命运调控和类器官构建方面展现出了巨大的应用潜力,成为深入探究细胞生物学机制以及组织器官发育过程的强大工具。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、 重组FGF-9蛋白在原代细胞培养中的应用
FGF-9(Recombinant Human FGF-9,AbMole,M15032)在原代细胞培养体系中具有独特优势。与永生化细胞系不同,原代细胞在体外培养时往往面临增殖能力有限和表型不稳定的挑战。添加FGF9能有效促进多种原代细胞(如肺血管平滑肌细胞、神经元前体细胞和肿瘤细胞)的存活和增殖。其作用机制可能与FGF-9激活细胞内一系列与增殖相关的信号通路有关,如MAPK通路。激活后的MAPK通路可促进细胞周期相关蛋白的表达,从而推动细胞从静止期进入分裂期,加快细胞增殖速率[1]。

二、 FGF-9(重组FGF-9蛋白)在干细胞培养中的应用
1. FGF-9促进胚胎干细胞增殖和自我更新
FGF-9(Recombinant Human FGF-9,AbMole,M15032)可通过激活多种信号通路来促进干细胞的增殖。例如FGF-9可激活ERK1/2信号通路并促进软骨细胞的增殖[3]。在小鼠肺上皮干细胞的研究中,FGF-9显著增加了肺上皮干细胞集落的数目和体积,且这种作用不被其受体抑制剂消除,表明FGF-9通过非受体依赖途径促进细胞增殖[4]。FGF-9在神经干细胞的研究中也显示出促进增殖的作用,FGF-9能够增加神经干细胞细胞的增殖速率[5, 6]。此外,也有文献证实FGF9可通过p38 MAPK信号通路促进小鼠精原干细胞增殖(图2)[1]。

2. FGF-9诱导胚胎干细胞定向分化
FGF-9(Recombinant Human FGF-9,AbMole,M15032)在胚胎干细胞(ESC)和诱导多能干细胞(iPSC)的定向分化中具有重要的调控作用。有研究表明,FGF-9能够通过其受体(FGFR)激活下游信号通路,从而促进神经干细胞向特定神经细胞类型分化;以及在脂肪干细胞(ASCs)的研究中,FGF-9能够诱导ASCs分化为施万细胞(Schwann cells,SCs,周围神经系统中的神经胶质细胞),这一过程主要通过FGFR2-Akt信号通路实现(图3)[7, 8]2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。

FGF-9(Recombinant Human FGF-9,AbMole,M15032)在上皮细胞的分化中同样发挥着重要作用。研究表明,FGF-9能够加速上皮细胞的内陷过程,并促进上皮细胞向特定表型分化。例如,在牙胚细胞的研究中,FGF-9能够诱导上皮细胞表达牙釉质细胞(ameloblasts)的特异性标志物[9]。在骨髓间充质干细胞(BMSCs)的研究中,FGF-9通过激活MEK/ERK信号通路抑制成骨基因表达,同时通过PI3K/AKT/Hippo信号通路促进脂肪生成和成脂分化(图4)[10]。

三、 FGF-9(重组FGF-9蛋白)在类器官培养中的应用
FGF-9(Recombinant Human FGF-9,AbMole,M15032)在类器官培养中具有重要作用,尤其是在肾脏类器官的生成过程中。FGF-9(Recombinant Human FGF-9,AbMole,M15032)可以和BMP-2(AbMole,M9990)、BMP-4(AbMole,M9759)、BMP-7(AbMole,M11480)、Activin A(AbMole,M15046)等细胞因子,以及CHIR-99021(AbMole,M1692)等多种小分子化合物联用,以有效促进肾脏祖细胞的形成和分化。例如,在一项研究中,通过在培养基中添加FGF-9,研究人员成功将诱导多能干细胞(hiPSCs)和胚胎干细胞(hESCs)分化为肾祖细胞(图5)[11],并且该类器官还可形成肾小管和肾小球结构[11]。值得注意的是FGF-9不仅仅在肾脏类器的早期培养中提高肾祖细胞的形成效率,而且在后续的3D培养中可促进肾脏类器官的成熟和功能化。
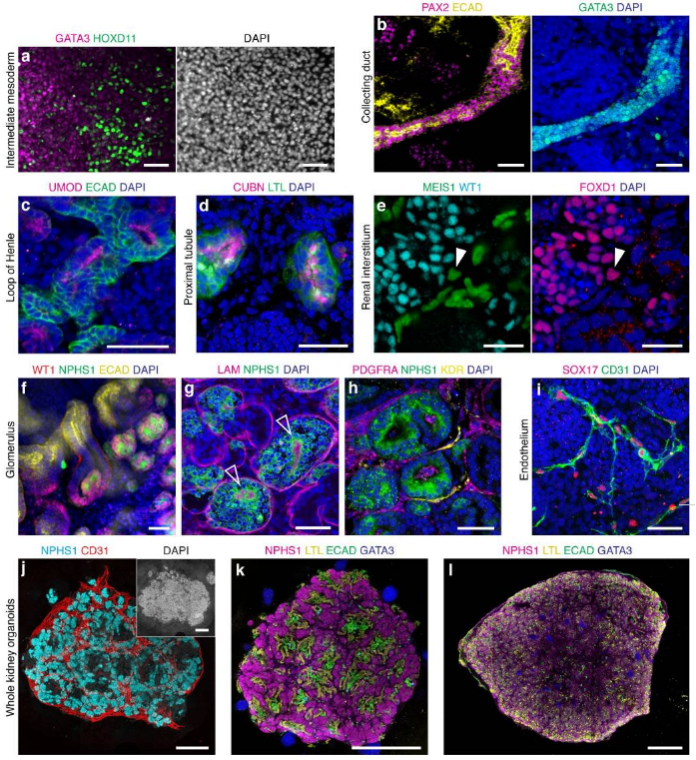 图 5. 从 hPSC 生成肾脏类器官后的免疫荧光图[11]
图 5. 从 hPSC 生成肾脏类器官后的免疫荧光图[11]
FGF-9(Recombinant Human FGF-9,AbMole,M15032)也是肝脏类器官生成的关键细胞因子之一[12],FGF-9通常与其他生长因子联合使用,以实现最佳的细胞增殖和分化效果,例如BMP4(AbMole,M9759)、HGF(AbMole,M10352)等细胞因子。FGF-9在维持肝脏类器官的长期培养中也发挥重要作用,它能够促进细胞的增殖和功能维持[13]。FGF-9在其他类型的类器官培养中也显示出潜在的应用价值。例如,在脑类器官的培养中,FGF-9被用于促进神经干细胞的增殖和分化[13]。在肺类器官的培养中,FGF-9也被用于促进肺上皮细胞的分化和成熟[14]。
AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] FGF9 promotes mouse spermatogonial stem cell proliferation mediated by p38 MAPK signalling %J Cell Proliferation, (2020).
[2] HasibullahSuzuki Habibi, AkinobuHayashi, KazunoriSalimi, HamidullahTerai, HidetomiHori, YusukeTamai, KojiOrita, KumiOhyama, ShoichiroYabu, AkitoMaruf, Mohammad HasibNakamura, Hiroaki %J The spine journal: official journal of the North American Spine Society, Expression and function of FGF9 in the hypertrophied ligamentum flavum of lumbar spinal stenosis patients, 21(6) (2021).
[3] Angela Au, Anna Polotsky, Karol Krzyminski, et al., Evaluation of thermoreversible polymers containing fibroblast growth factor 9 (FGF-9) for chondrocyte culture, (2004).
[4] 高静韬, Ahmed Hegab, 黑田葵, et al., 小鼠肺上皮干细胞体外增殖和分化特性及其影响因素的初步研究, 38(8) (2018) 11.
[5] Jih Ing. Chuang, Jui Yen. Huang, Shaw Jenq. Tsai, et al., FGF9-induced changes in cellular redox status and HO-1 upregulation are FGFR-dependent and proceed through both ERK and AKT to induce CREB and Nrf2 activation, 89 (2015) 274-86.
[6] Dasol Han, Sun Min Lee, Mookwang Kwon, et al., YAP enhances FGF2-dependent neural stem cell proliferation by induction of fibroblast growth factor receptor expression, 29(18) (2020) -.
[7] C. W. Huang, S. Y. Lu, T. C. Huang, et al., FGF9 induces functional differentiation to Schwann cells from human adipose derived stem cells, Theranostics 10(6) (2020) 2817-2831.
[8] Chia Wei Huang, Shih Yu Lu, Tzu Chieh Huang, et al., FGF9 induces functional differentiation to Schwann cells from human adipose derived stem cells, 10(6) (2020) 2817-2831.
[9] Y. Y. Tai, R. S. Chen, Y. Lin, et al., FGF-9 accelerates epithelial invagination for ectodermal organogenesis in real time bioengineered organ manipulation, Cell communication and signaling : CCS 10(1) (2012) 34.
[10] M. Chen, H. Liang, M. Wu, et al., Fgf9 regulates bone marrow mesenchymal stem cell fate and bone-fat balance in osteoporosis by PI3K/AKT/Hippo and MEK/ERK signaling, International journal of biological sciences 20(9) (2024) 3461-3479.
[11] M. Takasato, P. X. Er, H. S. Chiu, et al., Generation of kidney organoids from human pluripotent stem cells, Nature protocols 11(9) (2016) 1681-92.
[12] 林允祯, 王经琳, 任昊桢, et al., 肝脏疾病类器官模型的研究进展, (2021).
[13] L. Broutier, A. Andersson-Rolf, C. J. Hindley, et al., Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation, Nature protocols 11(9) (2016) 1724-43.
[14] B. R. Dye, D. R. Hill, M. A. Ferguson, et al., In vitro generation of human pluripotent stem cell derived lung organoids, eLife 4 (2015).
一、 重组FGF-9蛋白在原代细胞培养中的应用
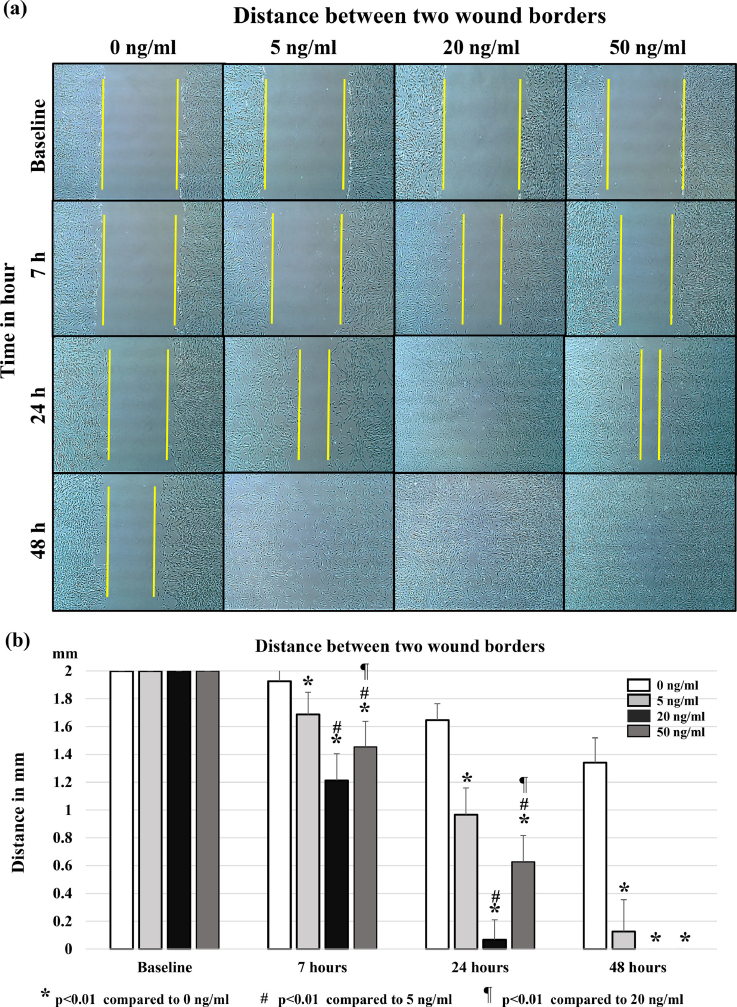
FGF-9(Recombinant Human FGF-9,AbMole,M15032)在原代细胞培养体系中具有独特优势。与永生化细胞系不同,原代细胞在体外培养时往往面临增殖能力有限和表型不稳定的挑战。添加FGF9能有效促进多种原代细胞(如肺血管平滑肌细胞、神经元前体细胞和肿瘤细胞)的存活和增殖。其作用机制可能与FGF-9激活细胞内一系列与增殖相关的信号通路有关,如MAPK通路。激活后的MAPK通路可促进细胞周期相关蛋白的表达,从而推动细胞从静止期进入分裂期,加快细胞增殖速率[1]。


图 1. FGF9促进腰椎黄韧带原代细胞体外增殖的划痕实验[2]
二、 FGF-9(重组FGF-9蛋白)在干细胞培养中的应用
1. FGF-9促进胚胎干细胞增殖和自我更新
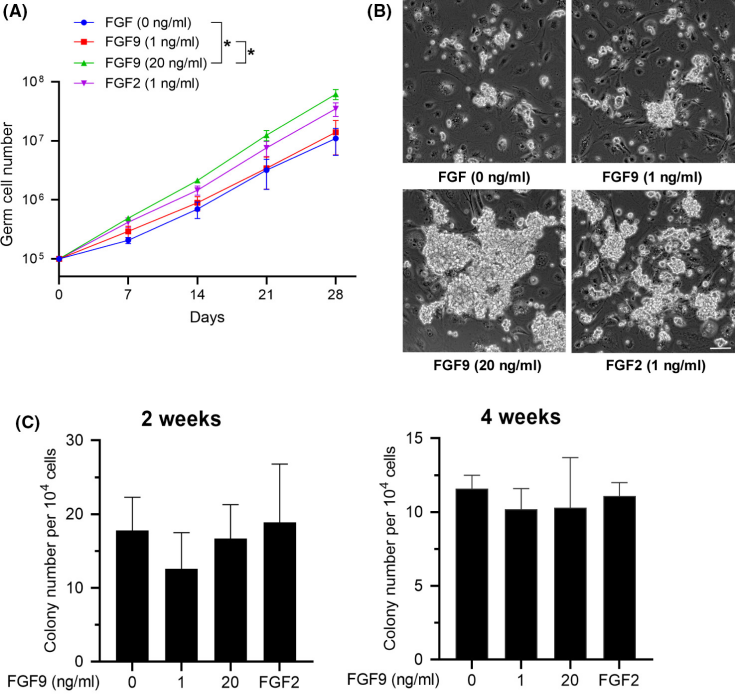
FGF-9(Recombinant Human FGF-9,AbMole,M15032)可通过激活多种信号通路来促进干细胞的增殖。例如FGF-9可激活ERK1/2信号通路并促进软骨细胞的增殖[3]。在小鼠肺上皮干细胞的研究中,FGF-9显著增加了肺上皮干细胞集落的数目和体积,且这种作用不被其受体抑制剂消除,表明FGF-9通过非受体依赖途径促进细胞增殖[4]。FGF-9在神经干细胞的研究中也显示出促进增殖的作用,FGF-9能够增加神经干细胞细胞的增殖速率[5, 6]。此外,也有文献证实FGF9可通过p38 MAPK信号通路促进小鼠精原干细胞增殖(图2)[1]。


图 2.FGF9通过p38 MAPK信号传导促进小鼠精原干细胞增殖[1]
2. FGF-9诱导胚胎干细胞定向分化
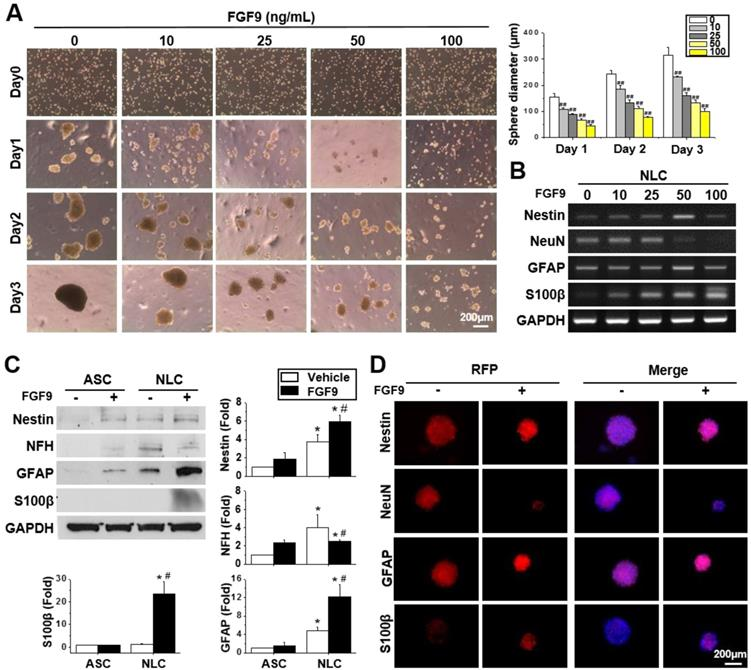
FGF-9(Recombinant Human FGF-9,AbMole,M15032)在胚胎干细胞(ESC)和诱导多能干细胞(iPSC)的定向分化中具有重要的调控作用。有研究表明,FGF-9能够通过其受体(FGFR)激活下游信号通路,从而促进神经干细胞向特定神经细胞类型分化;以及在脂肪干细胞(ASCs)的研究中,FGF-9能够诱导ASCs分化为施万细胞(Schwann cells,SCs,周围神经系统中的神经胶质细胞),这一过程主要通过FGFR2-Akt信号通路实现(图3)[7, 8]2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。


图 3. FGF9 诱导脂肪干细胞(ASCs)分化为施万细胞(SCs)谱系[8]
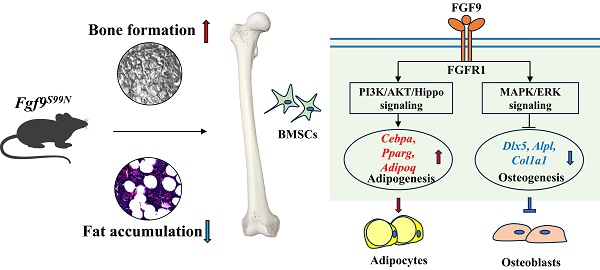
FGF-9(Recombinant Human FGF-9,AbMole,M15032)在上皮细胞的分化中同样发挥着重要作用。研究表明,FGF-9能够加速上皮细胞的内陷过程,并促进上皮细胞向特定表型分化。例如,在牙胚细胞的研究中,FGF-9能够诱导上皮细胞表达牙釉质细胞(ameloblasts)的特异性标志物[9]。在骨髓间充质干细胞(BMSCs)的研究中,FGF-9通过激活MEK/ERK信号通路抑制成骨基因表达,同时通过PI3K/AKT/Hippo信号通路促进脂肪生成和成脂分化(图4)[10]。


图 4. FGF-9通过 PI3K/AKT/Hippo 和 MEK/ERK 信号传导调节骨髓间充质干细胞命运和骨脂平衡[10]
三、 FGF-9(重组FGF-9蛋白)在类器官培养中的应用
FGF-9(Recombinant Human FGF-9,AbMole,M15032)在类器官培养中具有重要作用,尤其是在肾脏类器官的生成过程中。FGF-9(Recombinant Human FGF-9,AbMole,M15032)可以和BMP-2(AbMole,M9990)、BMP-4(AbMole,M9759)、BMP-7(AbMole,M11480)、Activin A(AbMole,M15046)等细胞因子,以及CHIR-99021(AbMole,M1692)等多种小分子化合物联用,以有效促进肾脏祖细胞的形成和分化。例如,在一项研究中,通过在培养基中添加FGF-9,研究人员成功将诱导多能干细胞(hiPSCs)和胚胎干细胞(hESCs)分化为肾祖细胞(图5)[11],并且该类器官还可形成肾小管和肾小球结构[11]。值得注意的是FGF-9不仅仅在肾脏类器的早期培养中提高肾祖细胞的形成效率,而且在后续的3D培养中可促进肾脏类器官的成熟和功能化。

 图 5. 从 hPSC 生成肾脏类器官后的免疫荧光图[11]
图 5. 从 hPSC 生成肾脏类器官后的免疫荧光图[11]FGF-9(Recombinant Human FGF-9,AbMole,M15032)也是肝脏类器官生成的关键细胞因子之一[12],FGF-9通常与其他生长因子联合使用,以实现最佳的细胞增殖和分化效果,例如BMP4(AbMole,M9759)、HGF(AbMole,M10352)等细胞因子。FGF-9在维持肝脏类器官的长期培养中也发挥重要作用,它能够促进细胞的增殖和功能维持[13]。FGF-9在其他类型的类器官培养中也显示出潜在的应用价值。例如,在脑类器官的培养中,FGF-9被用于促进神经干细胞的增殖和分化[13]。在肺类器官的培养中,FGF-9也被用于促进肺上皮细胞的分化和成熟[14]。
AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] FGF9 promotes mouse spermatogonial stem cell proliferation mediated by p38 MAPK signalling %J Cell Proliferation, (2020).
[2] HasibullahSuzuki Habibi, AkinobuHayashi, KazunoriSalimi, HamidullahTerai, HidetomiHori, YusukeTamai, KojiOrita, KumiOhyama, ShoichiroYabu, AkitoMaruf, Mohammad HasibNakamura, Hiroaki %J The spine journal: official journal of the North American Spine Society, Expression and function of FGF9 in the hypertrophied ligamentum flavum of lumbar spinal stenosis patients, 21(6) (2021).
[3] Angela Au, Anna Polotsky, Karol Krzyminski, et al., Evaluation of thermoreversible polymers containing fibroblast growth factor 9 (FGF-9) for chondrocyte culture, (2004).
[4] 高静韬, Ahmed Hegab, 黑田葵, et al., 小鼠肺上皮干细胞体外增殖和分化特性及其影响因素的初步研究, 38(8) (2018) 11.
[5] Jih Ing. Chuang, Jui Yen. Huang, Shaw Jenq. Tsai, et al., FGF9-induced changes in cellular redox status and HO-1 upregulation are FGFR-dependent and proceed through both ERK and AKT to induce CREB and Nrf2 activation, 89 (2015) 274-86.
[6] Dasol Han, Sun Min Lee, Mookwang Kwon, et al., YAP enhances FGF2-dependent neural stem cell proliferation by induction of fibroblast growth factor receptor expression, 29(18) (2020) -.
[7] C. W. Huang, S. Y. Lu, T. C. Huang, et al., FGF9 induces functional differentiation to Schwann cells from human adipose derived stem cells, Theranostics 10(6) (2020) 2817-2831.
[8] Chia Wei Huang, Shih Yu Lu, Tzu Chieh Huang, et al., FGF9 induces functional differentiation to Schwann cells from human adipose derived stem cells, 10(6) (2020) 2817-2831.
[9] Y. Y. Tai, R. S. Chen, Y. Lin, et al., FGF-9 accelerates epithelial invagination for ectodermal organogenesis in real time bioengineered organ manipulation, Cell communication and signaling : CCS 10(1) (2012) 34.
[10] M. Chen, H. Liang, M. Wu, et al., Fgf9 regulates bone marrow mesenchymal stem cell fate and bone-fat balance in osteoporosis by PI3K/AKT/Hippo and MEK/ERK signaling, International journal of biological sciences 20(9) (2024) 3461-3479.
[11] M. Takasato, P. X. Er, H. S. Chiu, et al., Generation of kidney organoids from human pluripotent stem cells, Nature protocols 11(9) (2016) 1681-92.
[12] 林允祯, 王经琳, 任昊桢, et al., 肝脏疾病类器官模型的研究进展, (2021).
[13] L. Broutier, A. Andersson-Rolf, C. J. Hindley, et al., Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation, Nature protocols 11(9) (2016) 1724-43.
[14] B. R. Dye, D. R. Hill, M. A. Ferguson, et al., In vitro generation of human pluripotent stem cell derived lung organoids, eLife 4 (2015).
相关文章
更多 >

