蛋白质半衰期的监测方案及常用方法环己酰亚胺(CHX)介绍
2025-09-05 来源:本站 点击次数:64蛋白质?半衰期?
是的!你体内的蛋白质是有寿命滴~处于不断合成与降解的动态平衡中。
本期,我们一起来看看蛋白质半衰期的监测方案有哪些?
Section.01
蛋白质也有半衰期!
蛋白质的......半衰期?是的!这是一个通用术语。
在物理学中,半衰期 (Half-life) 是描述放射性核素衰变速率的一个基本概念,指放射性核素衰变至原有数量一半所需的时间。当然,这也是我们最熟知的。而在蛋白质稳态中,蛋白质半衰期也是十分重要的!先看图!
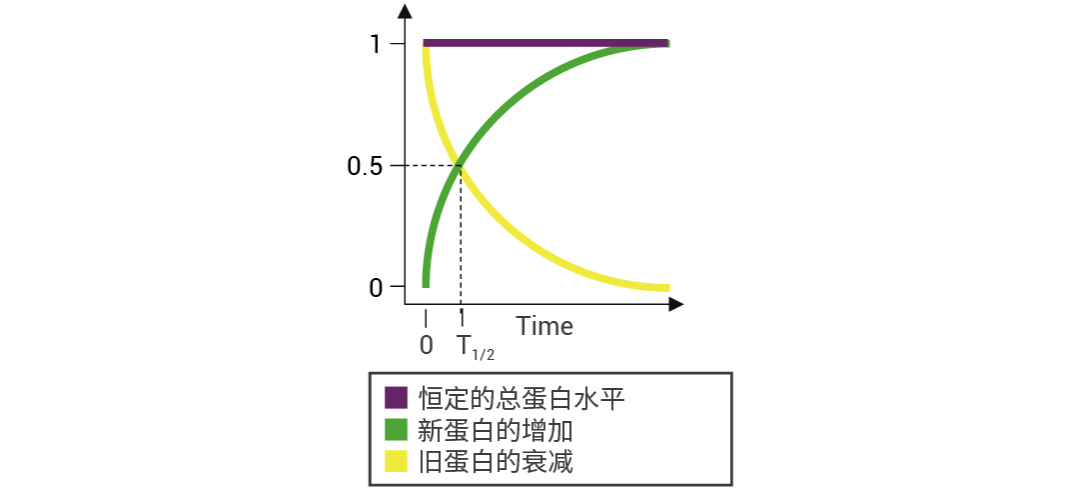 图 1. 蛋白质半衰期示意图[1]。
图 1. 蛋白质半衰期示意图[1]。
在所有细胞中,蛋白质不断地合成和降解,这一动态过程称为蛋白质周转 (protein turnover),以维持蛋白质稳态。在此过程中,旧蛋白质降解为氨基酸,随后通过细胞内蛋白质合成被新蛋白质取代[1][2]。
图中的 T1/2 就是指蛋白质的半衰期 (Protein half-life) —— 即蛋白质降解一半所需的时间,是衡量蛋白质动态变化的重要指标,反映了蛋白质在细胞内的稳定性[3]。一般来说,蛋白质的半衰期越短,说明其降解速度越快,蛋白质“寿命”也就越短;半衰期越长,降解速度则越慢,蛋白质“寿命”也就相对较长。
本期为大家介绍研究蛋白质降解的常用方法——环己酰亚胺 (CHX)。
Section.02
CHX 追踪分析
环己酰亚胺
环己酰亚胺(Cycloheximide, CHX) 是一种真核生物蛋白质合成抑制剂,可以与真核细胞蛋白质合成过程中核糖体 60S 亚基的 E-位点结合,阻断核糖体易位过程并阻止新蛋白质的合成,而细胞中已有的蛋白质逐渐降解,通过测定降解速率能检测细胞中特定蛋白质的变化过程。
自 1947 年从 Streptomyces griseus 中被发现以来,CHX 广泛用于真核生物蛋白质合成的抑制剂[4]。CHX 可阻断蛋白质翻译。随后,使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和免疫印迹法检查目标蛋白质“追踪”水平的降低情况。可以通过同时监测控制稳定的内源性蛋白质 (例如,微管蛋白或肌动蛋白) 的丰度来标准化生成的降解曲线[5]。
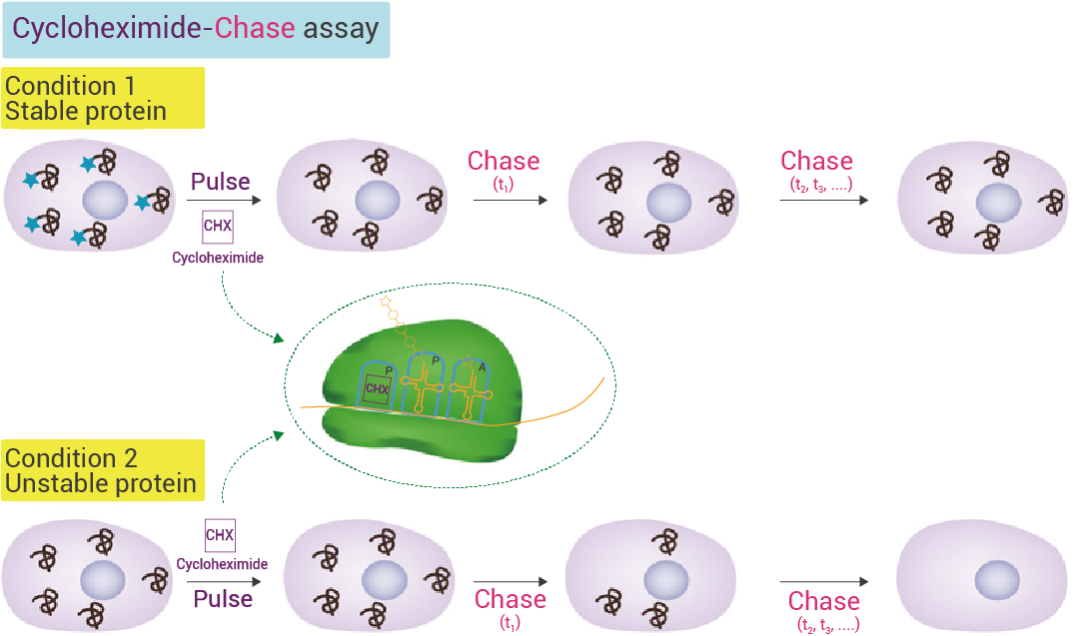 图 2. CHX 追踪分析[5]。
图 2. CHX 追踪分析[5]。
作为蛋白质翻译阻滞剂,CHX 操作简便,无需使用放射性同位素,不需要考虑正在进行的蛋白质合成的影响,并且可以进行高通量筛选喔~
实验验证
- CHX 使用方法:用不同浓度的 CHX 处理细胞,处理不同时间点收集细胞进行 WB 实验检测蛋白质水平的变化
- 结果检测:半衰期短的蛋白质降解速度快,半衰期长的蛋白质降解速度慢。因此在 WB 检测中,前者条带强度迅速减弱,后者条带强度变化不明显。
MCE 独家验证
为了检测 HCT 116 细胞中 CHX (HY-12320) 对 MDM2、c-Myc 蛋白的稳定性影响,利用 CHX 免疫印记分析 MDM2、c-Myc 蛋白稳定性。结果表明,CHX 促进 MDM2、c-Myc 蛋白的降解,并且表现出不同批次间的一致性。
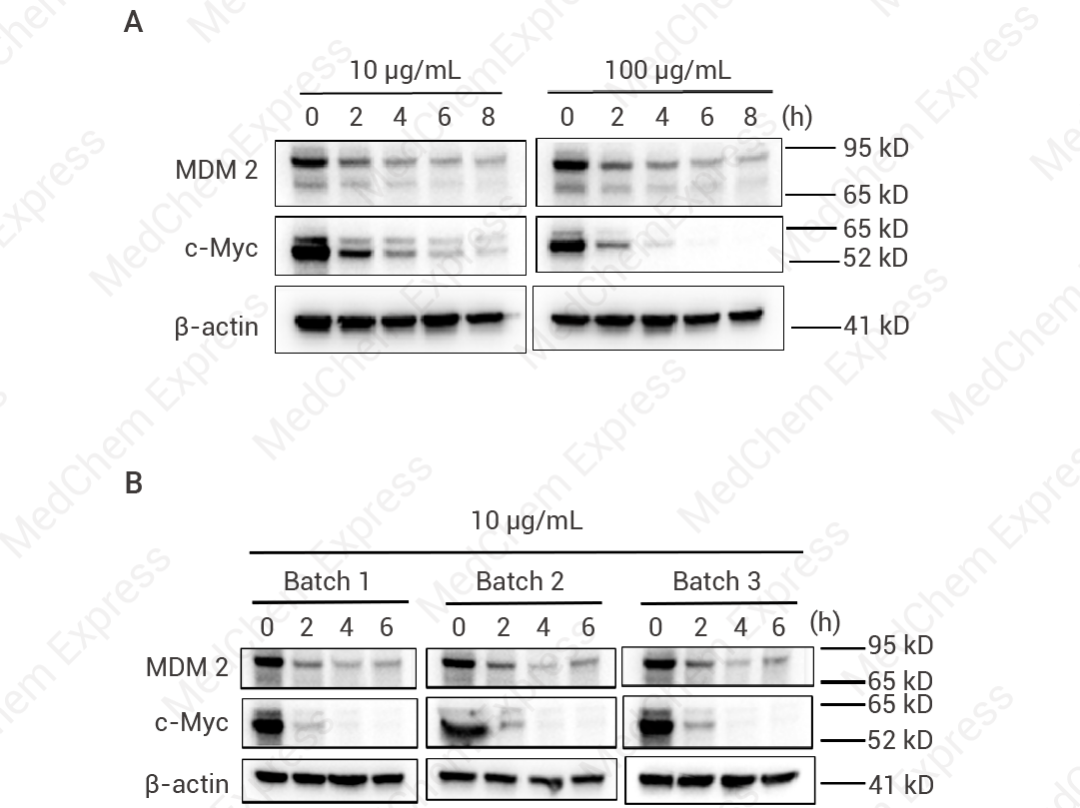 图 3. CHX 抑制MDM2、c-Myc 蛋白的表达。
图 3. CHX 抑制MDM2、c-Myc 蛋白的表达。
(A) 用HCT 116 细胞分别用 10 μg/mL 和 100 μg/mL 的 CHX 处理 0、2、4、6 和 8 小时,通过 Western blot 检测 MDM2 和 c-Myc 的表达。(B) HCT 116 细胞用 10 μg/mL 的 CHX 处理 0、2、4 和 6 小时,通过 Western blot 检测不批次间 MDM2 和 c-Myc 的表达。
CHX 追踪案例
CHX 可用于测定不同条件下蛋白质稳定性/半衰期的变化,例如敲除与野生型、过表达或敲低的情况。
以文献研究为例,为了检测 shCtrl 或 shAHI 1 转染的 A549 细胞中 CHX 对 Tyk2 蛋白的稳定性影响,利用环己酰亚胺 (CHX) 免疫印记分析 Tyk2 蛋白稳定性[6]。
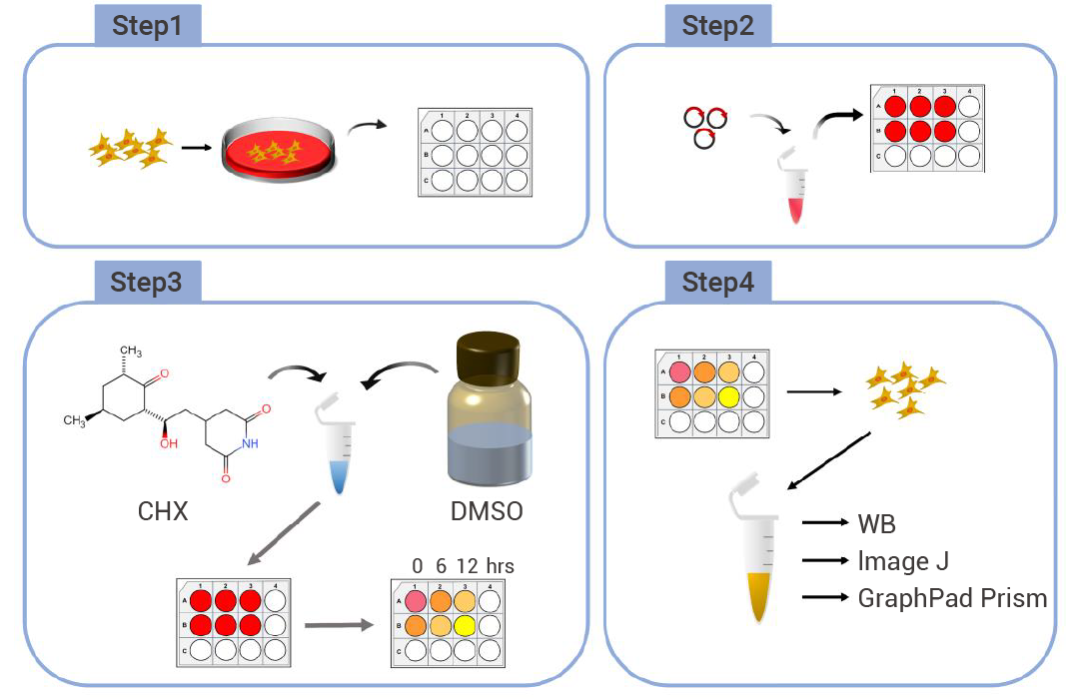 图 4. CHX 追踪测定的完整实验程序[6]。
图 4. CHX 追踪测定的完整实验程序[6]。结果表明,CHX 促进 Tyk2 蛋白的降解,而 AHI 1 缺陷显著加速 A549 细胞中 Tyk 2 蛋白的降解。
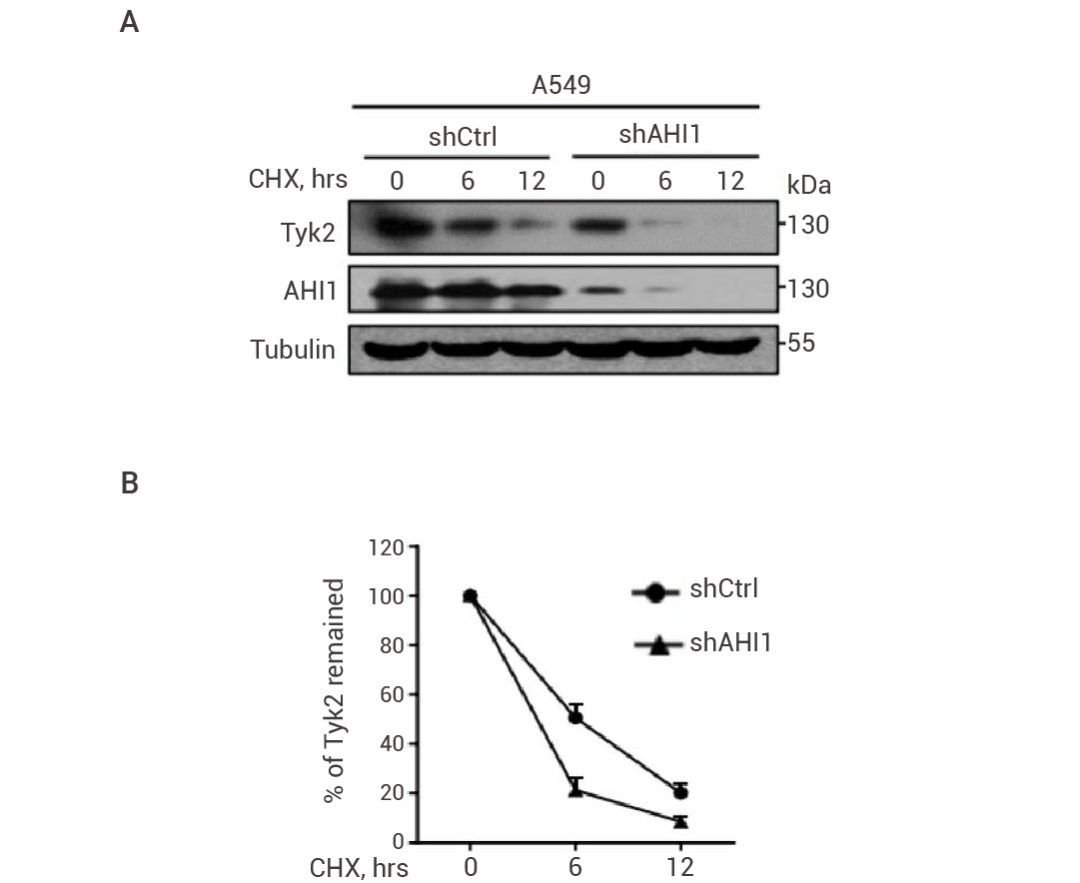 图 5. AHI 1 敲低加速 CHX 对 Tyk2 蛋白的降解[6]。
图 5. AHI 1 敲低加速 CHX 对 Tyk2 蛋白的降解[6]。(A) 用 shRNA (shCtrl) 或 shAHI 1 转染的 A549 细胞中,转染 72 小时后,用 DMSO 或环己酰亚胺(CHX,50 μg/mL)处理细胞 0, 6, 12 h,进行 Tyk 2 蛋白水平的蛋白质印迹分析。(B) 将 Tyk 2 和微管蛋白的条纹图像导入 Image J。测量所有条带的像素计数,然后在 GraphPad Prism 软件中计算剩余 Tyk 2 的百分比。
注意事项
1. 蛋白质的降解速率可能存在很大差异,因此建议事先使用 CHX 追踪实验确定蛋白质降解的时间进程。一些内源性蛋白质降解非常迅速,因此 CHX 的处理时间可以调整为 30-60 min。有时只需设置五个时间点即可检测蛋白质的半衰期。
2. 不同细胞系对 CHX 敏感度不同,检测指标蛋白质之间的降解速率可能差异很大。在进行正式的实验之前,建议参考文献,提前做预实验 (摸索 CHX 处理时间、浓度,抗体条件),确定实验方案合理可行。
3. 传代次数、细胞状态、细胞密度都可能会影响实验效果。需要调整细胞状态至较好时开展实验。
4. CHX 具有细胞毒性,配制和使用过程中需在通风良好的环境中进行,注意防护。药物现配现用,可超声助溶,直至溶液澄清透明;应避光、低温保存,避免其分解失效。
5. 对实验结果进行量化分析,例如通过灰度值分析计算蛋白条带的强度,以准确评估蛋白质的降解程度。分析数据时要考虑到实验的重复性和统计学意义。
但另一方面,CHX 能够非特异性地阻断所有蛋白质翻译;以及不适用于降解速度慢的蛋白质,因为其具有高细胞毒性,长时间处理后能够导致大规模细胞死亡。因此,小伙伴们需要根据适当的条件选择 CHX[6]。
Section.03
其他监测方法
目前,除了 CHX 法,还有多种不同的方法来监测蛋白质降解率和估计蛋白质半衰期,小 M 为大家整理在下方表格中,包括脉冲追踪测定、质谱技术、CuAAC (铜催化叠氮化物-炔烃环加成物) 标记法[6][7][8][9]。


此外,可以通过向细胞中添加降解途径的药物抑制剂来研究蛋白质降解,例如,蛋白酶体抑制剂 MG-132,与 CHX 结合起来也能够验证蛋白质的稳定性和降解。
"搭档"MG132
MG132 (HY-13259) 是一种常用的蛋白酶体降解抑制剂,通过与 β 亚基的活性位点共价结合抑制 20S 蛋白酶体的活性,并有效阻断 26S 蛋白酶体复合物的蛋白水解活性,使泛素化蛋白质在细胞内积累[10]。
CHX 追踪案例
为了检测 NSC34 运动神经元细胞中抑制蛋白酶体系统是否可以抵消 CHX 处理后的 a-SMN 快速降解。在存在或不存在 MG 132 的情况下,利用 CHX 免疫印记检测 FL-SMN 和 a-SMN 蛋白的稳定性。结果表明,CHX 促进 FL-SMN 和 a-SMN 蛋白的降解,而 MG 132 延长了 FL-SMN 和 a-SMN 蛋白的半衰期。
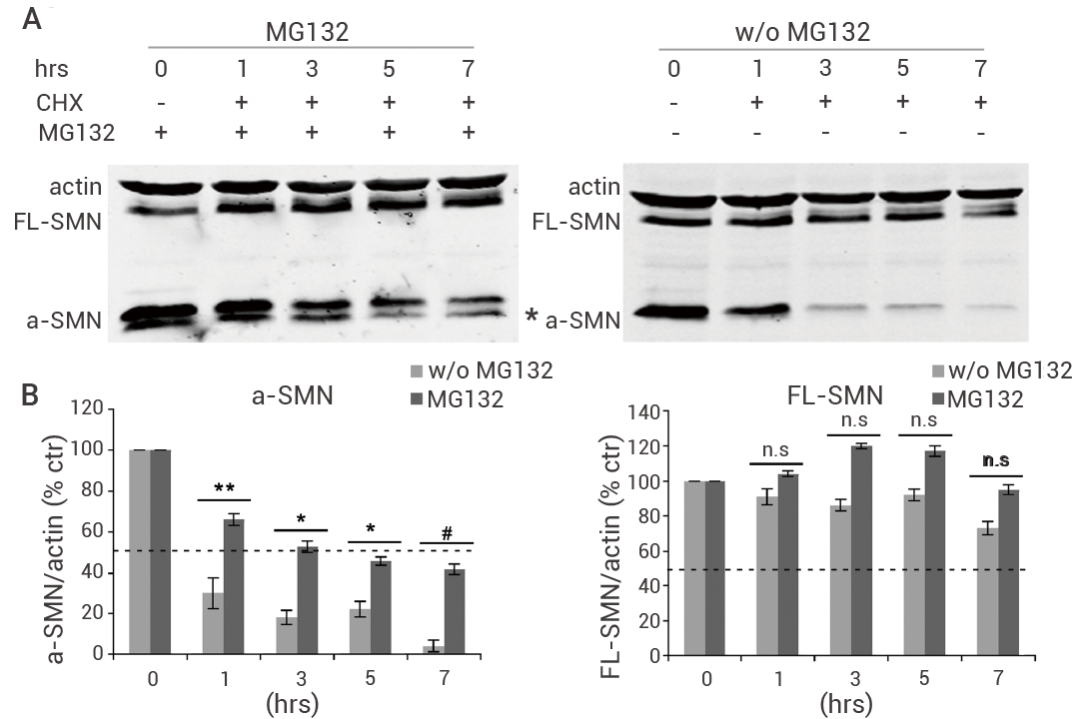 图 6. MG132 增加了 FL-SMN 和 a-SMN 蛋白的稳定性[11]。
图 6. MG132 增加了 FL-SMN 和 a-SMN 蛋白的稳定性[11]。(A) 存在或 (B) 不存在 MG 132 的情况下,用 N-末端标记的人 FL-SMN 和 a -SMN 共转染 NSC 34 细胞,然后用 100 μg/mL CHX 处理 0、1、3、5 和 7 小时,通过 Western blot 检测 FL-SMN 和 α-SMN 的表达。(w/o MG132: without MG132;a-SMN:较短的 SMN 亚型)
当然,还有环氧霉素和硼替佐米通过泛素-蛋白酶体途径阻断蛋白质降解。氯喹和 bafilomycin A1 等抑制剂通过中和溶酶体内的酸性 pH 值发挥作用[6]。
Section.04
小结
CHX 作为蛋白质合成抑制剂,在测量蛋白质半衰期的实验中发挥着重要作用。但在实际应用中,需要综合考虑其优缺点哦~合理选择和运用 CHX 测量方法,以获取准确可靠的蛋白质半衰期数据,为深入研究蛋白质的功能和调控机制提供有力支持!
|
产品推荐 |
|
Cycloheximide (CHX) (HY-12320) 环己酰亚胺,真核生物蛋白质合成抑制剂 |
|
蛋白酶体抑制剂 |
|
蛋白酶体抑制剂 |
|
20S 蛋白酶体抑制剂 |
|
自噬抑制剂;PI3K 抑制剂 |
|
20S 蛋白酶体抑制剂 |
|
自噬晚期阶段抑制剂;V-ATPase 抑制剂 |
|
可用于人、猴背景下的 WB、ICC/IF、IHC-P 实验 |
|
用于人、小鼠、大鼠背景下 WB、ICC/IF、IP 实验 |

[1] Ross AB, et al. Proteome Turnover in the Spotlight: Approaches, Applications, and Perspectives. Mol Cell Proteomics. 2021;20:100016.
[2] Fornasiero EF, et al. Determining and interpreting protein lifetimes in mammalian tissues. Trends Biochem Sci. 2023 Feb;48(2):106-118.
[3] Ghosh R, et al. Protein and Mitochondria Quality Control Mechanisms and Cardiac Aging. Cells. 2020 Apr 10;9(4):933.
[4] Zhang B, et al. Overproduction of lactimidomycin by cross-overexpression of genes encoding Streptomyces antibiotic regulatory proteins. Appl Microbiol Biotechnol. 2016 Mar;100(5):2267-77.



