高选择性AKT抑制剂Capivasertib的作用机制及抗肿瘤研究应用
2025-09-05 来源:本站 点击次数:30
Capivasertib是一种针对丝氨酸/苏氨酸蛋白激酶AKT(又称蛋白激酶 B)的小分子抑制剂。由于AKT通路的异常激活与多种生理过程密切相关,针对该通路的研究成为近年来的科研热点。Capivasertib(AZD5363,AbMole,M2303)凭借其对AKT多个亚型(AKT1/2/3)的抑制活性,为探索AKT通路的功能及相关生物学机制提供了重要工具。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、Capivasertib(AZD5363)的作用机制
Capivasertib(AZD5363,AbMole,M2303)是一种高亲和力、ATP 竞争型泛AKT(pan-AKT)抑制剂,可高效抑制AKT1、AKT2 和 AKT3的活性。Capivasertib的化学结构包含特殊的嘧啶环,该结构可与AKT激酶结构域中的ATP 结合位点形成氢键,从而抑制AKT的激酶活性,最终阻断下游信号通路的传导。体外酶学实验表明,该抑制剂对AKT1、AKT2 和AKT3 的半数抑制浓度(IC50)分别为3 nM、7 nM和7 nM[1]。与其他AKT抑制剂相比,Capivasertib具有更强的抑制剂活性,并且对其它激酶家族(如 PDK、PKC)的抑制活性较低[1]。
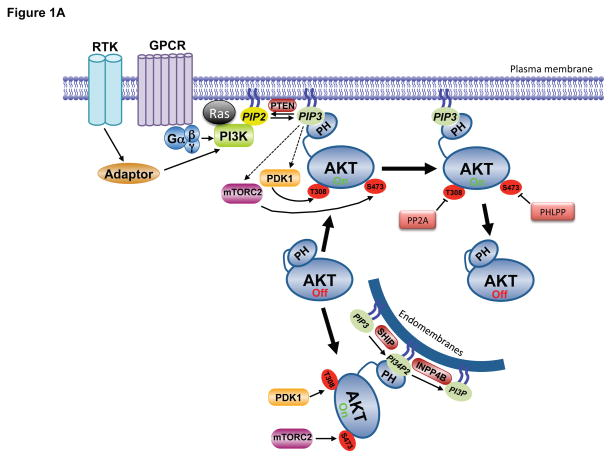

二、Capivasertib(AZD5363)的科研应用
1. Capivasertib(AZD5363)通过阻断AKT通路抑制肿瘤细胞增殖
Capivasertib(AZD5363,AbMole,M2303)处理细胞后,可显著降低AKT下游底物的磷酸化水平。例如用 1 μM的Capivasertib(AZD5363)处理BT474细胞24小时,通过蛋白质免疫印迹分析发现,AKT下游的GSK3β、FOXO1等底物的磷酸化水平明显下降[3]。这一现象明确表明Capivasertib可有效阻断AKT信号的向下传递,进而对细胞的多种生物学行为产生影响。在多种肿瘤细胞模型中,Capivasertib 的作用效果显著。如使用Capivasertib处理MCF-7乳腺癌细胞后,细胞周期停滞在G1期,同时促进细胞凋亡相关分子如 Bax 的表达上调,促使细胞走向凋亡[4]。Capivasertib还能抑制MDA-MB-231乳腺癌细胞的上皮间质转化过程,减少细胞的迁移与侵袭能力,这对于深入理解肿瘤细胞的转移机制具有重要意义[5]。
2. Capivasertib(AZD5363)通过阻断AKT通路影响肿瘤细胞代谢
Capivasertib(AZD5363,AbMole,M2303)作为AKT的选择性抑制剂,可通过阻断PI3K/Akt信号通路的异常激活,显著调控肿瘤细胞的代谢。例如Capivasertib 通过抑制AKT进而影响PFKFB3/4、丙酮酸激酶 M2(PKM2)等糖酵解过程中的关键催化酶[6],实现了对肿瘤细胞糖代谢的调控。在脂质合成方面,Capivasertib(AZD5363)对 AKT 的抑制可减少 ATP 柠檬酸裂解酶(ACLY)的磷酸化激活,并下调固醇调节元件结合蛋白(SREBP)的表达,从而从头抑制脂质合成,限制了肿瘤细胞快速分裂所需磷脂的生物合成[6]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
3. Capivasertib(AZD5363)用于动物肿瘤模型研究
Capivasertib(AZD5363,AbMole,M2303)可在多种移植瘤的动物模型中表现出抑瘤活性。例如在PIK3突变(ST3632、ST3932、CTC174等突变)导致的乳腺癌小鼠模型(NOD-SCID 雌鼠)的研究中,Capivasertib以100 mg/kg的剂量和每周4次的注射频次,有效抑制了肿瘤细胞的体积增长,并且不会导致小鼠体重的明显变化[7]。Capivasertib(AZD5363)还能用于AKT1 突变型(E17K突变)乳腺癌细胞的类器官模型(PDO)研究[8]。Capivasertib在肝细胞癌(HCC)模型中也显示出抗肿瘤效果,并且通过下调Akt及其下游分子的激活,改善肿瘤反应,减少肝纤维化[9]。
4. Capivasertib用于非肿瘤模型研究
在某些自身免疫性疾病(如类风湿关节炎、银屑病)中,免疫细胞(如 T 细胞、B 细胞)的过度活化及组织细胞(如滑膜细胞、角质形成细胞)的异常增殖常依赖 PI3K/AKT 通路。Capivasertib(AZD5363,AbMole,M2303)可在体外抑制滑膜成纤维细胞(MH7A)的AKT活性,减少其异常增殖及侵袭性[10]。此外,Capivasertib(AZD5363)还对血管内皮细胞、免疫细胞的AKT激酶活性表现出抑制作用[11, 12]。
三、范例详解
Oxidative medicine and cellular longevity 2021 (2021) 6662225.
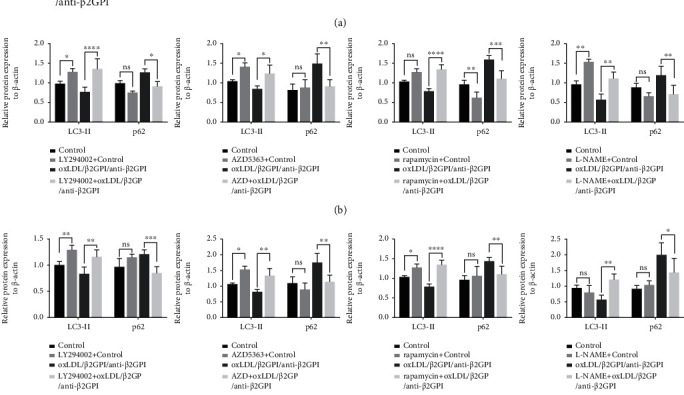
江苏省人民医院的研究人员在上述论文中探讨了oxLDL/β2GPI/anti-β2GPI complex(氧化低密度脂蛋白 /β2 糖蛋白 I / 抗 β2 糖蛋白 I 抗体复合物)对血管内皮细胞自噬的影响及其分子机制,目的是为了揭示内皮自噬与动脉粥样硬化(AS)的之间的关系。该研究使用了人脐静脉内皮细胞(HUVECs)和小鼠脑内皮细胞系(bEnd.3)。结果显示oxLDL/β2GPI/anti-β2GPI 复合物显著降低 LC3-II 和 Beclin1 等自噬标志物的表达,增加 p62 积累,减少自噬体生成,且通过阻断自噬起始,抑制自噬流。在分子机制上,oxLDL/β2GPI/anti-β2GPI复合物可激活 PI3K/AKT/mTOR 通路(磷酸化PI3K、AKT、mTOR水平升高)和eNOS通路(磷酸化 eNOS 水平升高),而AKT 抑制剂(AZD5363)可抑制eNOS激活,证明eNOS是AKT的下游靶标。综上,研究证实了oxLDL/β2GPI/anti-β2GPI 复合物通过激活 PI3K/AKT/mTOR 和 eNOS 信号通路抑制内皮细胞自噬,进而促进炎症、氧化应激和凋亡,导致内皮细胞功能障碍,并引起AS。上述文章使用了AbMole提供的Capivasertib(AZD5363,AbMole,M2303)作为AKT的抑制剂[12]。

AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] B. R. Davies, H. Greenwood, P. Dudley, et al., Preclinical pharmacology of AZD5363, an inhibitor of AKT: pharmacodynamics, antitumor activity, and correlation of monotherapy activity with genetic background, Molecular cancer therapeutics 11(4) (2012) 873-87.
[2] B. D. Manning, A. Toker, AKT/PKB Signaling: Navigating the Network, Cell 169(3) (2017) 381-405.
[3] Y. Zhang, Y. Zheng, A. Faheem, et al., A novel AKT inhibitor, AZD5363, inhibits phosphorylation of AKT downstream molecules, and activates phosphorylation of mTOR and SMG-1 dependent on the liver cancer cell type, Oncology letters 11(3) (2016) 1685-1692.
[4] R. Ribas, S. Pancholi, S. K. Guest, et al., AKT Antagonist AZD5363 Influences Estrogen Receptor Function in Endocrine-Resistant Breast Cancer and Synergizes with Fulvestrant (ICI182780) In Vivo, Molecular cancer therapeutics 14(9) (2015) 2035-48.
[5] Local anaesthetic use in cancer surgery and disease recurrence: role of voltage-gated sodium channels? British Journal of Anaesthesia, 2015; 113(6): 899-902, DOI 10.1093/bja/aeu221, British journal of anaesthesia 114(6) (2015) 1014.
[6] F. Fontana, G. Giannitti, S. Marchesi, et al., The PI3K/Akt Pathway and Glucose Metabolism: A Dangerous Liaison in Cancer, International journal of biological sciences 20(8) (2024) 3113-3125.
[7] L. Hopcroft, E. M. Wigmore, S. C. Williamson, et al., Combining the AKT inhibitor capivasertib and SERD fulvestrant is effective in palbociclib-resistant ER+ breast cancer preclinical models, NPJ breast cancer 9(1) (2023) 64.
[8] L. M. Smyth, K. Tamura, M. Oliveira, et al., Capivasertib, an AKT Kinase Inhibitor, as Monotherapy or in Combination with Fulvestrant in Patients with AKT1 (E17K)-Mutant, ER-Positive Metastatic Breast Cancer, Clinical cancer research : an official journal of the American Association for Cancer Research 26(15) (2020) 3947-3957.
[9] M. Mroweh, G. Roth, T. Decaens, et al., Targeting Akt in Hepatocellular Carcinoma and Its Tumor Microenvironment, International journal of molecular sciences 22(4) (2021).
[10] 高敏婵, 王鹏, 胡泽瑞, et al., 卡帕塞替尼对类风湿关节炎成纤维样滑膜细胞MH7A增殖、迁移、侵袭、凋亡及自噬的影响实验研究,陕西医学杂志,Shaanxi Medical Journal, 54(6) (2025) 742-747.
[11] J. Zuo, Q. Guo, X. Fu, et al., Stem cells of human exfoliated deciduous teeth -delivered miR-200c-3p contained in small extracellular vesicles regulates M2 macrophage polarization via PTEN/PI3K/Akt pathway in vitro, Biochemical and biophysical research communications 777 (2025) 152259.
[12] G. Zhang, C. He, Q. Wu, et al., Impaired Autophagy Induced by oxLDL/β2GPI/anti-β2GPI Complex through PI3K/AKT/mTOR and eNOS Signaling Pathways Contributes to Endothelial Cell Dysfunction, Oxidative medicine and cellular longevity 2021 (2021) 6662225.
一、Capivasertib(AZD5363)的作用机制
Capivasertib(AZD5363,AbMole,M2303)是一种高亲和力、ATP 竞争型泛AKT(pan-AKT)抑制剂,可高效抑制AKT1、AKT2 和 AKT3的活性。Capivasertib的化学结构包含特殊的嘧啶环,该结构可与AKT激酶结构域中的ATP 结合位点形成氢键,从而抑制AKT的激酶活性,最终阻断下游信号通路的传导。体外酶学实验表明,该抑制剂对AKT1、AKT2 和AKT3 的半数抑制浓度(IC50)分别为3 nM、7 nM和7 nM[1]。与其他AKT抑制剂相比,Capivasertib具有更强的抑制剂活性,并且对其它激酶家族(如 PDK、PKC)的抑制活性较低[1]。


图 1. AKT信号通路[2]
二、Capivasertib(AZD5363)的科研应用
1. Capivasertib(AZD5363)通过阻断AKT通路抑制肿瘤细胞增殖
Capivasertib(AZD5363,AbMole,M2303)处理细胞后,可显著降低AKT下游底物的磷酸化水平。例如用 1 μM的Capivasertib(AZD5363)处理BT474细胞24小时,通过蛋白质免疫印迹分析发现,AKT下游的GSK3β、FOXO1等底物的磷酸化水平明显下降[3]。这一现象明确表明Capivasertib可有效阻断AKT信号的向下传递,进而对细胞的多种生物学行为产生影响。在多种肿瘤细胞模型中,Capivasertib 的作用效果显著。如使用Capivasertib处理MCF-7乳腺癌细胞后,细胞周期停滞在G1期,同时促进细胞凋亡相关分子如 Bax 的表达上调,促使细胞走向凋亡[4]。Capivasertib还能抑制MDA-MB-231乳腺癌细胞的上皮间质转化过程,减少细胞的迁移与侵袭能力,这对于深入理解肿瘤细胞的转移机制具有重要意义[5]。
2. Capivasertib(AZD5363)通过阻断AKT通路影响肿瘤细胞代谢
Capivasertib(AZD5363,AbMole,M2303)作为AKT的选择性抑制剂,可通过阻断PI3K/Akt信号通路的异常激活,显著调控肿瘤细胞的代谢。例如Capivasertib 通过抑制AKT进而影响PFKFB3/4、丙酮酸激酶 M2(PKM2)等糖酵解过程中的关键催化酶[6],实现了对肿瘤细胞糖代谢的调控。在脂质合成方面,Capivasertib(AZD5363)对 AKT 的抑制可减少 ATP 柠檬酸裂解酶(ACLY)的磷酸化激活,并下调固醇调节元件结合蛋白(SREBP)的表达,从而从头抑制脂质合成,限制了肿瘤细胞快速分裂所需磷脂的生物合成[6]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
3. Capivasertib(AZD5363)用于动物肿瘤模型研究
Capivasertib(AZD5363,AbMole,M2303)可在多种移植瘤的动物模型中表现出抑瘤活性。例如在PIK3突变(ST3632、ST3932、CTC174等突变)导致的乳腺癌小鼠模型(NOD-SCID 雌鼠)的研究中,Capivasertib以100 mg/kg的剂量和每周4次的注射频次,有效抑制了肿瘤细胞的体积增长,并且不会导致小鼠体重的明显变化[7]。Capivasertib(AZD5363)还能用于AKT1 突变型(E17K突变)乳腺癌细胞的类器官模型(PDO)研究[8]。Capivasertib在肝细胞癌(HCC)模型中也显示出抗肿瘤效果,并且通过下调Akt及其下游分子的激活,改善肿瘤反应,减少肝纤维化[9]。
4. Capivasertib用于非肿瘤模型研究
在某些自身免疫性疾病(如类风湿关节炎、银屑病)中,免疫细胞(如 T 细胞、B 细胞)的过度活化及组织细胞(如滑膜细胞、角质形成细胞)的异常增殖常依赖 PI3K/AKT 通路。Capivasertib(AZD5363,AbMole,M2303)可在体外抑制滑膜成纤维细胞(MH7A)的AKT活性,减少其异常增殖及侵袭性[10]。此外,Capivasertib(AZD5363)还对血管内皮细胞、免疫细胞的AKT激酶活性表现出抑制作用[11, 12]。
三、范例详解
Oxidative medicine and cellular longevity 2021 (2021) 6662225.
江苏省人民医院的研究人员在上述论文中探讨了oxLDL/β2GPI/anti-β2GPI complex(氧化低密度脂蛋白 /β2 糖蛋白 I / 抗 β2 糖蛋白 I 抗体复合物)对血管内皮细胞自噬的影响及其分子机制,目的是为了揭示内皮自噬与动脉粥样硬化(AS)的之间的关系。该研究使用了人脐静脉内皮细胞(HUVECs)和小鼠脑内皮细胞系(bEnd.3)。结果显示oxLDL/β2GPI/anti-β2GPI 复合物显著降低 LC3-II 和 Beclin1 等自噬标志物的表达,增加 p62 积累,减少自噬体生成,且通过阻断自噬起始,抑制自噬流。在分子机制上,oxLDL/β2GPI/anti-β2GPI复合物可激活 PI3K/AKT/mTOR 通路(磷酸化PI3K、AKT、mTOR水平升高)和eNOS通路(磷酸化 eNOS 水平升高),而AKT 抑制剂(AZD5363)可抑制eNOS激活,证明eNOS是AKT的下游靶标。综上,研究证实了oxLDL/β2GPI/anti-β2GPI 复合物通过激活 PI3K/AKT/mTOR 和 eNOS 信号通路抑制内皮细胞自噬,进而促进炎症、氧化应激和凋亡,导致内皮细胞功能障碍,并引起AS。上述文章使用了AbMole提供的Capivasertib(AZD5363,AbMole,M2303)作为AKT的抑制剂[12]。


图 2. The regulation of PI3K/AKT/mTOR and eNOS signaling pathways in oxLDL/β2GPI/anti-β2GPI complex-mediated endothelial autophagy[12].
AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] B. R. Davies, H. Greenwood, P. Dudley, et al., Preclinical pharmacology of AZD5363, an inhibitor of AKT: pharmacodynamics, antitumor activity, and correlation of monotherapy activity with genetic background, Molecular cancer therapeutics 11(4) (2012) 873-87.
[2] B. D. Manning, A. Toker, AKT/PKB Signaling: Navigating the Network, Cell 169(3) (2017) 381-405.
[3] Y. Zhang, Y. Zheng, A. Faheem, et al., A novel AKT inhibitor, AZD5363, inhibits phosphorylation of AKT downstream molecules, and activates phosphorylation of mTOR and SMG-1 dependent on the liver cancer cell type, Oncology letters 11(3) (2016) 1685-1692.
[4] R. Ribas, S. Pancholi, S. K. Guest, et al., AKT Antagonist AZD5363 Influences Estrogen Receptor Function in Endocrine-Resistant Breast Cancer and Synergizes with Fulvestrant (ICI182780) In Vivo, Molecular cancer therapeutics 14(9) (2015) 2035-48.
[5] Local anaesthetic use in cancer surgery and disease recurrence: role of voltage-gated sodium channels? British Journal of Anaesthesia, 2015; 113(6): 899-902, DOI 10.1093/bja/aeu221, British journal of anaesthesia 114(6) (2015) 1014.
[6] F. Fontana, G. Giannitti, S. Marchesi, et al., The PI3K/Akt Pathway and Glucose Metabolism: A Dangerous Liaison in Cancer, International journal of biological sciences 20(8) (2024) 3113-3125.
[7] L. Hopcroft, E. M. Wigmore, S. C. Williamson, et al., Combining the AKT inhibitor capivasertib and SERD fulvestrant is effective in palbociclib-resistant ER+ breast cancer preclinical models, NPJ breast cancer 9(1) (2023) 64.
[8] L. M. Smyth, K. Tamura, M. Oliveira, et al., Capivasertib, an AKT Kinase Inhibitor, as Monotherapy or in Combination with Fulvestrant in Patients with AKT1 (E17K)-Mutant, ER-Positive Metastatic Breast Cancer, Clinical cancer research : an official journal of the American Association for Cancer Research 26(15) (2020) 3947-3957.
[9] M. Mroweh, G. Roth, T. Decaens, et al., Targeting Akt in Hepatocellular Carcinoma and Its Tumor Microenvironment, International journal of molecular sciences 22(4) (2021).
[10] 高敏婵, 王鹏, 胡泽瑞, et al., 卡帕塞替尼对类风湿关节炎成纤维样滑膜细胞MH7A增殖、迁移、侵袭、凋亡及自噬的影响实验研究,陕西医学杂志,Shaanxi Medical Journal, 54(6) (2025) 742-747.
[11] J. Zuo, Q. Guo, X. Fu, et al., Stem cells of human exfoliated deciduous teeth -delivered miR-200c-3p contained in small extracellular vesicles regulates M2 macrophage polarization via PTEN/PI3K/Akt pathway in vitro, Biochemical and biophysical research communications 777 (2025) 152259.
[12] G. Zhang, C. He, Q. Wu, et al., Impaired Autophagy Induced by oxLDL/β2GPI/anti-β2GPI Complex through PI3K/AKT/mTOR and eNOS Signaling Pathways Contributes to Endothelial Cell Dysfunction, Oxidative medicine and cellular longevity 2021 (2021) 6662225.
相关文章
更多 >

