RNA干扰技术介导基因沉默的原理及其应用场景和临床应用
2025-10-30 来源:本站 点击次数:46Section.01
RNA 干扰技术
RNA 干扰是一种通过 RNA 分子介导的基因沉默机制,相较于常规的抑制剂,RNA 干扰技术具有无靶点限制、特异性强、生物毒性低等优点。常见的应用于 RNA 干扰的寡核苷酸有小干扰 RNA (siRNA)、微小 RNA (miRNA) 和反义寡核苷酸 (ASO) 等 (图 1) ,其基本原理是利用 siRNA、miRNA 或 ASO 与特定的目标基因 mRNA 序列相互作用,从而诱导靶基因的降解或抑制其翻译,进而实现对特定基因的沉默或抑制。
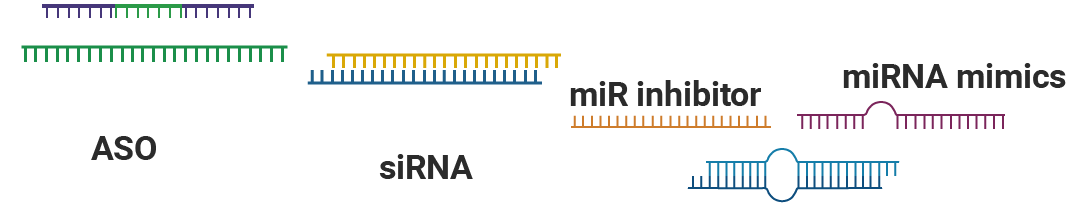 图 1. 常见的 RNA 干扰寡核苷酸。
图 1. 常见的 RNA 干扰寡核苷酸。Section.02
siRNA、miRNA 和 ASO
如何介导基因沉默?
miRNA、siRNA 属于双链 RNA,一般包含 20 个左右的核苷酸。短发夹 RNA (shRNA) 是单链 RNA。shRNA 被设计成能够形成发夹结构,当进入细胞后,shRNA 被 Dicer 酶切割成 siRNA。
原理:miRNA、siRN 或 shRNA 进入细胞质中,短双链 RNA 解旋后正义链被降解。反义链与多种蛋白组分形成 RNA 诱导的沉默复合体 (RNA Induced Silencing Complex, RISC) 。RISC 中保留的反义链与靶基因的 mRNA 特异地互补,同时 RISC 具有核酸酶活性,能将靶基因的 mRNA 切割降解,抑制靶基因的表达 (图 2) 。
值得注意的一点是,如果 siRNA 或者 miRNA 和 mRNA 不完全互补,则 siRNA 或者 miRNA 与靶基因的 3’ 端-非翻译区的序列形成非完全互补的杂交双链,miRISC 结合在杂交双链上,特异性的抑制基因表达。
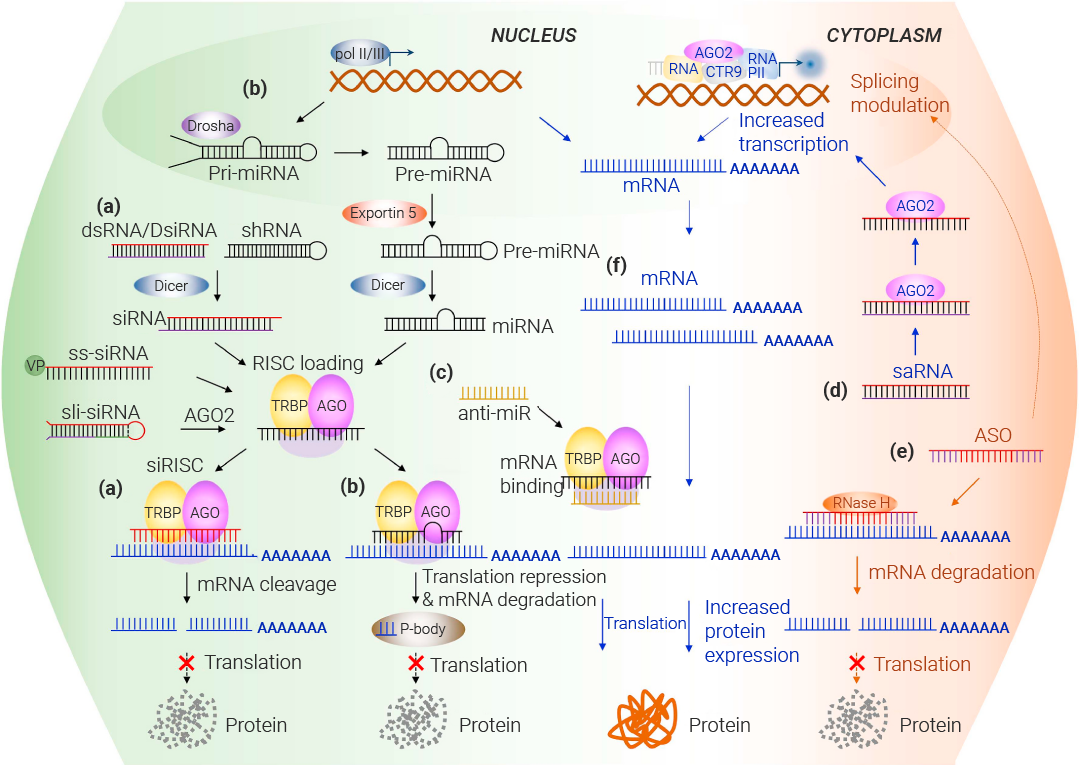 图 2. siRNA、miRNA、shRNA、ASO 的作用机制[1]。
图 2. siRNA、miRNA、shRNA、ASO 的作用机制[1]。反义寡核苷酸 (ASOs) 通常指的是短小的、人工合成的单链 DNA 或 RNA (13 至 30 个核苷酸)。反义寡核苷酸的作用机制主要包括两种方式:一是通过空间阻挡,干扰其他分子与靶 RNA 的结合;二是诱导靶 mRNA 降解。反义寡核苷酸能够与成熟 mRNA 结合阻止其附着在核糖体上,阻断蛋白质翻译或招募 RNase H 引起 mRNA 的降解 (图 2)。
除了上述这些 RNA 干扰技术之外,小激活 RNA (saRNA) 作为一种能够特异性的上调基因表达的寡核苷酸,也已经应用于基因功能的研究中。
saRNA:
saRNA,一类非编码 RNA,结构类似于siRNA,但生物学功能完全相反。siRNA 可以分别与 AGO1、AGO2、AGO3 和 AGO4 四种蛋白结合以获得活性,而 saRNA 只能被特异性地加载到 AGO2 蛋白行使功能。
saRNA 的作用机制如下:
1)外源性 saRNA 被加载到细胞质中的 AGO2 蛋白上;
2)AGO2 蛋白通过切割和丢弃其中一条 RNA 链,形成一个活性的 AGO2-RNA 复合物,并进入细胞核;
3)AGO2-RNA 复合物将结合到基因组 DNA 序列或 DNA 相连的反义转录本序列,进一步形成 RNA 诱导的转录激活复合物;
4)该复合物与 hnRNPs、RNAPⅡ 和各种转录因子结合,诱导靶基因表达。
SaRNA 作为一种新兴的基因调控技术,其具有的小分子量、基因特异性,以及激活基因表达的作用特点使其成为正向调节基因表达的药物热门候选。
Section.03
RNA 干扰技术的应用
miRNA 有哪些应用场景?
miRNA 模拟物是与相应 miRNA 序列互补的合成双链小 RNA 分子,因此在研究中常用于功能性地补充缺失的 miRNA。miRNA inhibitor 具有与要抑制的 miRNA 相互补的序列,并通过与相应 miRNA 紧密结合来阻断其功能。
miRNA agomirs 和 miRNA antagomirs 是 miRNA mimic 和 miRNA inhibitor 的化学修饰版本,该核酸采用特殊化学修饰和末端标记技术。无需转染试剂即可用于体内实验,通过尾静脉或局部注射等方法给药至动物体内。
siRNA 有哪些应用场景?
关于 siRNA,往期小 M 为大家详细介绍过 siRNA 的机制、设计、体外转染与注意事项等,详见:干货分享 | 如何做 RNA 干扰实验? (常见问题+解决方案)
对于 siRNA 体内实验而言,由于动物的体内环境复杂,实验周期长,对 siRNA 产品的稳定性提出了更高的要求。所以一般用于动物实验的 siRNA 需要做化学修饰。MCE 的预设计套装中的 siRNA 没有做过化学修饰,所以不适合用于动物实验。不过我们可以提供不同化学修饰的 siRNA 的定制服务。除了常规的化学修饰以外, MCE 也提供包括 GalNAc 偶联在内的多种偶联修饰方法 (图 3)。
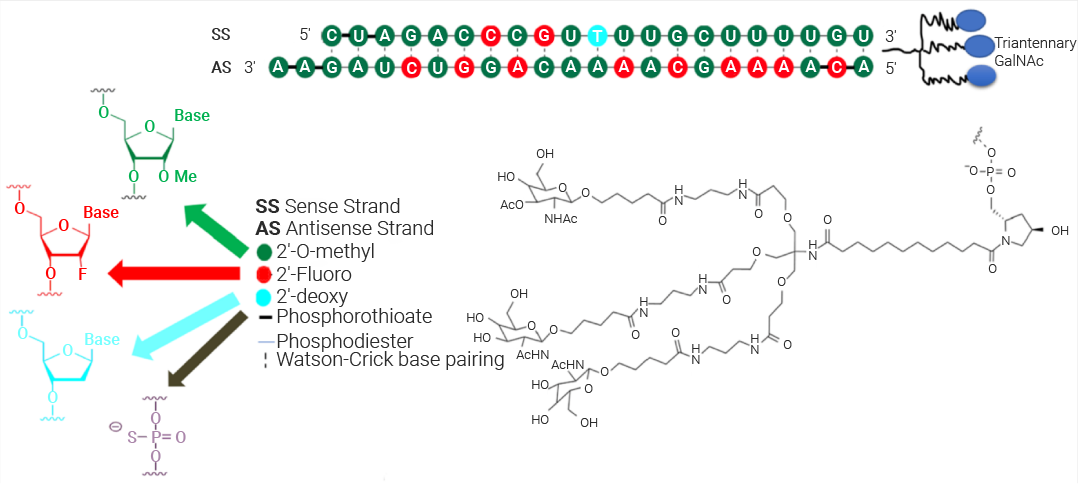 图 3. 因克西兰的化学结构:N-乙酰半乳糖胺(GalNAc)偶联介导的肝靶向递送。GalNAc 三聚体是典型的修饰方法[2]。
图 3. 因克西兰的化学结构:N-乙酰半乳糖胺(GalNAc)偶联介导的肝靶向递送。GalNAc 三聚体是典型的修饰方法[2]。ASO 有哪些应用场景?
反义寡核苷酸 (ASO) 通过互补与靶标 RNA 结合,几乎可影响 RNA 从剪接、转录到翻译的各个过程。通常来说,为了增加 ASO 在细胞内的稳定性,会采用例如锁核酸 (LNA) 与硫代磷酸酯 (PS) 修饰等多种类型的化学修饰。
应用一:实现 mRNA 敲减
ASO 与靶标 mRNA 杂交后可以引发 RNA 酶 H 的作用,并且导致靶标 RNA 的水解,ASO 与靶标 RNA 结合后也可以通过空间阻碍的方式抑制 mRNA 的翻译过程。
应用二:调节前体 mRNA 的剪接
根据 pre-mRNA 序列设计的 ASO 能够与目标 pre-mRNA 的外显子及内含子的交界处互补。ASO 与 pre-mRNA 配对形成的双链区域能够遏制该位置被识别,引起与 ASO 互补的外显子在 pre-mRNA 成熟过程中被整段剪切掉。通过这种方式,可以实现对 mRNA 可变剪接功能的研究。
应用三:切除 mRNA5' 端帽子结构
如镧系元素大环复合物已被证明可通过亲核攻击三磷酸键,特异性地化学切除 5' 端 7'-甲基鸟苷残基。利用结合了镧系元素大环复合物的 ASO 可以有效的去除 mRNA5' 端帽子结构。
应用四:调节 mRNA 多聚腺苷酸化位点
真核细胞基因通常被发现有不止一个多聚腺苷酸化位点。采用 ASO 对前体 mRNA 中的一个多聚腺苷酸化位点进行特异性结合,使 E 选择蛋白 (E-selectin) 在加尾时不得不使用上游的多聚腺苷酸化位点,进而达到调节 mRNA 多聚腺苷酸化位点的目的。
Section.04
RNA 干扰技术:临床应用
寡核苷酸药物具有研发周期短、特异性强、高效性和长效性等明显性优势,成为近年来全球资本和药企争相布局的新赛道。国内研究最多的寡核苷酸药物类型是 siRNA,大部分处于临床前阶段,部分临床药物见下表。
表 1. 部分 RNA 临床在研药物。

























|
产品推荐 |
|
Patisiran sodium 是一种双链小干扰 RNA,靶向 Transthyretin (TTR) 信使 RNA 内的序列。 |
|
Inclisiran sodium (HY-132591A) Inclisiran sodium 是一种双链小干扰 RNA (siRNA) 分子,可抑制 PCSK9 的转录。 |
|
MicroRNA Mimic Negative Control (HY-R04602) MicroRNA Mimic Negative Control 是 21 个核苷酸的 miRNA 模拟物,可作为阴性对照使用。 |
|
Fomivirsen (ISIS-2922) 是一种反义 21 mer 磷酸硫寡核苷酸。 |
|
Nusinersen sodium (HY-112980A) Nusinersen sodium 是一种反义寡核苷酸活性分子,修饰 SMN2 基因的前信使 RNA 剪接。 |
|
Mipomersen sodium (ISIS 301012) 是载脂蛋白 B (apoB) 的反义寡核苷酸抑制剂。 |
|
Inotersen (ISIS-420915) sodium 是一种 2'-O-甲氧基乙基修饰的反义寡核苷酸。 |
|
Givosiran (ALN-AS1) 是一种小干扰 RNA,靶向肝脏氨基纤维素合酶 1 (ALAS1) 信使 RNA。 |
|
Bepirovirsen sodium (HY-147217A) Bepirovirsen sodium 是一种反义寡核苷酸,靶向所有 HBV 信使 RNAs。 |
|
Nusinersen是一种反义寡核苷酸活性分子,修饰 SMN2 基因的前信使 RNA 剪接。 |

[1] Weng Y, et al. RNAi therapeutic and its innovative biotechnological evolution. Biotechnol Adv. 2019 Sep-Oct;37(5):801-825.
[2] Ebenezer O, et al. Development of Novel siRNA Therapeutics: A Review with a Focus on Inclisiran for the Treatment of Hypercholesterolemia. Int J Mol Sci. 2023 Feb 16;24(4):4019.



