拉伸应力下调胚胎干细胞来源的拟胚体中成骨标志物的表达和矿化
2025-11-26 来源:本站 点击次数:325Tension Force Stress Downregulates the Expression of Osteogenic Markers and Mineralization in Embryonic Stem-Cell-Derived Embryoid Bodies
Keywords: embryoid body; extracellular signal-regulated kinase; mineralization; osteogenic marker; tensile stress.
拟胚体(EBs)是胚胎干细胞(ESCs)的3D聚集体,能够分化成各种谱系细胞。大量研究结果表明,EBs与细胞外基质(ECM)的协同应用在引导组织再生(GTR)方面具有很大的优势。ECM 成分可以提供调节 ESCs 和/或 EBs 扩增和分化为特定谱系的线索。因此,具有天然骨ECM成分的支架可以直接增强ESCs的成骨分化和骨形成。
支架本身可以激活各种机械信号,并影响与其纤维拓扑结构相关的细胞行为。牵张应变应力是暴露于支架上或支架内生长的细胞的主要机械刺激,并调节细胞增殖和/或分化为功能化细胞的命运。然而,应变应力对EBs成骨分化和矿化的影响及其相关机制知之甚少。
点击了解:牵张应变细胞培养仪
在各种机械传感分子中,丝裂原活化蛋白激酶(MAPKs),如细胞外信号调节激酶(ERK)、c-Jun N末端激酶(JNK)和p38 MAPK在机械信号转导中起着至关重要的作用。激活的 MAPKs 将外源性机械信号转移到细胞核中,并根据机械刺激的条件介导转录激活。Wnt/β-catenin 信号也被机械信号激活,并调节细胞向各种谱系细胞的分化。
基于此,韩国国立全北大学牙科学院口腔生物科学研究所团队在一项研究中探索了拉伸应力如何影响 EBs 的成骨潜力,并研究 β-连环蛋白或 MAPK 中的哪一个在施加应力的 EBs 中充当主要机械信号介质。研究表明,拉伸负荷应力通过下调ERK1/RUNX2调控的信号来抑制EBs的成骨分化和矿化。其成果发表于 CELLS 期刊题为“Tension Force Stress Downregulates the Expression of Osteogenic Markers and Mineralization in Embryonic Stem-Cell-Derived Embryoid Bodies”。

图1展示了使用悬滴法从ESCs培养EBs以及使用体外牵张设备应用循环拉伸应力的实验设计。首先,在孵育的几个时间点测定了EBs中多能性相关标记物的水平。EBs中未分化状态标记物 Oct4和Sox2在第1天EBs中强烈表达,且在第3天EBs中发现了这种表达。第7 天 EBs 也显示出与 第1 天相似的 Sox2 表达水平,但 Oct4 的表达水平显著降低。同时,还检测了 EBs 在补充或不补充 DAG(二酰基甘油)的培养物中表达成骨转录因子 RUNX2 和 Osterix 的特性,免疫荧光染色显示,第3天的EBs表达RUNX2和Osterix,DAG处理后表达明显增加。
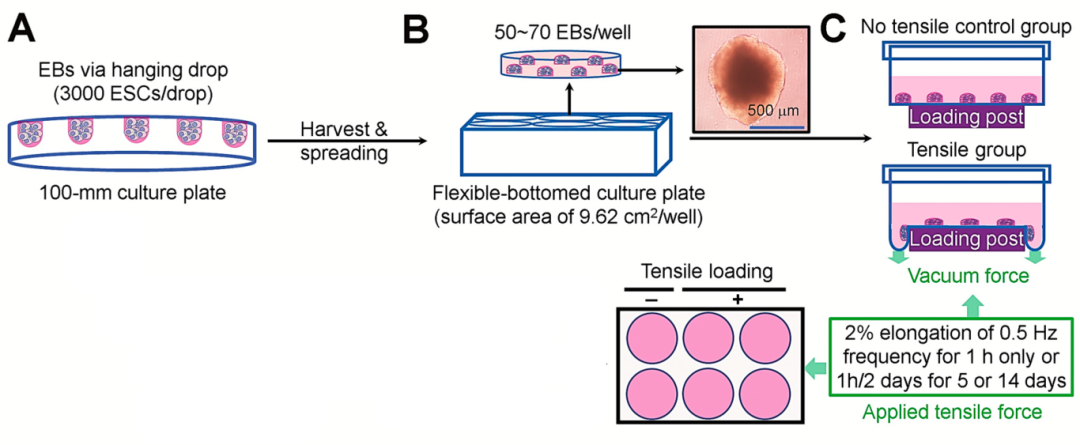
图1 ESC衍生EBs的拉伸应力应用实验设计。
随后,通过ARS染色研究了拉伸应力如何影响DAG诱导的EBs矿化。与生长培养基中的EB培养物相比,添加DAG的EBs显示出更多的ARS阳性菌落,但在应用于2% 幅度拉伸应力的EBs中这种增加有所下降(图2 A)。ARS特异性光密度(405 nm)的测量支持了DAG诱导的EBs矿化及其因拉伸应力而显著降低的趋势(图2 B)。与仅补充DAG的培养物相比,施加拉伸应力的培养物中直径超过300 μm的EBs数量显著减少(图2 C)。此外,补充 DAG的EBs表达的RUNX2、Osterix、BSP和OCN水平显著提高,但ALP和OPN水平不高(图2 D)。DAG 刺激的这些成骨基因在 EBs中的表达在拉伸应力的协同作用下被显著减弱。同样,免疫印迹测定显示DAG刺激RUNX2的诱导,并通过拉伸应力抑制(图2 E、F)。这些数据表明,循环拉伸应力减少DAG诱导的EBs矿化,这是由成骨调控分子的下调所控制的。
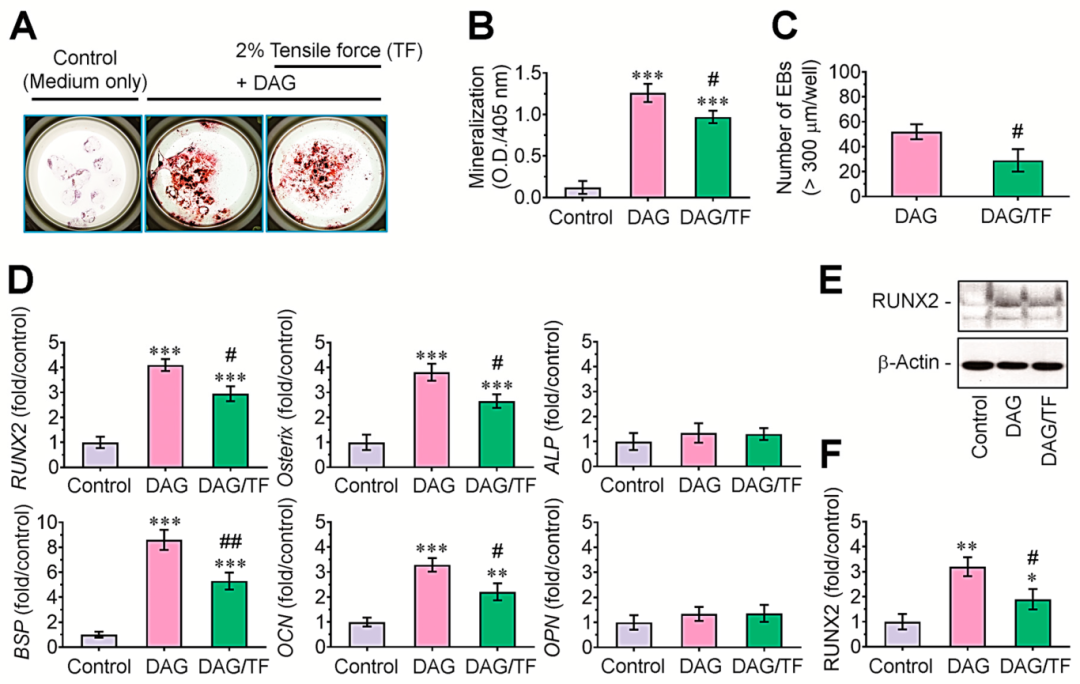
图2 循环拉伸应力抑制DAG刺激的EBs的成骨细胞分化和成骨标志物表达。
接下来,为了了解为什么拉伸应力会抑制 DAG 刺激的 EBs 矿化,首先检查了 EBs 中整合素和 β-连环蛋白的蛋白质水平。与生长培养基提供的对照EBs相比,DAG处理的EBs在全蛋白裂解物中显示出整合素α5和β1以及β-连环蛋白的明显增加,并且在拉伸加载后的指定时间(0-48小时)没有因拉伸应力而改变(图3 A),整合素和β-连环蛋白特异性的条带强度也显著提高,且同样在拉伸应力后没有减少(图3 B-D)。此外,仅补充DAG或与拉伸应力联合应用的EBs组在细胞质和核酸部分均显示出显著高于对照组的β-连环蛋白水平(图3 E-G)。
然后,为了探讨β-连环蛋白介导的信号对DAG刺激的EBs成骨分化的作用,用si-对照或si-β-连环蛋白转染。免疫印迹测定表明,si-β-连环蛋白转染显著降低了全蛋白裂解物中的β-连环蛋白水平。在培养14天后,与补充DAG或联合si-对照转染的EBs相比,si-β-连环蛋白转染的EBs中的ARS强度略有降低的趋势。然而,在si-β-连环蛋白转染的EBs中,ARS染料的平均吸光度和ARS阳性菌落的数量与仅用DAG处理或与si-对照转染一起处理时没有显著差异。这些数据表明,DAG刺激的EBs矿化及其受拉伸应力的抑制不受β-连环蛋白介导的信号的直接影响。

图3 拉伸应力不会减弱 DAG 刺激的 EBs 中整合素和 β-连环蛋白的诱导。
为了评估ERK介导的信号对张力施加的EBs的影响,通过免疫印迹测定比较了对照组、DAG组和DAG/拉伸施加EB组之间的p-ERK水平(图4 A)。与对照组或 DAG 组相比,拉伸应力施加的 EBs 中发现 p-ERK 迅速且持续性增加,然而,在拉伸应力12 小时后,DAG刺激的ERK磷酸化被广泛抑制。密度分析支持,DAG 处理的 EBs 中张力介导的 p-ERK 降低在 p-ERK1 而不是 p-ERK2 中进一步突出(图4 B)。这些结果表明,DAG刺激的EBs中ERK1介导的信号与张力介导的成骨抑制作用密切相关。

图4 拉伸应力以时间依赖性方式抑制了ERK的磷酸化。
进一步地,用每种(10 μM)MAPK 抑制剂研究了 MAPKs 对 DAG 刺激的 EBs 矿化的影响。ARS染色结果表明,DAG诱导的EBs矿化被p-ERK的药理抑制剂所抑制,非p-JNK或p-p38激酶的抑制剂。在MAPK处理的EB组中,与DAG对照EBs相比,仅在暴露于PD98059的EBs中发现ARS染料特异性吸光度显著降低。用PD98059预处理也显著抑制了EBs中DAG刺激的RUNX2,Osterix,BSP和OCN的表达。此外,在与药理学ERK抑制剂联合治疗中,DAG介导的第5天EBs中RUNX2和Osterix蛋白的诱导显著降低。这些数据表明,药理学ERK抑制剂通过下调成骨标记基因表达来减弱DAG介导的EBs矿化。
最后,为了阐明ERK介导的信号在DAG刺激的EBs矿化中的作用,用si-ERK1、si-ERK2或两者转染。DAG诱导的EBs矿化通过si-ERK1而不是si-ERK2的转染而减弱(图5 A)。ARS染料特异性光密度的测量证实了ERK1介导的信号与DAG刺激的EBs矿化之间的关联,因此与DAG对照组相比,si-ERK1转染的EBs矿化显著较低(图5 B)。拉伸应力介导的DAG刺激的EBs矿化减少与其直径大小密切相关,其中si-ERK1或si-ERK1/2转染的EBs的平均菌落直径显著小于DAG对照组(图5 C)。用si-ERK1或si-ERK1/2转染,而不用si-对照或si-ERK2转染,显著抑制了DAG处理的EBs中RUNX2和OCN的水平(图5 D、E)。此外,ERK1 而不是 ERK2 介导的信号通过调节 RUNX2 的表达介导 DAG 刺激的 EBs 的矿化(图5 F、G)。这些数据表明,ERK1介导的信号在DAG刺激的EBs中充当RUNX2的上游效应因子。

图5 用 si-ERK1 转染减少了 DAG 刺激的 EBs 矿化。(H)图形概要
总之,该研究考察了循环拉伸应力对 DAG 刺激的 EBs 成骨能力的影响及其相关机制(图5 H)。研究表明,拉伸应力抑制了 DAG 刺激的 EBs 成骨分化和矿化;还表明ERK1 介导的信号,而非 Wnt/β-catenin 信号,与张力介导的成骨抑制密切相关;p-ERK1 在 DAG 刺激的 EBs 中作为 RUNX2 的上游效应子。
参考文献:An JH, Kim CC, Lee J, Kim J, Lee JC, Kook SH. Tension Force Stress Downregulates the Expression of Osteogenic Markers and Mineralization in Embryonic Stem-Cell-Derived Embryoid Bodies. Cells. 2025 Jun 28;14(13):991. doi: 10.3390/cells14130991. PMID: 40643512; PMCID: PMC12248426.
原文链接:https://pubmed.ncbi.nlm.nih.gov/40643512/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:牵张应变细胞培养仪

