机械应力诱导心脏成纤维细胞早衰
2025-11-26 来源:本站 点击次数:415Mechanical Stress Triggers Premature Senescence in Cardiac Fibroblasts
Keywords: cellular senescence; mechanical stress; mechanosensitivity; nuclear integrity.
细胞衰老是一种细胞周期停滞状态,在发育和损伤后的组织形成和重塑中发挥作用。定义衰老的最广泛认可的标志物是通过细胞周期停滞信号,特别是小鼠的 p16/p19(或人类的 p16/p14)和 p53/p21。新出现的证据表明,机械刺激和微环境的改变可能是启动早衰样状态的另一个因素。随着在创伤和疾病中观察到的长期暴露于物理应力或拉伸应变,细胞和细胞核会发生直接变化,从而影响一系列生物标志物。然而,如果细胞应力继续超出正常生理范围,则可能出现应激诱导的过早衰老表型。这种表型与癌症、骨关节炎和心血管疾病等病理状态有关。值得注意的是,这些疾病状态通常会导致组织中生化和机械环境的变化,表明衰老可能是由多种因素共同引起的。
心脏成纤维细胞(CFs)是心脏组织中对环境信号参与适应性反应的主要细胞类型之一。研究表明, CF 的表型可塑性通过机械敏感反应,在生物化学上由钙信号介导,在生物物理上由α-SMA增加介导。此外,已知拉伸幅度和基质刚度的改变会将 CFs 激活为肌成纤维细胞表型。衰老的心肌细胞由于细胞收缩力下降而导致收缩频率增加,从而表现出收缩功能障碍。CFs 嵌套在心肌细胞之间,被动地经历这种收缩功能障碍,表明心肌细胞和 CFs 之间存在连续串扰。
点击了解:牵张应变细胞培养仪
基于此,美国科罗拉多大学博尔德分校机械工程系及生物医学工程项目团队使用体外模型模拟心脏病中的机械破坏,旨在通过检测细胞衰老标志物以确定扰动机械刺激是否可以在小鼠原代 CFs 中触发应激诱导的早衰表型。由于核膜结构完整性的改变和氧化应激的增加与几种类型的心血管疾病有关,还进一步研究了氧化应激和核纤层蛋白A/C 突变对 CFs 的衰老反应。研究分析表明,早衰表型可以由机械环境中的扰动单独启动,与化学诱导相比是独特的。研究成果发表于Advanced Science 期刊题为“Mechanical Stress Triggers Premature Senescence in Cardiac Fibroblasts”。

首先,为了检查扰动机械刺激对心脏成纤维细胞(CFs)的作用,对小鼠原代野生型(WT)CFs进行两种循环拉伸模式持续4天(图1 A)。第一种模式称为对照拉伸(1 Hz,8.5%),第二种模式称为损伤拉伸,它模仿了心脏病中观察到的机械负荷变化,在1 Hz,8.5% 应变持续24 小时,然后幅度降低到2.5% 应变,频率增加到2 Hz(图1 B)。4天(96小时)后,使用标记细胞周期 G1、G2 和 S 期细胞的 Ki-67,与对照拉伸 CFs 相比,损伤拉伸组 CFs 显示 Ki-67 归一化强度值显著降低(图1 C),这与增殖能力降低和细胞周期停滞一致,是衰老的标志。
同时,评估了损伤拉伸组 CFs 的其他衰老特征,如核纤层蛋白B 的表达、核形态的改变、DNA 损伤和细胞周期停滞标志物的基因表达。在体内和体外衰老细胞中观察到核纤层蛋白 B 减少。此外,损伤拉伸组 CFs的核面积显著增加,但没有观察到核长宽比的变化。γH2A.X 焦点的 DNA 损伤,是在应激引起的早衰中常见的双链断裂(DSB)的标志物。通过γH2A.X的存在测量DNA损伤,发现与对照组相比,损伤拉伸CFs中每个细胞核的γH2A.X焦点显著增加,这提供了一种触发衰老状态启动的信号机制。已知 p53-p21-RB 轴参与 DNA 损伤反应信号和细胞周期停滞。RT-qPCR 结果显示,损伤拉伸组 CFs 的 p53 和 p21 表达增加,但令人惊讶的是 p16 的表达降低。这些数据表明,通过细胞周期、核形态和 DNA 损伤的标记进行评估时,小鼠原代 CFs的机械扰动会诱导衰老样表型。

图1 机械负荷的改变会破坏原代心脏成纤维细胞的细胞周期和增殖。
考虑到定义衰老表型需要多种标志物的组合,而且有几种标志物不是衰老du有的,研究人员试图通过氧化应激、活性氧(ROS)诱导的衰老来额外诱导衰老表型。使用过氧化氢处理原代 WT CFs 超过 21 天,以化学诱导衰老。结果发现。与组织培养板(TCP)对照相比,ROS诱导的CFs的Ki-67染色显著减少,表明增殖减少。同时,ROS诱导的CFs 核纤层蛋白B 环厚度减少(图2 A),强度普遍降低,核面积显著增加(图2 B)。通过γH2A.X焦点计数检查了ROS诱导的衰老CFs是否增加DNA损伤,发现TCP和ROS诱导的CFs之间没有差异(图3 C)。p53 和 p21 的基因表达分析支持了 γH2A.X 焦点没有显著差异,与 TCP 对照相比,这两个基因都有所减少(图2 D)。与机械诱导的衰老CFs相似,p38基因表达没有差异。然而,ROS 诱导的 CFs 显示出 p16 表达的增加。
上述研究表明,机械诱导的衰老样CFs表现出与ROS诱导的CFs相似的衰老特征,即增殖下降(即Ki-67),核纤层蛋白B减少,核面积增加。然而,两种诱导模式可能有其独特的途径,且取决于机械刺激与生化刺激。虽然两种处理都显示出细胞周期停滞标志物的表达增加,但 ROS 诱导的 CFs 表现出显著的 p16 上调,而机械诱导的 CFs 表现出 p53 和 p21 表达的增加。

图2 氧化应激下的心脏成纤维细胞表现出化学诱导衰老表型标志物,包括形态、DNA 损伤和基因表达的改变。
由于在衰老细胞中发现的许多改变和标记与细胞核和核膜的变化重叠,实验假设核膜中的机械敏感蛋白可能会放大衰老样表型的启动。因此,从4-9周龄的核纤层蛋白A/C缺失小鼠中建立了CFs的原代培养物,暴露于对照拉伸和损伤拉伸的加载条件下。结果观察到,与对照拉伸 CF 相比,损伤拉伸 CF 中的 Ki-67 分布显著降低(图3 A),核面积或纵横比没有变化(图3 B),核纤层蛋白B 环厚度增加(图3 C),这可能是在核纤层蛋白 A/C 缺失情况下的一种代偿机制。检查 CFs 中的 DNA 损伤反应,观察到 γH2A.X 焦点增加(图3 D),但基因表达分析未显示 p53 或 p21 的显著差异。虽然没有观察到核纤层蛋白 B 环厚度的减少,这将证实衰老样表型,但实验注意到机械刺激(对照和损伤拉伸)下核纤层蛋白 A/C 缺失的 CFs 中核破裂和核纤层蛋白B 稀释区域的增加,这表明沿核膜的核纤层蛋白 A/C 的缺失降低了结构完整性。这表明,形态学读数、基因表达和 DNA 损伤的总体变化并不表明过早衰老状态的进展是由于核纤层蛋白 A/C 的丢失而改变的核结构完整性而放大的。
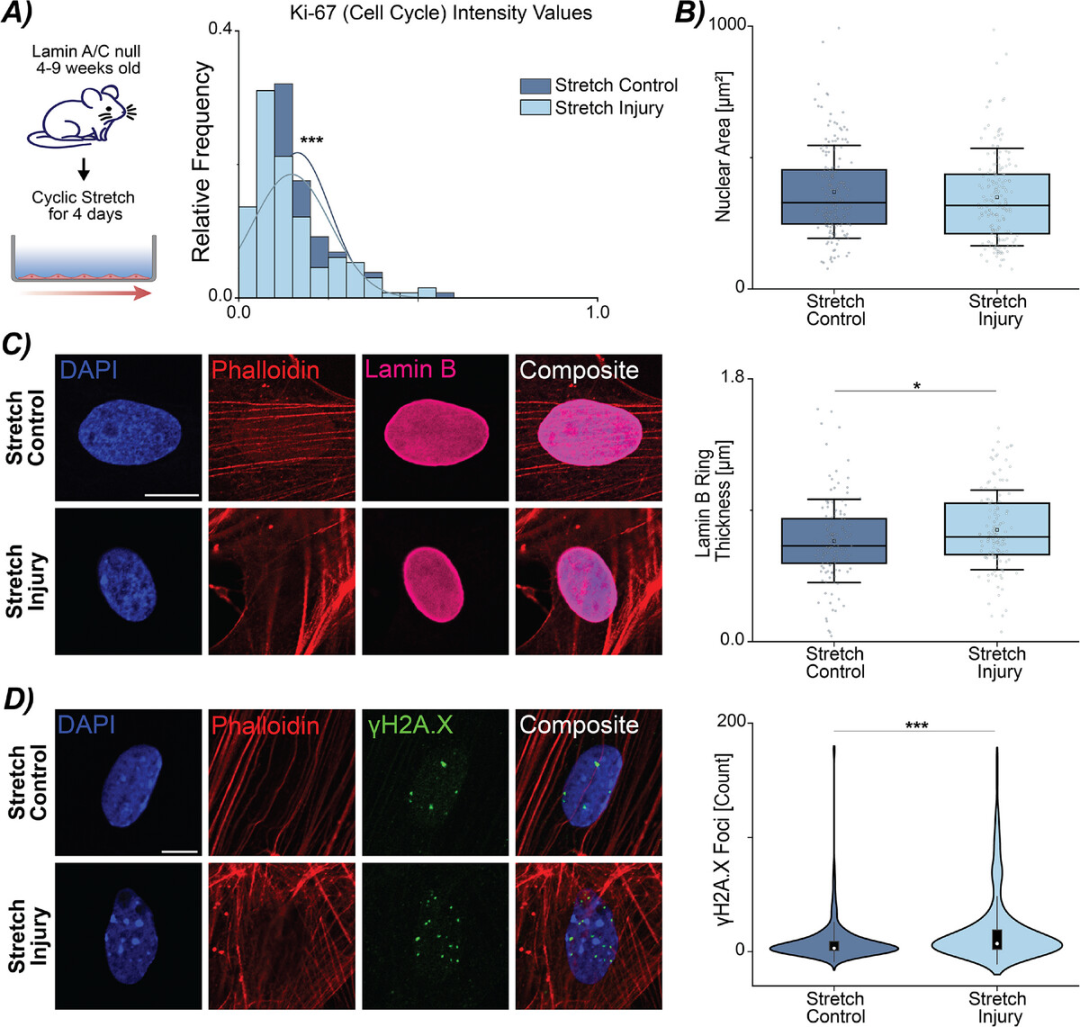
图3 通过核纤层蛋白 A/C 丢失破坏核完整性不会放大心脏成纤维细胞中机械诱导的早衰表型。
由于上述过程没有观察到核纤层蛋白A/C 缺失的 CFs 的放大表型,最后,实验观察了核膜中其他机械敏感的蛋白质。Emerin 是一种核膜蛋白,与核纤层蛋白A/C 紧密相互作用,调节核的力学性质和信号传导。研究发现,应变增加会导致 Emerin 定位到外核膜。使用相同的拉伸方案来启动机械诱导的衰老表型(图1 B),发现与对照拉伸CFs 相比,损伤拉伸CFs 的 Emerin环厚度显著降低(图 4 A)。
这一发现是否适用于所有的衰老CFs,量化 ROS 诱导和 TCP 诱导的CFs 中的Emerin环厚度,并没有发现化学诱导的衰老 CFs 的改变(图 4 B)。在所有核纤层蛋白 A/C 缺失细胞中,无论是机械刺激还是化学刺激,都测量到Emerin环厚度的减少,但两者未发现显著差异。这并不奇怪,因为核纤层蛋白 A/C 缺失 CFs 中的Emerin定位已被证明主要定位在细胞质上。此外,随着Emerin环厚度的减小,还定性地观察到紧邻核膜周围的不规则肌动蛋白结构模式。这些结果表明,机械敏感蛋白 Emerin 会随着损伤性拉伸而减少,Emerin定位是机械诱导衰老的一个显著特征,突出了它作为核结构完整性的机械敏感调节剂的作用及其与衰老表型诱导的相互作用。
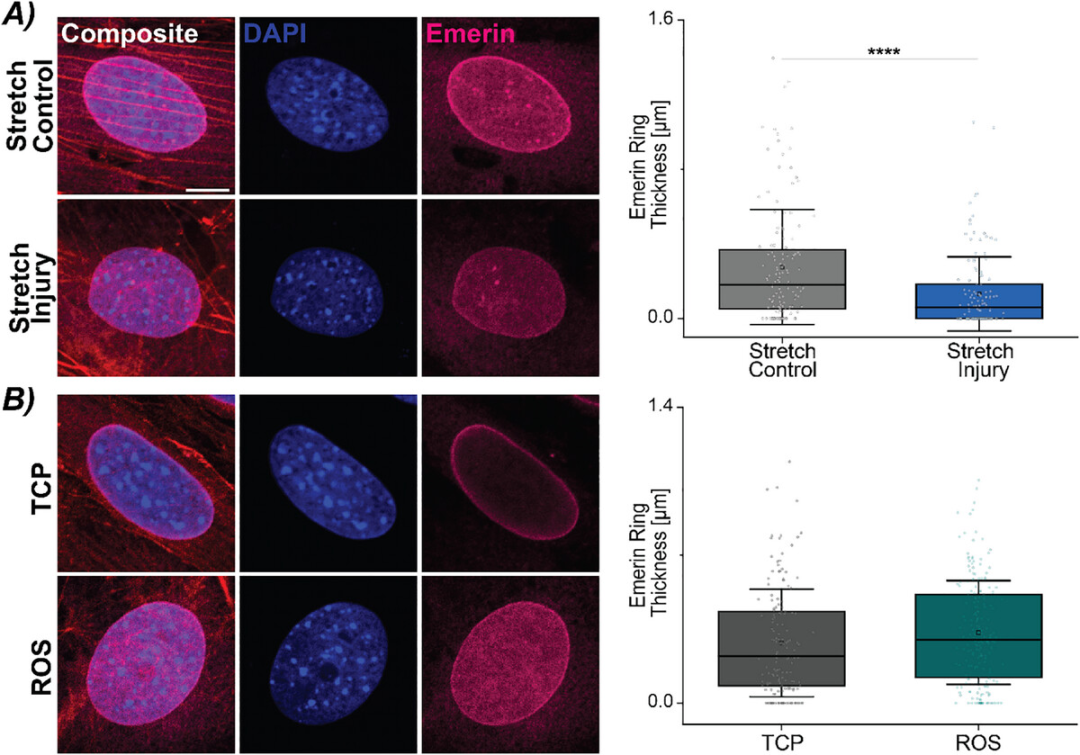
图4 机械敏感核膜蛋白 Emerin 可能是心脏成纤维细胞中启动机械诱导衰老表型的关键介质。
总之,这项研究检查了在心脏病的简化体外模型中,扰动的机械刺激如何触发细胞衰老的启动。利用先前建立的细胞衰老标志物,研究发现扰动力刺激可以改变增殖、核纤层蛋白 B 表达、诱导 DNA 损伤反应以及 p21 和 p53 表达的增加,从而定义 CFs 中机械诱导的衰老特征。此外,还发现 Emerin (一种核膜中的机械敏感蛋白质)可能在起始阶段参与其中。该研究证明了机械刺激的生理变化,更具体地说,应变幅度的降低和频率的增加如何引发细胞衰老,从而推进了更精确定义细胞衰老的尝试。
参考文献:Schneider SE, Scott AK, Gallagher KM, Miller EY, Ghosh S, Neu CP. Mechanical Stress Triggers Premature Senescence in Cardiac Fibroblasts. Adv Sci (Weinh). 2025 Sep 26:e13314. doi: 10.1002/advs.202513314. Epub ahead of print. PMID: 40999893.
原文链接:https://pubmed.ncbi.nlm.nih.gov/40999893/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:牵张应变细胞培养仪

