抑制内皮细胞 Scarb1 可减轻压力超负荷诱导的心力衰竭进展
2025-12-05 来源:本站 点击次数:356Inhibition of Scarb1 on Endothelial Cells Attenuates Pressure Overload-Induced Heart Failure Progression
Keywords: SCARB1; endothelial cells; fibroblasts; heart failure.
心力衰竭显著缩短了全球健康预期寿命。尽管心脏中有多种细胞类型,但以往的研究主要关注心肌细胞(CMs),因为它们在心脏泵血功能中发挥关键作用。非心肌细胞(NCMs)的数量占心脏细胞的近70%,显著影响心力衰竭的进展。在NCMs 中,内皮细胞(EC)群体最多。ECs在维持心脏稳态中起重要作用,其功能障碍会促进心力衰竭的进展。
此外,在心力衰竭进展中,细胞的病理变化发生在细胞水平上,并通过包括 ECs 在内的多个细胞之间的相互作用而发生。尽管之前的许多研究已经证明了通过 CMs 进行细胞间相互作用的重要性,但成纤维细胞(FB)-EC 的相互作用在心脏中也起着重要作用。然而,FB-EC 相互作用导致心力衰竭进展的详细机制仍然知之甚少。
点击了解:仿生多细胞动态共培养系统
鉴于此,日本庆应义塾大学医学院心内科、综合运动医学研究所及东京大学计算生物与医学科学系团队在一项研究中,通过心力衰竭进展对NCMs 进行了单细胞RNA测序(scRNA-seq)分析,以阐明细胞的病理变化,主要关注ECs和FBs及其病理细胞间相互作用,并基于细胞间相互作用分析,重点关注了 ECs中表达的Scarb1,提出Scarb1可以作为心力衰竭的新型治疗靶点。研究成果发表于 JACC: Basic to Translational Science 期刊题为“Inhibition of Scarb1 on Endothelial Cells Attenuates Pressure Overload-Induced Heart Failure Progression”。

首先,为了研究心力衰竭发展过程中NCMs的病理变化,创建小鼠主动脉弓缩窄(TAC)模型,从小鼠正常期(TAC 0周),适应性肥厚期(TAC 2周)和心力衰竭期(TAC 12周)的心脏中提取NCMs,并进行scRNA-seq分析。数据表明,TAC 诱导的压力超负荷成功诱发了心力衰竭。
ECs的数量随着心力衰竭的进展而增加,特别是在肥厚期,表明ECs对体内平衡的破坏在心力衰竭进展中起关键作用。将ECs重新聚类并将它们分类为11个亚群(图1 A、B)。通过分析心力衰竭进展期间数量增加的簇,发现簇6 在适应性肥厚期间增加,而簇5 在心力衰竭阶段增加。根据基因表达,簇6 被认为是一种毛细血管 EC(图1 B),其中 Col1a1、Col3a1 和 Il1b 的表达增加(图 1 C)。簇5 在心力衰竭阶段数量增加,表现出动脉 EC 特征。在心力衰竭阶段,应力纤维相关基因,如Acta2和Tagln,在动脉EC中上调(图1 D)。Fgfr1 在器官纤维化中起重要作用,在其中也上调(图1 D)。
同时,分析FB群体的病理变化。FBs被重新聚类为7个子簇(图1 E)。伪时间序列分析显示,随着心力衰竭的进展,FBs细胞分化轨迹分化为簇5、1方向和簇2、4方向(图1 F)。关于细胞数量,簇1 在适应性肥厚期间增加,而簇4 在心力衰竭期间增加。FBs 中包括 Postn 在内的细胞外基质的产生随着心力衰竭的进展而增加,是心力衰竭中 FB 病理性变化的关键特征。分析表明,簇1 和 4 是 Postn 阳性(图1 G),表明这些亚群是病理性 FBs。此外,簇4 中的 FBs 表达应力纤维,例如 Acta2(图1 H),这是肌成纤维细胞中的一个独特基因。
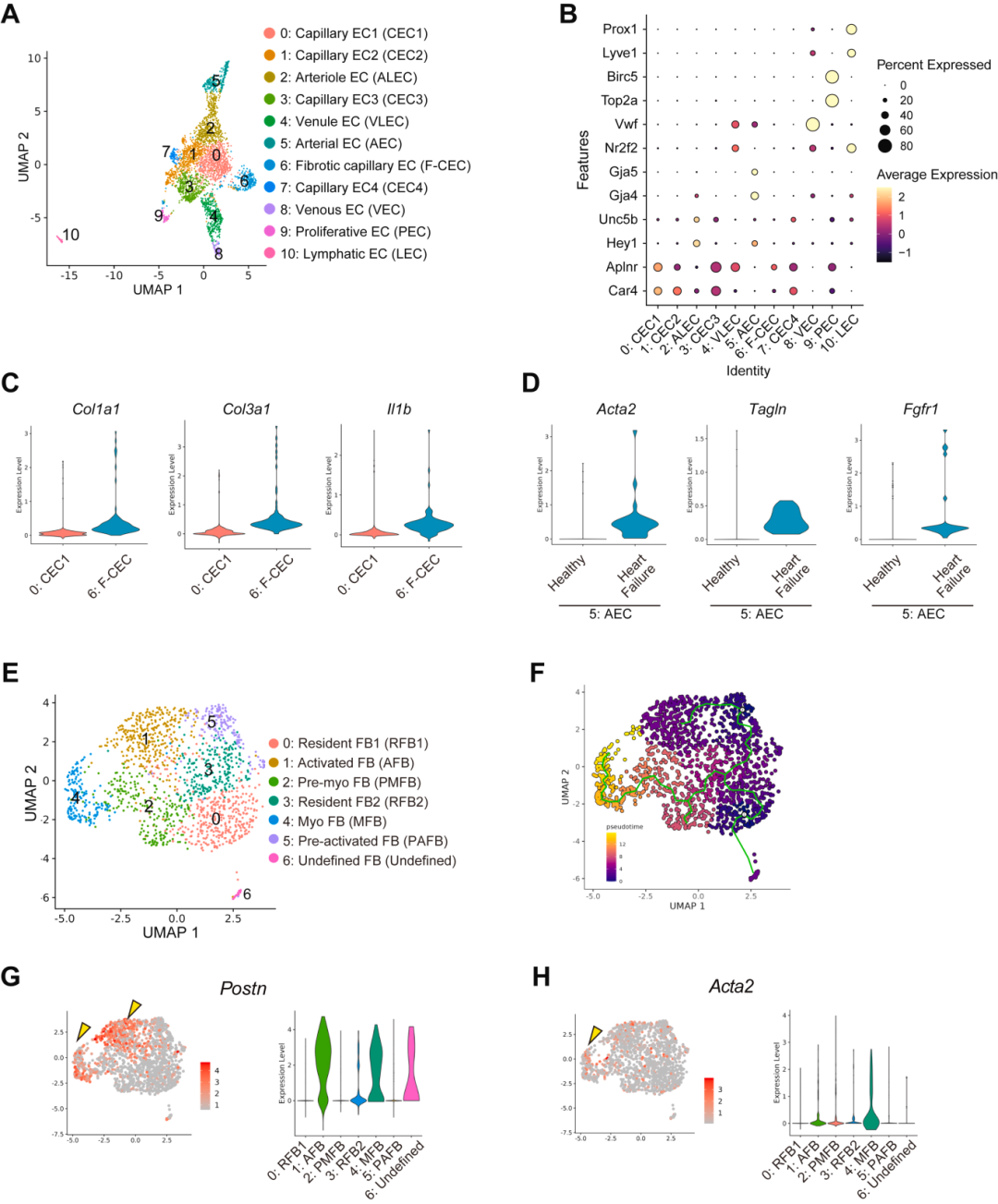
图1 scRNA-seq 揭示了心力衰竭发展过程中 ECs 和 FBs 中不同的亚群和基因表达谱。
接下来,使用配体-受体对进行细胞间相互作用分析,发现作为受体的ECs和作为配体的FBs之间的相互作用(FB-EC相互作用)最为突出,FB-EC相互作用的总数随着心力衰竭的进展而增加。在ECs的受体中,经常检测到与清道夫受体(Scarb)家族相关的基因,包括 B 类清道夫受体1(Scarb1)和Scarb3。当计算Scarb家族中的相互作用总数时,发现FBs是配体的主要来源,与相互作用总数相似。通过SCARB1受体的相互作用是前 2 名相互作用,说明通过 SCARB1 的 FB-EC 相互作用可能对心力衰竭发展的病理变化产生影响。此外,还通过免疫荧光证实了Scarb1在心脏毛细血管ECs中的局灶性表达。
对小鼠心力衰竭模型的scRNA-seq分析得出了SCARB1受体介导的FB-EC相互作用可能是心力衰竭进展的关键因素的假设。为了检验Scarb1在小鼠心力衰竭模型中是否真的是一个关键病理基因,构建了EC特异性Scarb1敲除小鼠(Scarb1 CKO)(图2 A)。在Scarb1 CKO和对照小鼠中给予他莫昔芬后进行TAC诱导心力衰竭(图2 B)。超声心动图显示,与对照TAC小鼠相比,Scarb1 KO显著改善了左心室射血分数(LVEF)功能障碍(图2 C、D),将LVEF恢复到TAC前水平,表明ECs中的Scarb1在TAC诱导的心力衰竭的进展中起关键作用。
此外,为了研究 Scarb1 CKO 是否减少心脏纤维化,对心脏组织进行了 azan 染色。结果显示,Scarb1 CKO显著抑制了血管周围纤维化和间质纤维化(图2 E、F)。qPCR显示,Scarb1 CKO显著降低了纤维化标志物Col1a1和Postn以及炎症分子Il1b和Il6 表达(图2 G、H)。TAC 诱导心力衰竭后血管密度降低,Scarb1 CKO 可进行缓解(图2 I 、J)。这些数据表明,EC 选择性敲除 Scarb1 可减轻心力衰竭进展。
进一步地,对TAC诱导的心力衰竭小鼠施用SCARB1特异性抑制剂BLT-1,观察到在BLT-1给药后挽救了TAC引起的心功能损害,血管周围纤维化和间质纤维化也受到抑制,TAC增加的纤维化标志物Col1a1、Postn、Tgfb和Timp1也显著降低,炎症分子,如Il1b和Il6也下调。心脏重量-体重比增加,表明BLT-1可以阻止向失代偿性心力衰竭的转变。通过研究高密度脂蛋白(HDL)在观察到的现象中的参与(SCARB1 是一种特定的 HDL 摄取受体),表明HDL摄取不受研究中使用的BLT-1剂量的影响,无论 BLT-1 给药如何,心脏中都没有发生 HDL 摄取。因此,BLT-1的心脏保护作用可能是通过SCARB1的直接信号传导介导的,而不是HDL介导的作用。
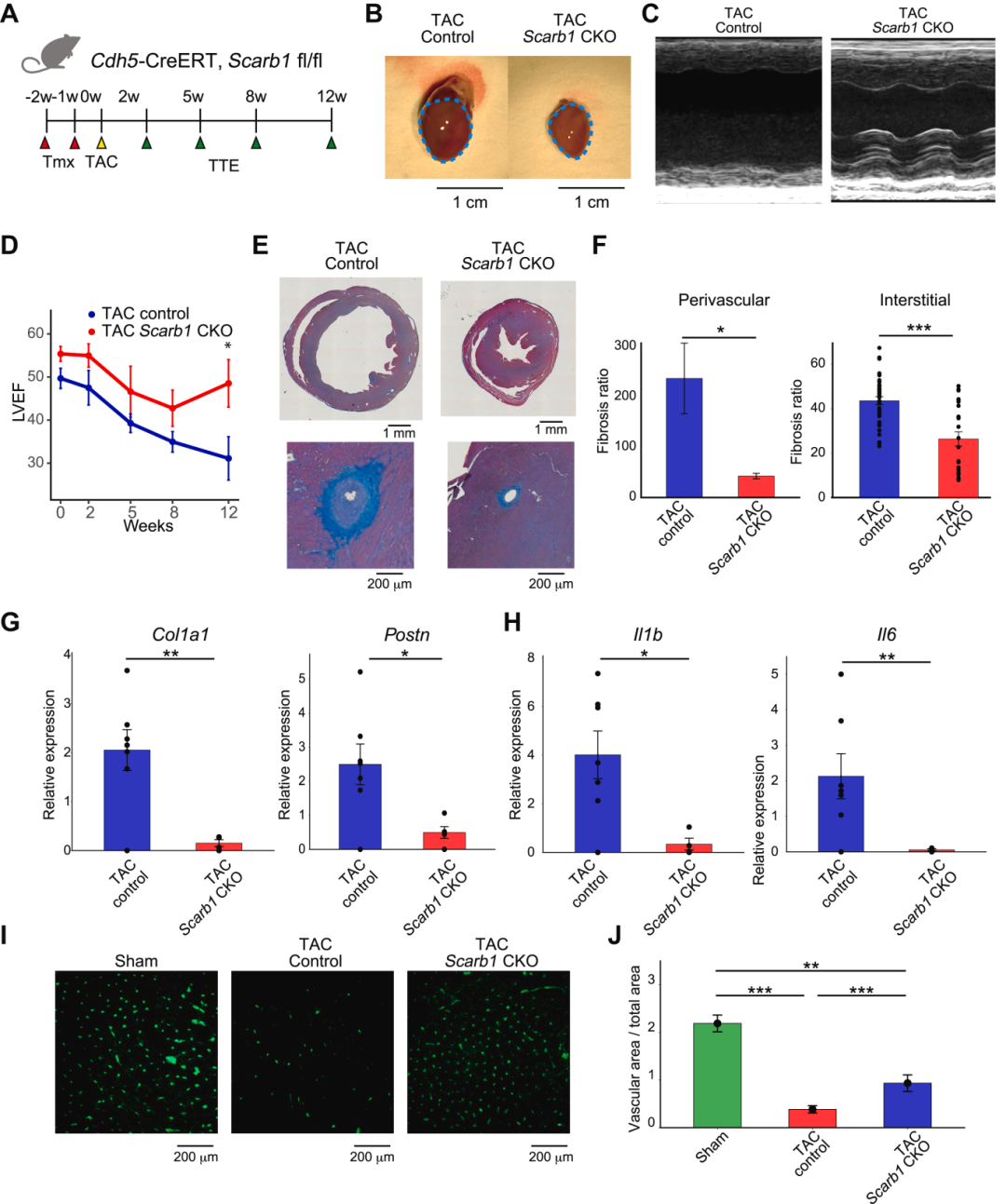
图2 EC 特异性 Scarb1 KO 改善压力超负荷心脏的心力衰竭状况。
重要的是,为了确认SCARB1介导的FB-EC相互作用导致ECs的病理变化,进行了FBs和ECs的混合共培养(图3 A、B)。结果显示,人微血管内皮细胞(HMVECs)和大鼠成纤维细胞的混合共培养导致HMVECs中病理性纤维化标志物(如ACTA2和S100A4)的表达增加,用BLT-1处理降低了其表达(图3 C)。相比之下,在分离的共培养系统中,没有观察到这些基因表达变化,表明FB-EC直接串扰可能对ECs的病理变化至关重要。
进行 RNA-seq 分析 BLT-1 处理的 HMVECs 的表达变化,主成分分析和聚类显示,对照组和BLT-1组存在不同的基因表达簇(图3 D、E)。KEGG通路分析表明,与炎症通路相关的基因(包括肿瘤坏死因子α信号)富集(图3 F)。基因集富集分析显示,BLT-1给药后与上皮-间充质转化相关的基因显著减少(图3 G)。同时,纤维化标志物(ACTA2、TAGLN和COL1A1),促炎分子(IL1B和VCAM1)和趋化因子(CCL2、CXCL1和CXCL12)的表达也降低,与 BMP 信号传导相关的基因(ID1、ID2 和 ID3)(图3 H)也减少了。
实验假设血小板反应蛋白1(THBS1)是 SCARB1 的潜在配体,qPCR分析显示,THBS1 处理增加了 IL1B 和 COL1A1 的表达,而 BLT-1 给药抵消了这种效应。在使用 TAC 诱导的心力衰竭小鼠模型的 scRNA-seq 实验中,这些基因被鉴定为病理 ECs 的重要因素(图1 C)。这些发现强化了体内分析的结果,即心力衰竭进展过程中的病理变化是由 FB-EC 通过 SCARB1 相互作用引起的。
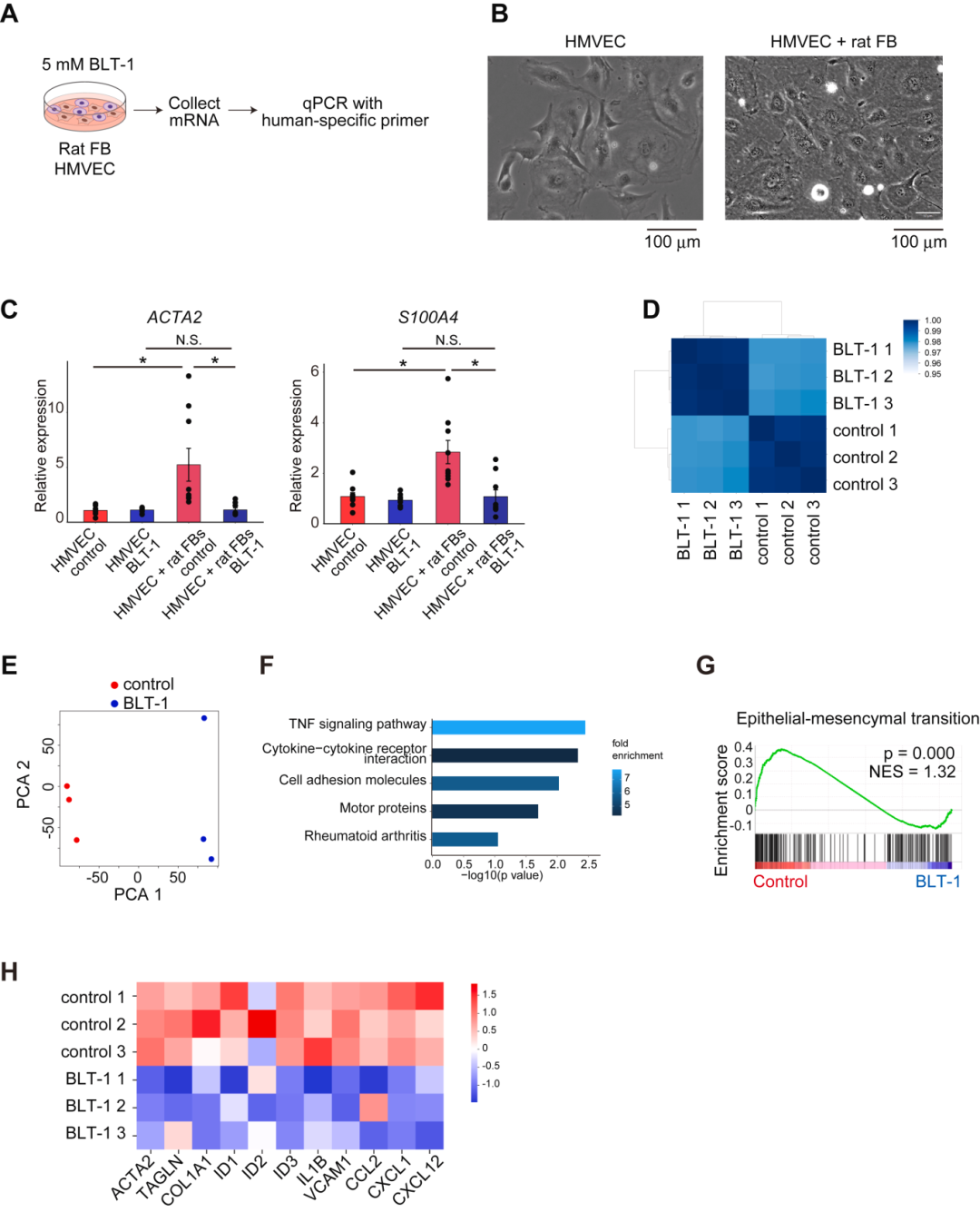
图3 RNA-seq 和共培养实验阐明了 ECs 中抑制 SCARB-1 的假定心脏保护机制。
上述结果提示通过 SCARB1 受体的 FB-EC 相互作用在心力衰竭进展中的重要性。然而,细胞间相互作用在实际心脏中的定位和变性内皮细胞中的下游机制尚未得到充分研究。最后,为了阐明心脏细胞(包括EC和FB)的空间排列,对假手术和TAC 12周的心脏上约300个基因进行了Xenium原位空间转录组学分析。结果显示,FBs和ECs在假手术和TAC心脏中的空间上非常接近。TAC心脏显示出Nppa和Postn等病理标志物的较高表达,主要位于内部区域(心内膜侧)。该区域含有更高密度的病理性 ECs,其特征是炎症和纤维化基因表达,通常靠近表达 Myc、Nppa 和 Nppb 的 CMs。尽管这些相互作用的确切方向仍不清楚,但这些发现表明,病理改变的 ECs 可能会影响相邻的 CMs,从而加剧心力衰竭。
在 TAC 模型中,假设心肌内区域受到缺氧条件的影响,这可能有助于这种细胞分布。此外,表现出明显纤维化的区域显示EC密度的显著降低。类似地,在TAC小鼠的心脏中,与对照小鼠相比,血管密度降低,并且观察到Scarb1 CKO的改善。这些结果表明,微血管稀疏化可能会加重纤维化重塑,反之亦然。总体而言,研究结果支持 FB 衍生的配体激活相邻的 ECs,导致炎症和纤维化基因表达以及内皮功能障碍。特别是在缺氧的内部区域,这些病理变化在 ECs 和 CMs 中都会加剧,从而可能加剧心力衰竭。
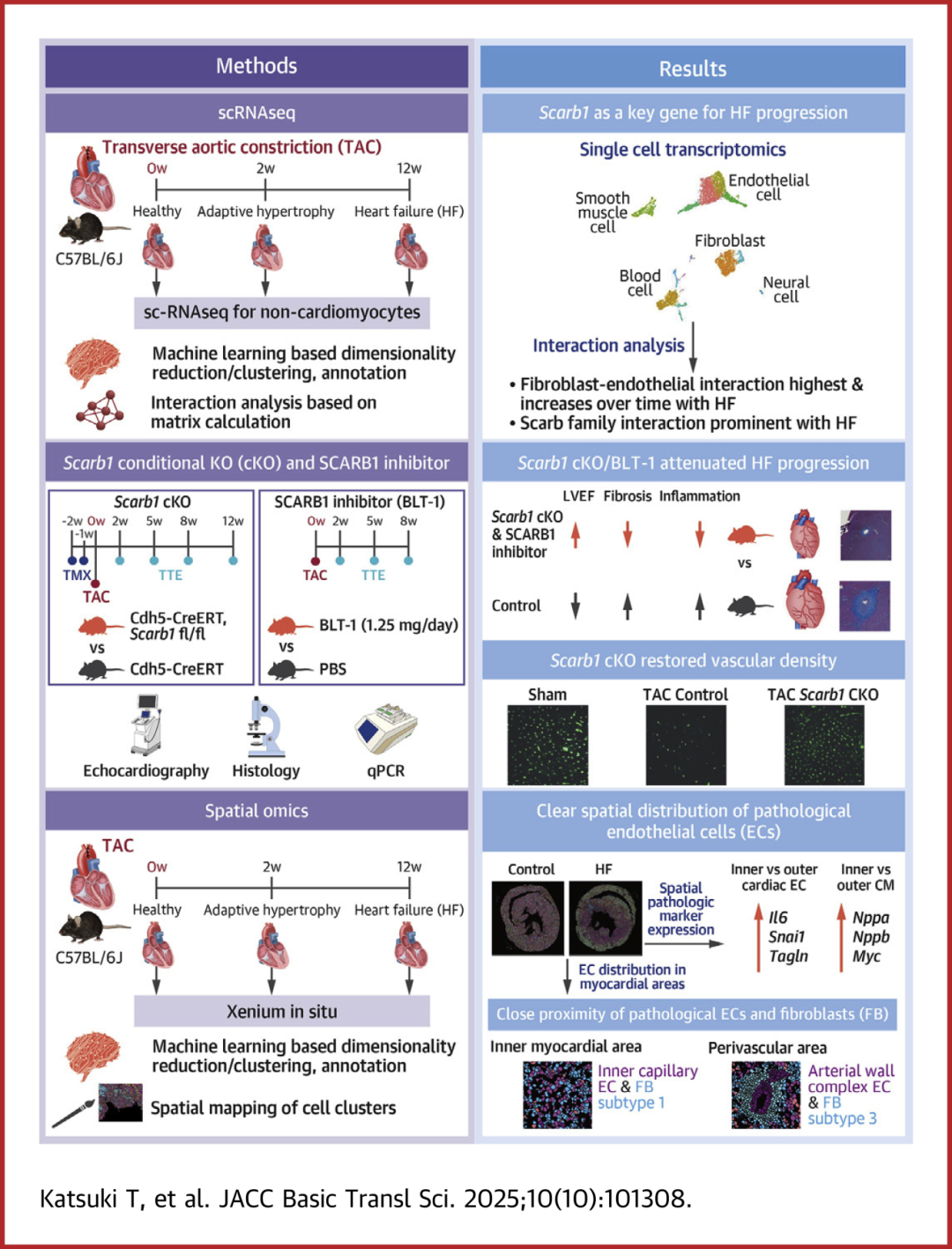
图5 图形概要
总之,该研究利用scRNA-seq证明由SCR1受体介导的ECS与FBs间的相互作用是治疗伴有心脏肥厚的进行性心衰的有效靶点。SCARB1特异性抑制剂BLT-1已被证明在此背景下具有心脏保护作用。BLT-1靶向内皮细胞中的SCARB1,显示出作为高血压性心力衰竭患者新型治疗策略的前景。进一步研究BLT-1的作用机制、疗效和安全性对于将该化合物发展为心力衰竭治疗的实用药物至关重要。
参考文献:Katsuki T, Kusumoto D, Akiba Y, Kimura M, Komuro J, Nakamura T, Hashimoto H, Kouka T, Sugai K, Katsumata Y, Miyasaka M, Suzuki Y, Kuramoto J, Kubota Y, Fukuda K, Yuasa S, Ieda M. Inhibition of Scarb1 on Endothelial Cells Attenuates Pressure Overload-Induced Heart Failure Progression. JACC Basic Transl Sci. 2025 Oct;10(10):101308. doi: 10.1016/j.jacbts.2025.05.003. Epub 2025 Aug 6. PMID: 40772900.
原文链接:https://pubmed.ncbi.nlm.nih.gov/40772900/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:仿生多细胞动态共培养系统

