巨噬细胞机械免疫调节血管生成和成骨作用影响骨折愈合的再生环境
2025-12-05 来源:本站 点击次数:428骨折愈合是一个复杂且高度协调的过程,包含连续且紧密相关的炎症、修复和重塑阶段。愈合级联从炎症阶段开始,特征是形成止血并作为细胞临时支架的纤维蛋白凝血块,随后是炎症性免疫细胞的浸润和募集,其中巨噬细胞(Mφs)已知在免疫反应中发挥长期作用。当 Mφs 进入受损组织时,会遇到高度炎症信号,诱导其进入主要的“促炎”M1样表型,驱动促炎细胞因子的释放(包括IL-6、IL-8、TNF-α),这些细胞因子同时在骨折愈合过程中协调下游再生过程。持续的炎症会导致愈合受损或延迟,因此,成功度过炎症阶段高度依赖于从M1样表型向“抗炎”M2样表型的严格调控转换。这一 M2 转换与修复期的进展相吻合,Mφs 分泌如抗炎细胞因子 IL-10 等因子,在成骨/软骨生成谱系的后续调控中起关键作用。由于 Mφs 在骨折愈合的所有阶段都具有关键的时间作用,因此,在早期纤维蛋白血肿中实现免疫调节是促进再生的有希望的新途径。
骨骼修复的一个强有力调节因子是机械负荷(骨碎片间应变),它可能作用于早期骨折血肿来调节免疫环境。重要的是,数据表明早期机械线索对长期愈合反应起关键作用,因为骨折后第一周施加的应变大小与长期骨再生呈显著正相关。这表明早期血肿的机械环境是通过潜在地影响免疫反应来调节愈合的关键因素。事实上,免疫反应受组织微环境信号控制,例如在许多疾病状况、炎症状态以及衰老背景下观察到的生物物理性质变化。然而,目前尚不清楚机械介导的 Mφ 表型变化是否通过间接影响早期血管形成和后期骨骼修复来影响再生环境。
点击了解:仿生压力细胞培养仪
机械力学-免疫学领域的研究正在兴起,旨在探讨机械线索如何塑造免疫细胞表型和功能。最近,来自爱尔兰圣三一大学生物医学工程中心及先进材料与生物工程研究中心(AMBER)的团队首次设计并验证了一种复制早期骨折血肿部位动态负荷条件的专用 3D 体外平台,通过表征 Mφ 表型、分泌组及可溶性因子对血管形成和成骨的影响来评估巨噬细胞对不同水平压缩应变的反应,并研究了如何利用局部力学来调节高度炎症环境以促进更有利于长期愈合的再生环境。研究成果发表于 Acta Biomaterialia 期刊题为“Mechano-immunomodulation of macrophages influences the regenerative environment of fracture healing through the regulation of angiogenesis and osteogenesis”。

首先,通过在不同染色强度的循环压缩刺激下,对已建立的 M1/M2 样及再生巨噬细胞相关标记进行基因和蛋白质表达分析,解析巨噬细胞表型调控。综合来看,结果支持人类巨噬细胞具有机械反应性,对负荷强度敏感,反应在表型和分泌组的变化。值得注意的是,最低幅度 5% 的应变代表了固定良好的骨缺损,通常在临床上表现出更好的愈合效果,能够促进再生细胞因子 IL-10 的产生,同时抑制促炎 IL-6 因子的分泌。较高的35% 应变代表未修复缺陷和愈合不良,导致分泌组再生能力较低,VEGF-A 和 IL-10 水平下降。
缺损部位血管的浸润发生在骨沉积之前,是骨愈合成功的关键。重要的是,巨噬细胞已知是血管形成的调节者,而血管形成高度依赖于其表型。因此,随后确认了在巨噬细胞条件培养基(CM)存在下差异极化巨噬细胞对人脐静脉内皮细胞(HUVECs)形成管状结构能力的基线效应(图1 B)。虽然与阴性对照组相比,M0 样巨噬细胞 CM 未改变血管形成结果,但 M1 样巨噬细胞 CM 导致连接、节点和分支的形成增加,M2a 样 CM 进一步增强。这些结果与巨噬细胞中分别通过启动血管形成和促进血管成熟的 M1 样和 M2 样表型的血管生成作用相符。
此外,研究了负荷巨噬细胞分泌组在决定管形成中的影响。高幅度 20–35% 机械负荷巨噬细胞 CM 时,HUVECs 重组明显减少(图1 A)。这一趋势经定量验证,与静态对照相比,暴露于低 5% 应变的巨噬细胞未改变形成的连接、节点或分支数量,但暴露于高 20% 应变导致连接、节点和分支数量的显著抑制,最高 35% 应变也出现类似趋势(图1 B)。这些数据表明,机械激活的巨噬细胞分泌旁分泌因子,以强度依赖性方式对血管生成产生负面影响,更高的压缩负荷会诱发抑制性血管生成巨噬细胞分泌组,从而可能延迟或损害骨骼早期愈合阶段。
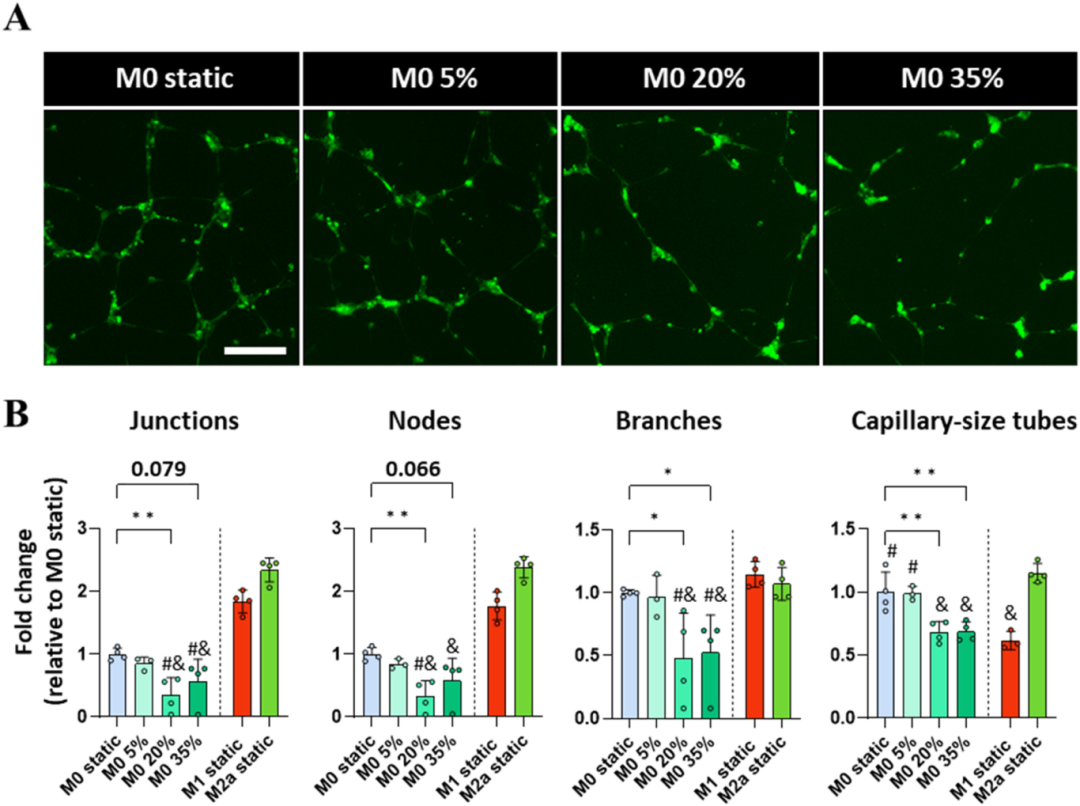
图1 机械激活的巨噬细胞分泌旁分泌因子,以强度依赖性的方式对血管生成产生负面影响。
接下来,探讨了巨噬细胞分泌的旁分泌因子在不同压缩强度下是否以及如何改变人骨髓来源间充质干细胞/基质细胞(MSCs)的成骨分化。有趣的是,与静态对照相比,虽然较低的负荷(5%、20%)似乎对 RUNX2 成骨标志物的 mRNA 水平没有影响(图2 A),但较高的 35% 负荷则使其显著增加1.62倍,与 M2a 表型相当。此外,由于机械压缩后 SOX9 软骨生成标志物表达未发生变化,导致 RUNX2/SOX9 比值以幅度依赖的方式增强,与静态对照相比,35% 负荷巨噬细胞分泌组的 RUNX2/SOX9 比率显著增加1.63倍,这符合 M2a 极化后的趋势,表明成骨潜力增强。在检测 BMP-2 mRNA 水平时,这一点得到了进一步的支持(图2 A),其中 BMP-2 的表达以幅度依赖的方式显著降低。
为了进一步验证和补充上述发现,进行了 14 天矿化试验评估了负荷巨噬细胞分泌组对 hMSCs 长期成骨作用的影响。首先观察到 hMSC 增殖和 ALP 活性均无显著变化,但有趣的是,巨噬细胞无论表型如何,在14天后都会分泌显著抑制 hMSC 矿化的因子。此外,机械刺激 M0 巨噬细胞导致旁分泌因子的分泌,进一步抑制长期成骨,在较高的 20–35% 负荷下达到显著水平,与静态对照组相比钙沉积分别降低 81% 和 84%(图2 B–C)。这一下降趋势与 M1 样矿化结果相符,而 M1 型已已知对长期骨沉积有害。
这些发现共同指向MSCs中早期骨生成信号的强力调控,最终通过调节巨噬细胞分泌组抑制后期骨沉积,尤其是在高强度压缩应变后。

图2 机械激活的巨噬细胞分泌旁分泌因子,以强度依赖性的方式介导成骨。
既然机械刺激可以以幅度依赖的方式调节 M0 样巨噬细胞的免疫反应,进一步关注的是是否可以利用局部力学来抑制代表受损骨缺损的高度炎症免疫环境(图3 A)。基于上述在未活化巨噬细胞中建立再生混合表型/分泌组的研究,以下实验选择了中等幅度的 5% 压缩应变。通过研究编码 M1 和 M2 样表型的基因表达,发现在 5% 压缩应变下 M1 样基因 CD80、CXCL9、CXCL10 和 CCR7 表达增强(图3 B),同时 MRC1 M2 标志物也增加(图3 C)但不显著。值得注意的是,IL-10 mRNA 表达水平未因负荷而改变。这表明,将 M1 极化巨噬细胞暴露于适度的 5% 预负荷下,诱导其向 M1/ M2 样表型的混合转变,尽管偏向于促炎表型,这与之前的 M0 研究中发现的结果一致,即较低负荷激活了 M0 样巨噬细胞的混合表型。在蛋白质水平上,机械刺激下 CD80 M1 和 CD206 M2 样细胞表面标记均上调,进一步证实了这一点(图3 D-E)。
随后,试图考察所得的混合表型是否与 M1 极化巨噬细胞高度炎症分泌组的调控对应。有趣的是,尽管炎症基因有所增加,但中等 5% 的预负荷水平相比静态对照组减少了炎症细胞因子的分泌,如促炎 IL-6 因子、TNF-α 因子显著下降(图3 F),这符合再生性 M2a 表型的趋势。值得注意的是,与静态对照相比,机械刺激下 IL-8 的产生没有变化。而且这种促炎水平的调节并未以 IL-10 和 VEGF-A 促再生细胞因子的分泌为代价。这些发现凸显了中度压缩负荷在调节过度激活炎症免疫反应方面的潜力,这通常发生在受损的骨缺损中。
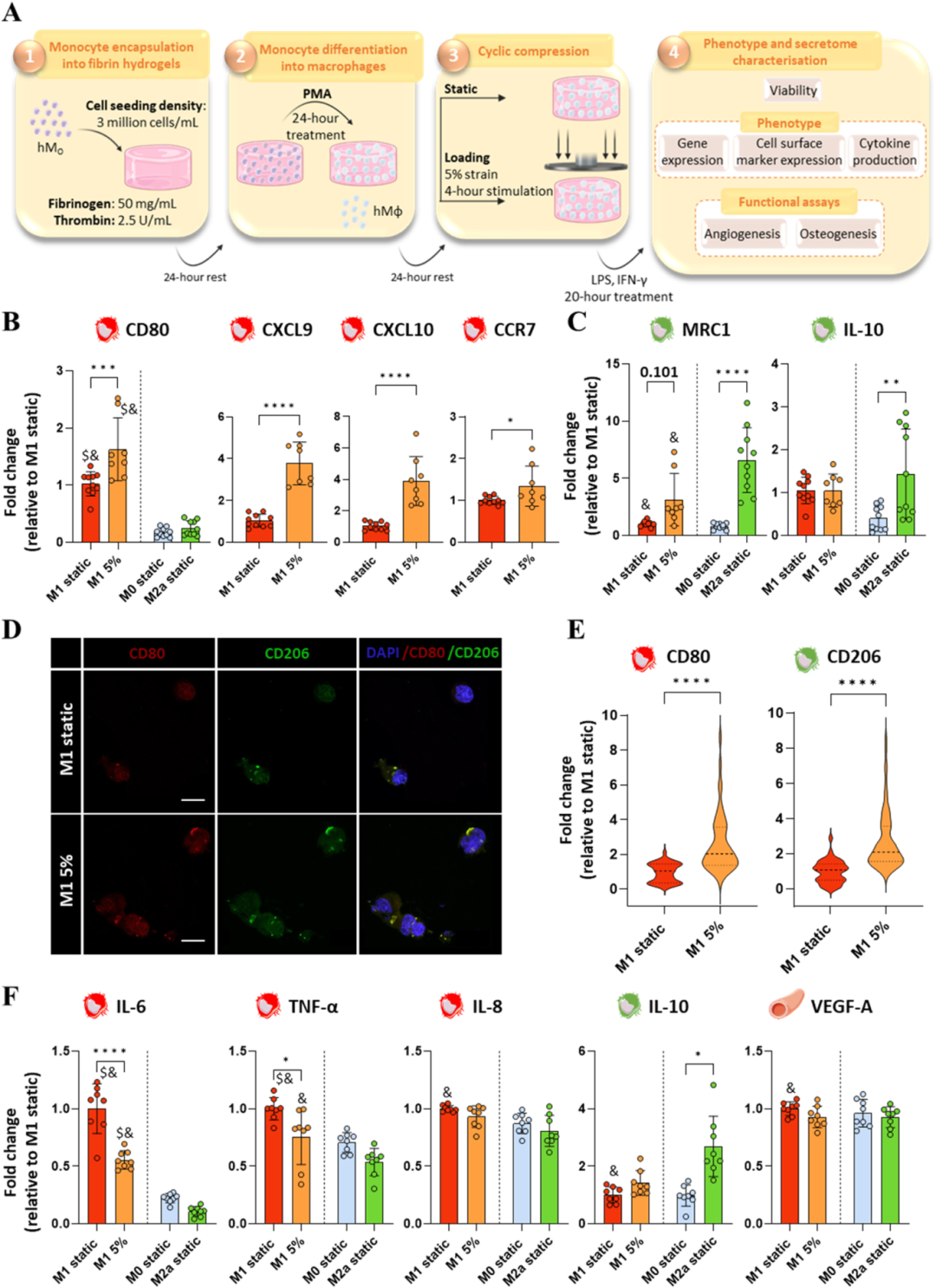
图3 中度压缩应变可以改变高度炎症性巨噬细胞的表型,从而抑制促炎巨噬细胞分泌组。
为了进一步探讨局部力学在受损环境中指导骨愈合过程的作用,通过前述的管形成试验评估了机械激活的 M1 极化巨噬细胞分泌组的血管生成再生特性。结果表明,在炎症环境中,控制局部力学可以通过调节巨噬细胞分泌组重塑血管化,承受适度负荷,血管的再生能力增强。这些发现为局部力学通过调节局部免疫环境间接重塑早期血管形成提供了证据。
最后,通过前述的成骨试验评估机械激活的 M1 极化巨噬细胞分泌组的成骨再生特性。暴露于机械刺激 M1 巨噬细胞条件培养基的人 MSCs 显示出 RUNX2 适度但不显著的增加(图4 A),同时未影响软骨生成 SOX9 水平,因此与静态 CM 对照相比,RUNX2/SOX9 比率呈上升趋势,尽管不显著。这些结果表明,hMSCs 早期成骨谱系承诺可能向 M2a 样表型转变(图4 A),进一步体现在负荷 M1 CM 处理后 BMP-2 mRNA 水平的显著下降。
为了研究骨形成的长期影响,进行了前述的14天矿化分析,观察到 hMSCs 的增殖和 ALP 蛋白生成均未显著变化。此外,虽然 5% 预负荷巨噬细胞分泌组能够推动骨生成基因表达的微小变化,但这并未转化为后续矿化结果,这一点从与静态对照 CM 相比钙沉积变化不显著所证明(图4 B)。这些结果表明,适度负荷优先调控修复早期阶段,通过靶向巨噬细胞表型和早期血管形成,而在受损环境中对后期成骨作用影响有限。
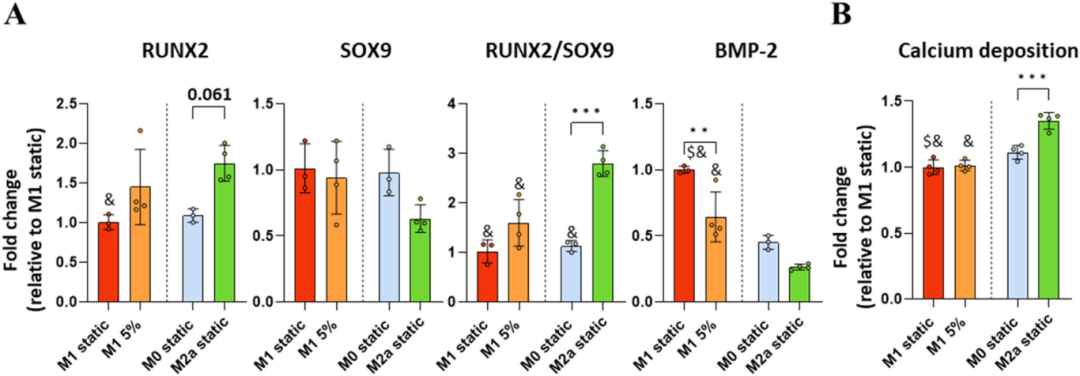
图4 较低的动态压缩负荷对通过调节高度炎症性巨噬细胞分泌组对骨沉积的后续协调影响有限。
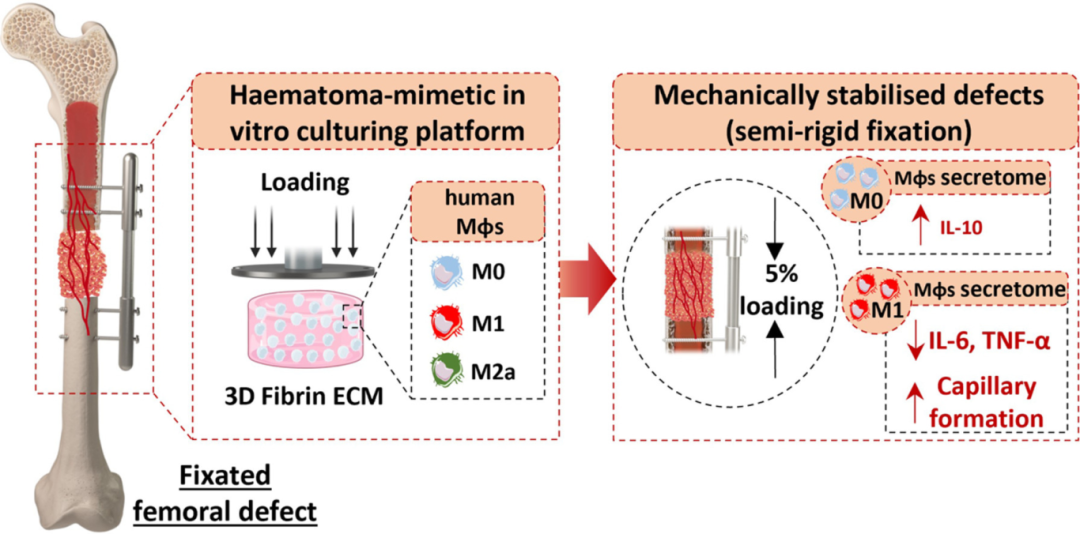
图5 图形概要
利用该模型,该研究证明,巨噬细胞对压缩负荷强度具有响应性且敏感性,中等负荷(5%应变)会产生再生巨噬细胞混合表型和分泌组,而高度负荷(35%应变)则产生对血管生成和骨生成不利的分泌组。此外,中等幅度应变还可以抑制炎症性受损骨折模型中的炎症。总之,该研究提供了有力证据,表明局部机械线索对巨噬细胞具有强大的免疫调节作用,这有助于理解局部固定器刚度对骨折修复的影响,并最终证明了一种调节骨缺损早期免疫反应的新方法。
参考文献:Petrousek SR, Kronemberger GS, O'Brien G, Hughes C, O'Rourke SA, Lally C, Dunne A, Kelly DJ, Hoey DA. Mechano-immunomodulation of macrophages influences the regenerative environment of fracture healing through the regulation of angiogenesis and osteogenesis. Acta Biomater. 2025 Jun 15;200:187-201. doi: 10.1016/j.actbio.2025.05.045. Epub 2025 May 21. PMID: 40409508.
原文链接:https://pubmed.ncbi.nlm.nih.gov/40409508/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:仿生压力细胞培养仪

