B10通过激活PD-1促进骨髓来源巨噬细胞(BMDM)的极化和促解炎功能
2025-12-05 来源:本站 点击次数:477B10 Promotes Polarization and Pro-Resolving Functions of Bone Marrow Derived Macrophages (BMDM) Through PD-1 Activation
Keywords: B10 cells; PD-1; SPMs; macrophage; regulatory B cell.
调节性B细胞(B regs )通过免疫调节细胞因子抑制过度炎症。值得注意的是,分泌白介素-10(IL-10)的调节性B细胞称为B10细胞(B-10),通过IL-10的生成在调节免疫反应中发挥关键作用。研究已表明,B-10抑制CD8+ T细胞增殖,B-10效应细胞的功能可通过MHC classII和CD40与CD4+ T细胞同源相互作用增强。
巨噬细胞也是调节炎症状态的主要角色。一般来说,促炎巨噬细胞(M1表型)有促炎介质的产生,抵抗微生物病原体并激活适应性免疫反应。相比之下,促解炎巨噬细胞(M2表型)极化以防止宿主过度炎症反应并促进组织修复过程。巨噬细胞还通过中性粒细胞凋亡中的吞噬作用和特异性促解炎介质(SPMs)的分泌对炎症的缓解做出关键贡献。
为了阐明B-10与巨噬细胞之间的相互作用,研究已探讨了两种细胞类型之间潜在的配体-受体联系。有趣的是,人类CD19+ CD24+ CD38+ B细胞(B regs 的一个子集)表现出程序性细胞死亡配体1(PD-L1)的表达升高。另一方面,观察到表达程序性细胞死亡受体1(PD-1)的巨噬细胞表现出M2功能。PD-L1/PD-1轴是参与负向免疫调控的关键配体-受体信号通路。因此,表达PD-L1的B-10和表达PD-1的巨噬细胞之间的串扰可能通过PD-L1/PD-1的结合促进其炎症消退功能。
点击了解:仿生多细胞动态共培养系统
基于此,美国诺瓦东南大学牙科学院口腔科学与转化研究系团队探讨了B-10是否能通过PD-L1/PD-1连接增强巨噬细胞促解炎功能。研究表明,B-10增强了M2型巨噬细胞极化,上调了PD-1表达,并促进了吞噬细胞活性和特异性SPMs产生等促解炎功能。这种对巨噬细胞促解炎功能的诱导需要细胞间的接触,尤其是通过PD-1激活。研究成果发表于 CELLS 期刊题为“B10 Promotes Polarization and Pro-Resolving Functions of Bone Marrow Derived Macrophages (BMDM) Through PD-1 Activation”。

首先,研究了B-10细胞通过直接细胞间相互作用影响巨噬细胞极化的能力。对BMDMs与B-10进行共培养,建立四个实验组:单独M0巨噬细胞(M0)、初始B细胞与巨噬细胞(M0 + B)、间接共培养的B-10细胞与巨噬细胞(Tr M0 + B-10)、直接共培养的B-10细胞与巨噬细胞(M0 + B-10)。共培养48小时后,流式细胞术评估了各组M1巨噬细胞(F4/80+/CD86+)和M2巨噬细胞(F4/80+/CD206+/CD163+)的比例,发现 F4/80+ CD86+ 细胞的比例在所有条件下无显著变化。相比之下,与M0组相比,M0 + B-10组中F4/80+ CD206+ CD163+ 细胞的比例和出现频率均显著升高,其他两组未检测到显著变化。这些结果表明,B-10细胞通过细胞间直接接触增强M2巨噬细胞的极化,而不影响M1巨噬细胞的分化。
随后,评估了B-10细胞与BMDMs共培养是否能增强PD-1表达。与单独M0组相比,M0+B组的PD-1蛋白或mRNA水平未见显著变化,然而,M0 + B-10组的PD-1表面蛋白和 Pdcd1 mRNA表达显著增加,Tr M0 + B-10 组PD-1蛋白水平未显著增加,但Pdcd1基因表达明显下降。这些结果表明,巨噬细胞中B-10细胞对PD-1的上调需要直接的细胞间接触。
M2巨噬细胞可进一步细分为四个亚群:M2a、M2b、M2c和M2d。如前所述,B-10细胞通过细胞间直接接触促进M2巨噬细胞极化。为探究共培养巨噬细胞中哪些M2亚群相关的细胞因子上调,评估了Il10及多种M2亚群标志物的mRNA表达水平,包括M2a相关标记物Il1rn和Arg1,M2b相关标记物Il1β、Il6、Ccl1,M2c相关标志物Tgfβ,以及M2d相关标记物Vegfα。与M0组相比,M0+B组细胞因子表达无显著差异,Tr M0 + B10组Arg1 mRNA表达显著升高(图1 C),M0 + B-10组在Il10、Il1rn、Arg1、Il6和Ccl1的mRNA水平上显著升高(图1 A-C、E、F)。 此外,在比较Tr M0 + B-10和M0 + B-10组时,后者中M2a相关基因和M2b相关基因水平显著升高(图1 A-C、E、F)。这些结果表明,直接细胞间接触是B-10细胞调控M2a和M2b巨噬细胞因子表达的关键机制。

图1 B-10细胞增强巨噬细胞中的M2相关细胞因子。
吞噬活性是巨噬细胞活性的一个关键促解炎方面,因此,接下来评估了B-10细胞是否增强了这一功能。流式细胞术数据显示,M0 + B组吞噬细胞比例无变化,Tr M0 + B-10组的吞噬活性显著增强,而M0 + B-10组表现出显著更高的吞噬活性。免疫荧光染色结果显示,Tr M0 + B-10组和M0 + B-10组的pHrodo™ 生物颗粒阳性细胞显著增加,且后者观察到更多的阳性细胞。这些结果表明,B-10细胞主要通过直接相互作用增强巨噬细胞吞噬功能。
被B-10细胞极化的巨噬细胞通过直接细胞间接触表现出PD-1表达增加和向M2表型转变的趋势。然而,该过程中具体的配体-受体相互作用仍不明确。因此,实验研究了B-10细胞是否通过巨噬细胞上的PD-1和B-10细胞上的PD-L1调节促解炎巨噬细胞的极化。PD-1在PD-1 KO BMDMs 中被降低(图2 A、B),Pg.-LPS和CpG刺激可增强B-10细胞上的PD-L1表达(图2 C、D)。共培养48小时后,流式细胞术评估以下各组的M1和M2表型标志物:WT M0、WT M0 + B、WT M0 + B10、PD-1 KO M0、PD-1 KO M0 + B,以及PD-1 KO M0 + B10。数据显示,与单独PD-1 KO M0相比,WT M0 + B组或WT M0 + B10组F4/80+ CD86+ 细胞的比例没有一致的增加,PD-1 KO M0 + B组或 PD-1 KO M0 + B10 组也没有一致的增加(图2 E、F)。虽然F4/80+、CD206+和CD163+ 三阳性细胞数量在WT M0 + B中与WT M0无显著差异,但在WT M0 + B10组中显著增加(图2 G、H)。然而,与单独PD-1 KO M0组相比,PD-1 KO M0 + B组或PD-1 KO M0 + B10组无统计学差异(图2 G、H)。这表明,B-10细胞与巨噬细胞之间的PD-L1/PD-1轴对于诱导M2型巨噬细胞极化至关重要。
接着,检测了PD-L1/PD-1连接在调控M2相关细胞因子表达中的作用。野生型(WT)巨噬细胞与初始B细胞共孵育,细胞因子mRNA水平与WT M0对照组无显著变化。相比之下,与B-10培养的WT BMDM 组M2a和M2b的基因表达显著升高。相反,使用初始B细胞培养的PD-1 KO巨噬细胞相比PD-1 KO M0对照组,CCL1 mRNA水平显著下降。在与B-10细胞培养的PD-1 KO巨噬细胞中,Tgfβ和Vegfα的mRNA水平显著降低,而Il10、Il6和Ccl1 mRNA水平显著升高。这说明,B-10细胞与巨噬细胞之间的PD-L1/PD-1相互作用主要增强了M2a相关细胞因子的产生,而M2b相关细胞因子表达似乎不受PD-L1/PD-1信号传导的影响。
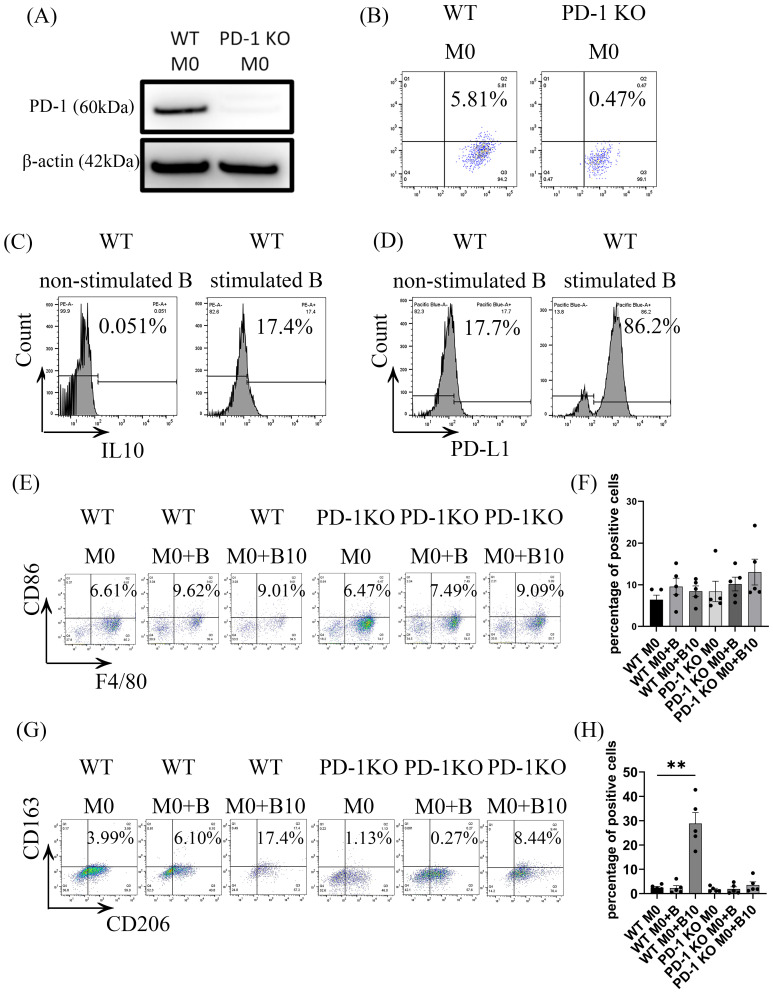
图2 B-10细胞通过PD-L1/PD-1连接诱导巨噬细胞从M0 到M2极化。
进一步地,通过在共培养实验中使用PD-1 KO巨噬细胞,实验探讨了PD-L1/PD-1信号对巨噬细胞中B-10诱导吞噬作用的影响。与B-10细胞共培养的WT巨噬细胞中,吞噬巨噬细胞的比例显著增加,但在 WT BMDMs和初始B淋巴细胞共培养条件下则无显著增加。相比之下,将PD-1 KO BMDM与初始B淋巴细胞或B-10共培养,吞噬细胞的比例降低。这些数据表明,B-10主要通过PD-L1/PD-1连接促进巨噬细胞吞噬能力。
最后,为评估B-10细胞是否通过PD-L1/PD-1信号驱动SPMs合成,利用液相色谱-串联质谱(LC-MS/MS)分析了脂质组学。主成分分析(PCA)以二维(图3 A)和三维(图3 B)格式呈现,揭示了两个集群之间不同的SPM特征。一个簇包括WT M0、WT M0 + B、PD-1 KO M0和PD-1 KO M0 + B,另一个则包括WT M0 + B10和PD-1 KO M0 + B10,B-10共培养条件与其他组明显区分开(图3 A、B)。热图分析显示,有四个SPMs——18-羧基二醇LXB4、AT-RvD4、15-肾上腺素LXA4和RvD2——在共培养过程中B-10存在时明显高于其他组(图3 C)。火山图分析发现,RvD2(图3 E、H)和15-epi LXA4(图3 E、I)在WT M0 + B-10中显著上调(图3 D-G)。值得注意的是,这些升高的SPMs(RvD2和15-epi LXA4)在PD-1 KO M0 + B组和PD-1 KO M0 + B10组中缺失(图3 F、G)。
此外,由于SPM通路涉及15-脂氧酶(15-LOX),因此研究了Alox15基因表达。与单独WT M0相比,WT M0 + B中 Alox15 mRNA水平未显著变化,但在 WT M0 + B-10中显著增加,PD-1 KO M0、PD-1 KO M0 + B 和 PD-1 KO M0 + B10 组之间未检测到差异(图3 J)。这些发现表明,B-10细胞主要通过PD-L1/PD-1信号促进RvD2和15-epi LXA4的合成,以及Alox15基因表达。

图3 B-10细胞通过PD-L1/PD-1相互作用刺激专门的促解炎介质(SPM)合成。
总之,该研究表明,小鼠原级骨髓来源巨噬细胞中PD-L1/PD-1的结合增加了PD-1+ M2巨噬细胞的数量,并增强了其吞噬活性和特定SPMs(RvD2和15-epi LXA4)的产生。基于这些观察,产生IL-10并表达PD-L1的B-10细胞有望作为一种新型免疫调节疗法。特别是,B-10细胞促进与炎症缓解相关的巨噬细胞功能的能力,可能有助于开发靶向疗法。
参考文献:Memida T, Cao G, Dalir Abdolahinia E, Ruiz S, Huang S, Hassantash S, Shindo S, Okamoto M, Yamashita S, Nakamura S, Suzuki M, Kawai T, Han X. B10 Promotes Polarization and Pro-Resolving Functions of Bone Marrow Derived Macrophages (BMDM) Through PD-1 Activation. Cells. 2025 Jun 7;14(12):860. doi: 10.3390/cells14120860. PMID: 40558486; PMCID: PMC12191351.
原文链接:https://pubmed.ncbi.nlm.nih.gov/40558486/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:仿生多细胞动态共培养系统

