现货型新生抗原疫苗联合ICI在晚期纤维板层型肝癌中展现治疗潜力
2025-12-05 来源:本站 点击次数:346▶ 发表时间:2025年11月24日
▶ 期刊:《Nature Medicine》(IF:28.5)
▶ 文章标题:A therapeutic peptide vaccine for fibrolamellar hepatocellular carcinoma: a phase I trial
▶ 核心内容:
该I期临床试验研究显示,一种靶向纤维板层型肝癌(FLC)特有DNAJ-PKAc融合蛋白的“现货型”off-the-shelf 治疗性新生抗原疫苗(FLC-Vac),联合纳武利尤单抗与伊匹木单抗,在晚期FLC患者中展现出可管理的安全性、强劲的免疫原性及令人鼓舞的临床活性。该研究为通过免疫策略靶向“不可成药”的致癌驱动因子提供了开创性概念验证。

研究背景:FLC的治疗困境与转化机遇
纤维板层型肝癌(FLC)是一种罕见的肝脏恶性肿瘤,好发于无肝病基础的青少年和年轻成人。其分子特征是在超过90%的病例中存在恒定的DNAJB1::PRKACA 基因融合,从而表达一种独特的嵌合癌蛋白DNAJ-PKAc。尽管该融合基因是明确的致癌驱动因子,但因其结构与正常蛋白激酶A高度相似,开发特异性分子抑制剂面临难以克服的靶点毒性,使其成为典型的“不可成药”靶点。鉴于其序列在所有FLC患者中高度一致,使得开发一种普适性的“现货型”疫苗成为可能。
本研究是一项单臂、开放标签的I期试验,旨在评估FLC-Vac联合纳武利尤单抗与伊匹木单抗在晚期FLC患者中的安全性、免疫原性与初步疗效。
1. 安全性特征与治疗耐受性在全部16例接受治疗的患者中,联合方案的安全性特征与已知的伊匹木单抗联合纳武利尤单抗的毒性谱基本一致。最常见的疫苗相关不良事件为注射部位反应(16/16, 100%),均为1-2级。共有6例患者(37.5%)报告了3级治疗相关不良事件,未观察到4级或5级事件 (表1)。这表明在双免疫检查点抑制剂(ICI)基础上加用肽疫苗,未引发新的安全性问题。
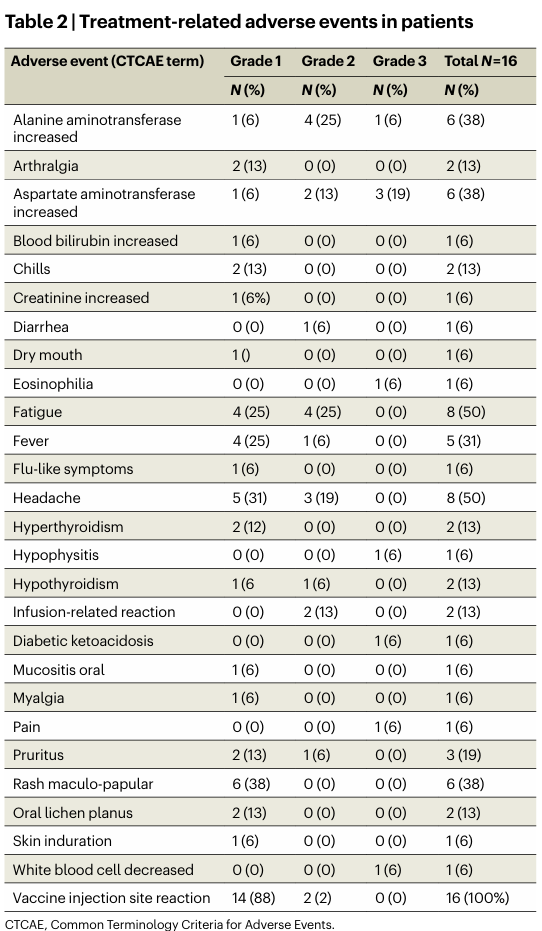
表1. 疫苗注射未引起新的安全性问题
2. 强劲的疫苗特异性免疫应答
研究的核心免疫原性终点显示,在完成10周疫苗 priming 阶段的12例可评估患者中,9例(75%)患者的外周血中检测到了针对DNAJ-PKAc融合肽的特异性T细胞应答,表现为干扰素-γ ELISpot 反应较基线显著增强。值得注意的是,所有获得临床缓解的患者均同时检测到了显著的T细胞应答。
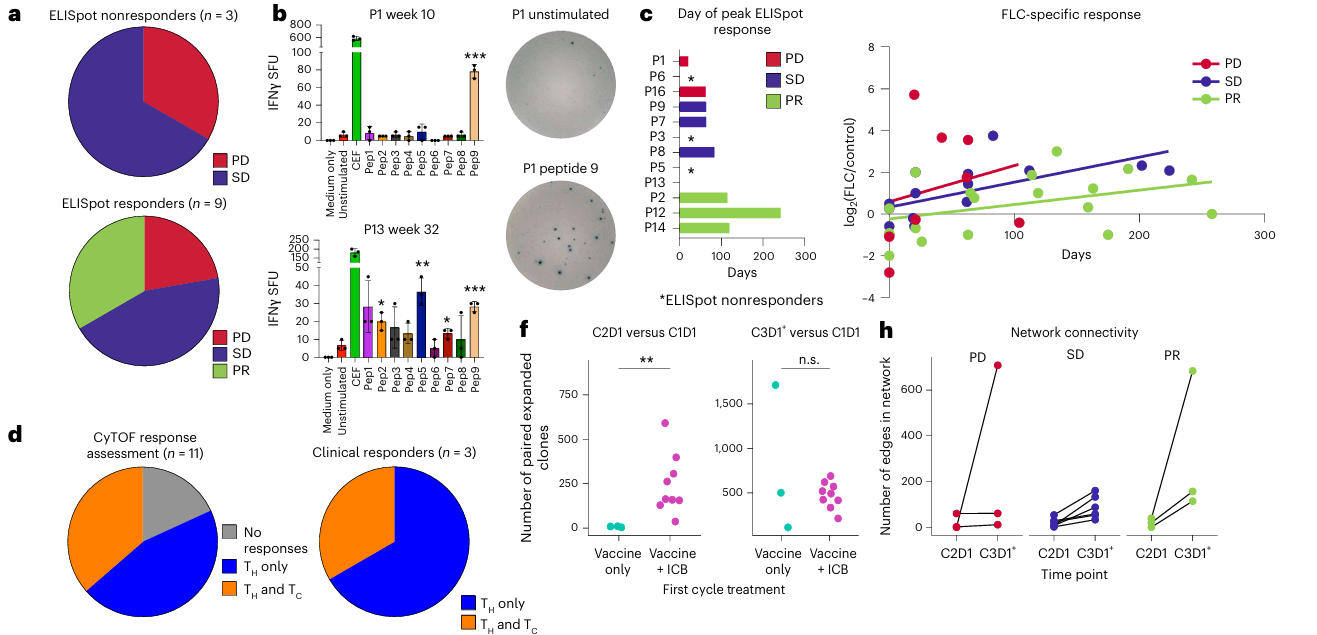
图1. 患者注射疫苗后的免疫应答
3. 显著的临床活性与生存获益
在12例完成 priming 的患者中,联合疗法展现了令人鼓舞的疗效:
●客观缓解率(ORR) 为25%(3/12),均为部分缓解(PR)。
●疾病控制率(DCR) 高达75%(9/12)(图. 2c-d)。
●影像学评估直观展示了患者靶病灶的显著消退 (图 2g)。
●中位无进展生存期(PFS)为8.5个月,中位总生存期(OS)尚未达到 (图2e-f)。这一数据在目前缺乏有效系统性疗法的晚期FLC背景下,具有重要的临床意义。
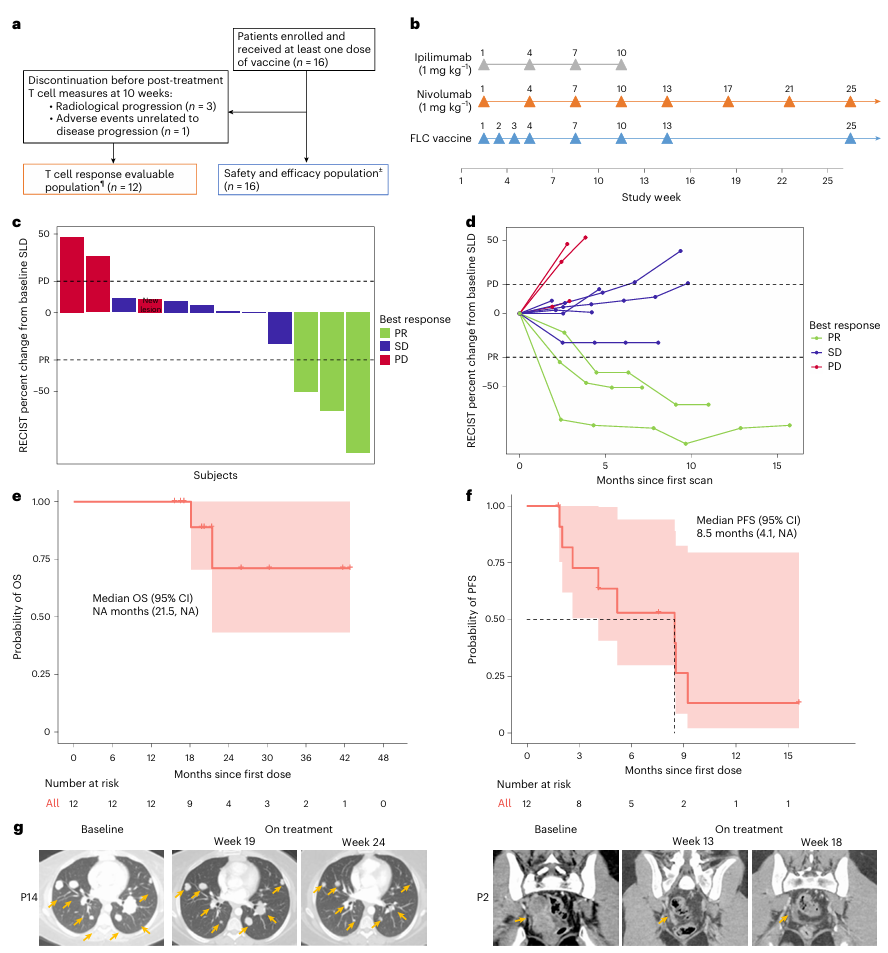
图2. 疫苗的临床活性与生存获益
作用机制深度解析:疫苗与ICI的协同效应本研究通过多组学分析,深入阐释了联合疗法的协同作用机制:
疫苗有效 priming 抗原特异性T细胞:疫苗成功激活了针对DNAJ-PKAc多个表位的多克隆CD4+ T细胞应答。研究人员从应答者体内鉴定出多个融合特异性的、受HLA-II类分子(如HLA-DRB3*01:01)限制的T细胞受体(TCR)。
●ICI增强T细胞克隆扩增与肿瘤浸润:与初始周期接受疫苗单药治疗的患者相比,从一开始就接受疫苗联合ICI治疗的患者,其外周血中表现出更为显著的TCR克隆扩增 。进一步分析证实,这些在外周血中扩增的T细胞克隆,在治疗后成功浸润至肿瘤组织内部。
●免疫应答的生物标志物:研究构建了一个包含ELISpot功能应答和TCR repertoire网络连通性(以边数量化)的决策树模型。该组合模型能极佳地区分临床应答者与非应答者(AUROC = 0.944),为未来预测疗效提供了潜在的生物标志物。
对未来肿瘤治疗范式的启示与展望本研究的成功,其意义远超对单一癌种的治疗突破,它标志着肿瘤免疫治疗进入了一个新的阶段:
1.范式转换:从“药理抑制”到“免疫靶向”:该策略为所有因毒性或结构问题而“不可成药”的致癌驱动因子(如KRAS G12V, MYC等)提供了全新的解决方案——即不直接抑制其功能,而是将其作为免疫系统的“靶标”,实现精准清除。
2.“冷肿瘤”免疫增敏的关键:对于FLC这类肿瘤突变负荷低、免疫细胞浸润少的“免疫荒漠型”肿瘤,治疗性疫苗可作为有效的免疫“启动器”,将“冷肿瘤”转化为“热肿瘤”,从而为ICI的效力发挥创造必要的免疫微环境前提。
3.靶向驱动性新抗原的优势:与随机突变产生新抗原不同,致癌融合蛋白是肿瘤维持恶性表位所必需的,因此不易因免疫编辑而丢失,可最大程度避免抗原丢失导致的耐药。本研究在治疗后的耐药病灶中均未检测到DNAJ-PKAc或HLA分子的丢失,印证了这一点 (图Fig. 3a, 3b, 3c)。
4.“现货型”疗法的广阔前景:该研究验证了针对“公共”新抗原开发通用型疫苗的可行性。其无需个性化定制、成本可控、可及性高的特点,预示着未来可能在多种拥有共同驱动突变的癌症中(如IDH1 R132H, BRAF V600E等)得到广泛应用。
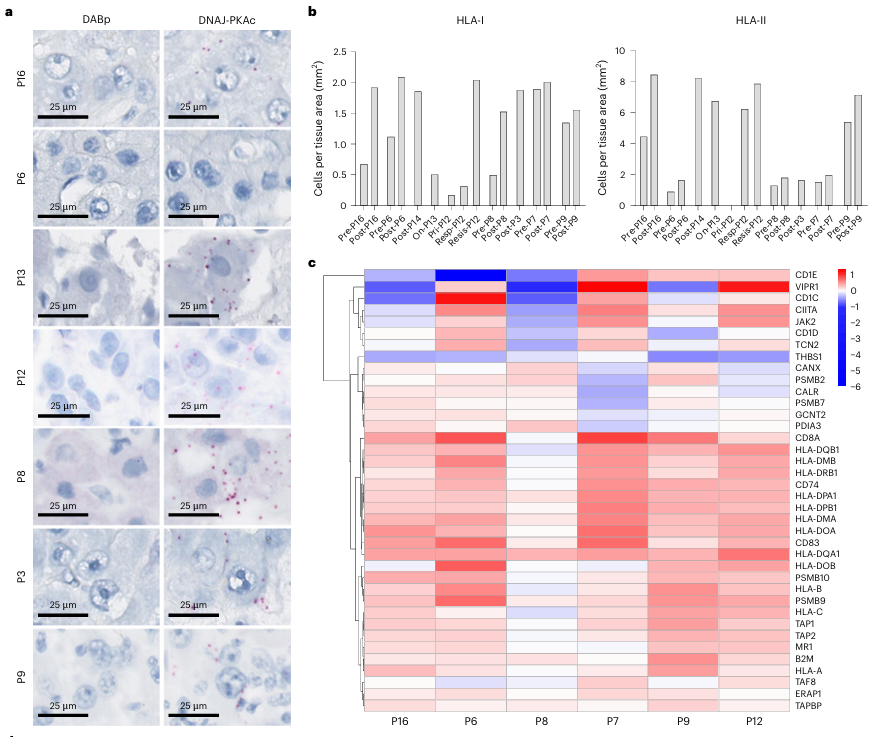
图3.DNAJ-PKAc表达在耐药病灶中表达未缺失
结论
这项开创性的I期临床试验证实,靶向共享致癌驱动新抗原的现货型肽疫苗FLC-Vac,与双免疫检查点抑制剂联合,在晚期FLC中安全可行,并能诱导强大的特异性T细胞免疫与显著的临床抗肿瘤活性。它成功地将一个“不可成药”的靶点转化为一个“免疫可成药”的靶点,为攻克一系列由明确驱动基因主导但缺乏靶向药的恶性肿瘤,铺就了一条充满希望的新道路。

