钠-葡萄糖转运蛋白2抑制剂恩格列净防止振荡剪切力引起的内皮功能障碍
2025-12-10 来源:本站 点击次数:538Sodium glucose co-transporter 2 inhibitor empagliflozin prevents endothelial dysfunction induced by oscillatory shear stress
Keywords: Calcium; Empagliflozin; Oscillatory shear stress; Sodium-calcium exchanger; Sodium-hydrogen exchanger 1.
钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)恩格列净(EMPA)是一种降血糖药物,对糖尿病患者和非糖尿病患者的心血管均具有显著益处。EMPA的心血管保护作用至少部分由其内皮保护作用介导。体外实验显示,EMPA对暴露于促炎细胞因子或循环拉伸幅度增加的人类内皮细胞(ECs)有多重有利效果,如减少氧化应激、增强内皮屏障功能、缓解炎症反应以及改善离子稳态。研究表明,利用生理模型模拟持续暴露于单向血流(层流剪切应力,LSS)的体内状态,EMPA能有效减少被TNF-α刺激的人类冠状动脉内皮细胞(HCAECs)中活性氧(ROS)的产生,并恢复一氧化氮(NO)生物利用度。在LSS下TNF-α刺激的ECs细胞中,EMPA对ROS过度产生的抑制作用是通过抑制钠-氢交换体1(NHE1)相关的钠内流([Na+]i)和随后通过钠钙交换体(NCX)的Ca2+ 流入介导的。通过抑制暴露于LSS下TNF-α的HCAECs中NHE1/NCX,EMPA可减少细胞内Ca2+ 积累从而削弱ROS生成。这些发现表明,EMPA主要通过调节离子稳态来调节内皮氧化应激。虽然EMPA在LSS下的保护作用已被充分确立,但其对振荡剪切应力(OSS)下内皮功能的影响尚不明确。
动脉粥样硬化区域、主动脉弓及其分支以及围手术期的血流紊乱会对内皮细胞施加OSS。OSS通过增加细胞骨架张力并增强血管内皮(VE)-钙黏蛋白的磷酸化,破坏内皮屏障的完整性。此外,OSS通过激活NOXs、ERK1/2、NF-κB信号传导诱导氧化应激和炎症。OSS下的炎症反应还通过ICAM-1的上调促进单核细胞粘附和跨内皮迁移,进一步加重血管功能障碍。Piezo1是一种机械敏感离子通道,通过介导Ca2+ 内流在内皮细胞对剪切应力的反应中起关键作用。在LSS下,激活 Piezo1促进适度的Ca2+ 流入,促进NO的产生和维持内皮稳态。然而,OSS下过度的Piezo1激活会导致细胞内Ca2+ 过载。Ca2+ 水平升高激活NOX2,促进ROS积累,进而刺激下游ERK1/2信号通路,破坏内皮连接。考虑到细胞内Ca2+ 和ROS生成之间的相互作用,目前尚不清楚EMPA是通过 Piezo1调节还是通过其他机制(如NHE1/NCX途径)减轻OSS诱导的内皮功能障碍。
点击了解:仿生流体剪切应力系统
近日,荷兰阿姆斯特丹大学医学中心心血管科学研究所联合麻醉学部门成员在一项研究中假设EMPA通过减少ROS产生、维持VE-cadherin完整性并抑制炎症反应,缓解OSS诱导的内皮功能障碍。为了研究EMPA在生理和病理相关剪切应力下的内皮效应,采用体外流动模型和离体小鼠主动脉免疫染色,特别关注主动脉弓,并旨在确定潜在保护效果是通过抑制 Piezo1 还是通过调控NHE1/NCX轴介导的。研究成果发表于 Biomedicine & Pharmacotherapy 期刊题为“Sodium glucose co-transporter 2 inhibitor empagliflozin prevents endothelial dysfunction induced by oscillatory shear stress”。

首先,与LSS(12 dyne/cm2)相比,OSS(± 4 dyne/cm2)提高了HCAECs中的ROS产生,而EMPA阻止了这一效应(图1 a)。在OSS下HCAECs的NO生物利用度受损,通过EMPA得以恢复(图1 b)。在LSS暴露的HCAECs中单用EMPA未影响ROS的产生和 NO 的生物利用度。此外,还进行了Ca2+ 测量,以研究细胞内Ca2+ 对流动下EMPA抗氧化作用的参与。结果表明,与 LSS 相比,OSS 增加了细胞内Ca2+,这种效应被EMPA降低(图1 c–d)。钙螯合剂BAPTA-AMwanquan降低了OSS触发的ROS生成,与EMPA联合使用未增强BAPTA-AM的抗氧化效果,表明EMPA对ROS的抑制作用至少部分由细胞内Ca2+ 的减少介导 (图1 e)。

图1 EMPA以钙依赖的方式抑制OSS诱导的ROS生成。
主动脉弓(即血流紊乱易发区)内皮细胞显示超氧化物歧化酶1(SOD1)表达减少,与EMPA体外培养后SOD1表达增加(图2 a-c),说明EMPA降低体外分离主动脉的氧化应激,这强烈支持体外条件下的研究发现。

图2 EMPA可降低离体主动脉氧化应激。
接下来,使用NHE1抑制剂cariporide和NCX抑制剂ORM-10962均降低暴露于OSS的HCAECs的ROS产生。与EMPA联合使用时,其ROS抑制效果并未进一步增强。此外,EMPA不影响流动中HCAECs中NHE1的表达。
研究结果还显示,OSS或EMPA未影响HCAECs中的Piezo1表达。敲低Piezo1 可显著降低OSS下HCAECs中ROS的产生。然而,EMPA和敲低Piezo1的组合对OSS诱导的ROS产生没有影响。这些数据表明,EMPA通过抑制NHE1/NCX轴减少Ca2+ 相关ROS的产生。
此外,在暴露OSS的HCAECs中,EMPA有效抑制细胞间隙(intercellular gap)形成的增加(图3 a-b)。OSS或EMPA均未调节HCAECs中VE-钙粘蛋白的总水平(图3 d)。相反,OSS增加了酪氨酸731位点VE-钙粘蛋白磷酸化,而EMPA则阻止了这一效应(图3 c)。EMPA还阻止了OSS诱导的src家族激酶(SFK)在HCAEC中的磷酸化(图3 e),该激酶是磷酸化VE-钙粘蛋白的上游激酶之一。在LSS或OSS下,EMPA未影响HCAECs中酪氨酸658位点VE-钙粘蛋白的磷酸化。
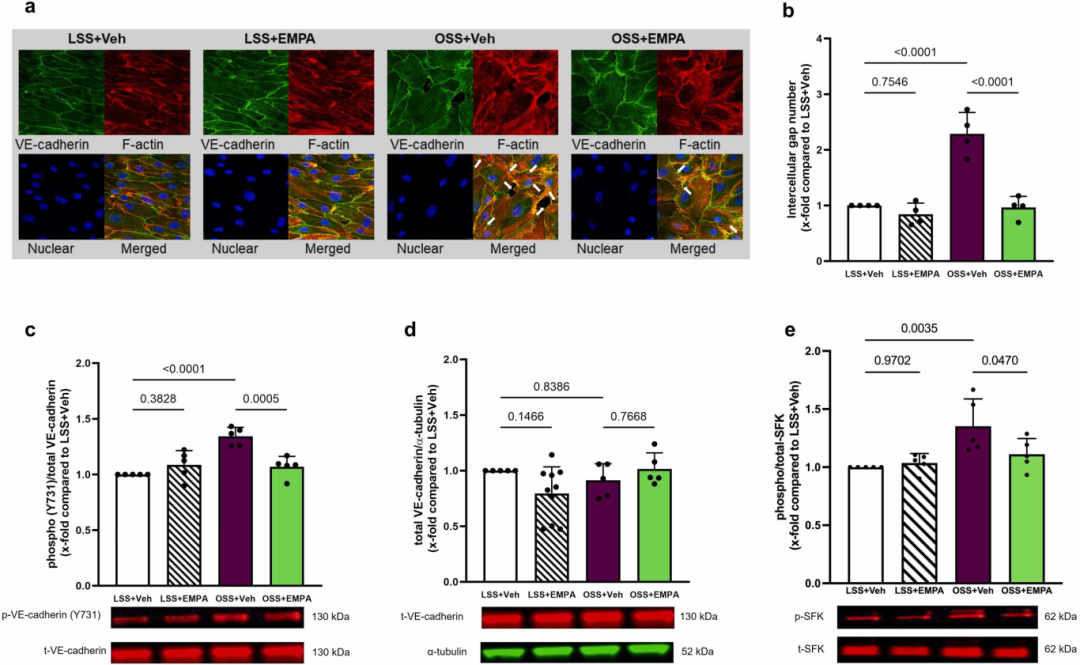
图3 EMPA可以防止HCAECs在血流紊乱期间细胞间隙的增加。
暴露于OSS会增加HCAECs中的细胞间黏附分子-1(ICAM-1)表达,而EMPA则阻止了这一效应(图4 a-b)。此外,EMPA抑制OSS下THP-1来源的巨噬细胞通过HCAECs 的转运(图4 c- e)。Infra-red Western blot显示,EMPA逆转了受OSS影响的ECs中ERK1/2磷酸化的增加(图4 f)。这些数据表明,EMPA抑制HCAECs中OSS引起的炎症反应。
最后,为了测试ROS生成与EC保护之间的因果关系,使用抗氧化剂NAC,发现对 OSS下HCAEC 施用0.5 mM 的NAC使ROS水平降低了34%。值得注意的是,高剂量(1 mM和5 mM)下的NAC并未表现出更强的ROS清除效应。
单用NAC及联合EMPA均显著减少了 ECs细胞间隙形成。NAC单用及NAC与EMPA联合处理也有效降低了VE-钙粘蛋白和SFK的磷酸化水平,但其联合处理并未进一步抑制细胞内间隙形成或VE-钙粘蛋白和SFK的磷酸化。NAC的应用未调节OSS 下HCAECs的VE-cadherin表达。虽然NAC和EMPA联合使用仍能降低暴露于OSS的HCAECs中ICAM-1表达和ERK磷酸化,但在仅单用NAC的ECs中未观察到此效应。这些数据表明,EMPA对OSS下HCAECs的内皮保护作用部分是由ROS介导的。

图4 EMPA抑制HCAECs中OSS诱导的炎症反应。

图5 血流紊乱下潜在的内皮保护作用。与LSS相比,OSS会诱导ROS生成增加,降低NO生物利用度,破坏VE-cadherin完整性,ICAM-1表达升高,以及单核细胞转运升高。EMPA对暴露于OSS的ECs表现出良好效果,表现为HCAECs中ROS生成减少、细胞内Ca2+ 减少、内皮屏障完整性增强以及缓解炎症反应。EMPA在血流下的抗氧化作用由NHE1/NCX/Ca2+轴介导。OSS下HCAECs内EMPA抑制ROS生成有助于增强屏障功能,但对炎症反应影响有限。
总之,该研究表明,EMPA通过NHE1/NCX通路减少细胞内Ca2+ 和ROS的产生,从而缓解OSS引起的内皮功能障碍。EMPA还能维持VE-cadherin的完整性并抑制内皮炎症,其中ROS抑制在屏障保护中起关键作用,但在ICAM-1调控中则无效。研究发现加深了对SGLT2抑制剂EMPA的心脏保护作用的理解,尤其是在血流紊乱导致内皮功能障碍和疾病进展的心力衰竭中。
参考文献:Li X, Wang M, Seehaber J, Stuhldreier C, Butt YA, Pacia MZ, Hollmann MW, Preckel B, Albrecht M, Zuurbier CJ, Weber NC. Sodium glucose co-transporter 2 inhibitor empagliflozin prevents endothelial dysfunction induced by oscillatory shear stress. Biomed Pharmacother. 2025 Nov;192:118670. doi: 10.1016/j.biopha.2025.118670. Epub 2025 Oct 22. PMID: 41130096.
原文链接:https://pubmed.ncbi.nlm.nih.gov/41130096/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:仿生流体剪切应力系统

