与疼痛研究相关的离子通道靶点介绍及其在疼痛中起的作用
2022-10-21 来源:本站 点击次数:3036疼痛是由背根神经节(DRG)神经元感知并传递到中枢神经系统的,DRG在功能上可分为三个亚细胞区室。1. 痛觉外周末梢感知到疼痛从而引起的刺激(机械感觉、热感觉和痛觉)。2. 传导痛觉信号的轴突。3. 突触前末端,它将信号转发到下一个神经元并向上传递到大脑,在那里信号被解释为疼痛(如下图所示)。

图1.疼痛信号的传播途径
疼痛的类型主要有两种:神经性(神经)疼痛和痛觉性(组织)疼痛。神经性疼痛是由神经系统的原发病变或功能障碍引起的。根据病变或功能障碍发生的部位,可细分为外周神经痛和中枢神经痛。外周神经痛可能是疾病引起的,而中枢神经痛则是脊髓或大脑受损引起的。神经性疼痛在受损组织明显愈合后持续很长时间,并经常转化为几乎没有任何保护作用的慢性疼痛。神经性疼痛实际上干扰了离子通道在痛觉中的作用,即损伤或疾病后正常功能的恢复。
痛觉性疼痛可细分为躯体疼痛(皮肤或深层组织)和内脏疼痛(内脏器官疼痛)。当从受损或发炎的组织中释放出的物质刺激痛觉感受器时,就会发生痛觉疼痛。这种物质的组合被称为“炎症汤”,它包括细胞外质子、核苷酸、神经生长因子、血清素、缓激肽等。痛觉感受器外周末梢也能对机械和热刺激做出反应(图1)。痛觉性疼痛可以是尖锐的、钝的或疼痛的。它通常是有时间限制的(一旦组织损伤愈合就会减少),起到保护作用。

图2. 感知神经的类型
与疼痛研究相关的离子通道靶点包括:Voltage gated Na+ and Ca2+ channels, TRP, ASIC, ligand gated ion channels, P2X, NMDA, AMPA and Kainate receptors。接下来就为大家介绍这些靶点在疼痛中如何起作用:
1. 疼痛的感知
瞬时受体电位通道(TRP通道)
哺乳动物的感觉系统能感受到很大范围的温度。温度低于15°C或高于43°C均会引起热感,并伴有疼痛感。六个热敏离子通道TRPV4(> 25°C), TRPV3(> 31°C), TRPV1(> 43°C), TRPV2(> 52°C), TRPM8(< 28°C)和TRPA1(< 17°C) 都具有不同的热激活阈值。
TRPV1通道(也称为辣椒素受体,VR1)参与热痛觉的研究已经通过不同的方法得到了很好的证明。2021年诺贝尔生理学或医学奖就针对TRP通道进行了相关研究:诺贝尔奖得主的文章 | 带您解析TRPV1和Piezo离子通道蛋白
TRPV1主要表达于痛觉感受器和感觉神经元中,被认为与组织损伤和炎症有关。TRPV1被热量和辣椒素激活12-15。据报道,在原生DRG神经元和异源系统中,炎症介质ATP和缓激肽(图1)分别通过P2Y2和B2受体增强TRPV1。

图2.
P2X受体
P2X3离子通道是疼痛处理过程中另一个重要且有充分记录的角色。P2X3通道属于配体门控离子通道家族(P2X1-P2X7七个受体亚型组成),由细胞外ATP激活。ATP是各种细胞反应(如肌肉收缩、蛋白质合成等)的主要能量来源。

图3.
同时ATP也是疼痛感受器的激活器,从受损或发炎的细胞中释放的ATP会激活P2X3受体,启动伤害感受信号。P2X3受体在DRG的痛觉感觉神经元上以同源体和异构体的形式高度表达(P2X3/P2X2)。在动物模型中,使用P2X3受体同质体和异质体的选择性非核苷酸拮抗剂(A-317491)可以减少损伤和慢性痛觉性疼痛。尽管P2X3和P2X3/2在介导急性炎症或内脏疼痛方面没有主要作用,但它们仍然是开发止痛药的可能靶点。
酸感应离子通道(ASICs)
组织酸中毒与炎症有关,是疼痛的重要来源。在炎症期间,细胞外pH值降低(低于pH=6),通过控制ASICs通道激活痛觉受体。ASIC是属于degenerin / ENaC超家族的钠离子通道。六种异构体由四个不同的基因编码:ASIC1a, ASIC1b, ASIC2a, ASIC2b, ASIC3和ASIC4。在疼痛研究中,最有趣的是ASIC3,它主要表达在DRG神经元中,使其成为疼痛传感器的一个很好的候选者。人类的ASIC3会造成炎症中的痛觉过敏(hyperalgesia)和异常痛觉(allodynia)。ASIC3在人类中的分布比在小鼠中更广泛,这可能表明它在人类的痛觉中发挥着更广泛的作用。

图4. ASIC3在DRG组织中表达
2. 疼痛信号的放大
电压门控钠离子通道
电压门控钠离子通道(Voltage gated Na+ channels,VGSCs,,NaV)是沿轴突传导的关键因素,包括初级感觉神经元。它们被认为在由周围神经损伤引起的几种慢性疼痛性神经病中起着至关重要的作用。生理学和药理学证据表明,VGSCs在神经或组织损伤引起的初级传入神经元高兴奋性的形成和维持中起着重要作用。
电压门控的Na+通道是一个由9个结构相关的α亚基(NaV1.1 ~ NaV1.9)组成的家族,它们具有不同的表达模式,并与一个或多个附属β亚基(β1 ~ β3)相关。α亚基异构体的表达是发育调控和组织特异性的。VGSC根据其对河豚毒素(TTX)的敏感性分为两组:TTX敏感通道和TTX不敏感通道。除了NaV1.4外,几乎所有VGSCs都在感觉神经元中有不同程度的表达。
| 通道 | 基因 | 染色体 | 是否TTX敏感 | 主要组织分布 |
| Nav1.1 | SCN1A | 2q23-24 | Yes | CNS |
| Nav1.2 | SCN2A | 2q23-24 | Yes | CNS |
| Nav1.3 | SCN3A | 2q23-24 | Yes | CNS (embryonic) |
| Nav1.4 | SCN4A | 17q23-25 | Yes | Skeletal muscle |
| Nav1.5 | SCN5A | 3q21-24 | No | Heart muscle |
| Nav1.6 | SCN8A | 12q13 | Yes | CNS (neuron, glia), PNS |
| Nav1.7 | SCN9A | 2q23-24 | Yes | PNS (neuron, Schwan), endocrine cells |
| Nav1.8 | SCN10A | 3q21-24 | No | PNS |
| Nav1.9 | SCN11A | 3q21-24 | No | PNS |
| NaV通道的命名及组织分布概述。(TTX = Tetrodotoxin,CNS = central nervous system, PNS = peripheral nervous system) | ||||
TTX敏感VGSC
Nav1.6存在于大多数感觉神经元中。Nav1.3在胚胎感觉神经元中高度表达,但在成人感觉神经元中则显著降低。损伤神经元和损伤脊髓中Nav1.3通道表达上调。Nav1.7主要表达于背根神经节(DRG)。Nav1.7基因的显性突变与红斑性痛症(一种罕见的常染色体疾病,其特征是散发的灼痛伴有四肢发红和发热)有关。这些数据可能证实了Nav1.7在痛觉中可能发挥的重要作用。
TTX不敏感VGSC
特别值得注意的是两个TTX不敏感通道,NaV1.8和NaV1.9,它们主要在小直径的DRG组织中表达。NaV1.9在C-纤维中表达,而NaV1.8在A-纤维中表达。到目前为止,人们对NaV1.9在神经痛中的作用知之甚少。到目前为止,积累的数据没有表明任何贡献,尽管通道的位置在DRG。NaV1.9的动力学特性和计算机分析表明,NaV1.9在静息膜电位处活跃,可能调节痛觉受体的静息电位及其对阈下刺激的响应。尽管NaV1.9被认为只在小直径的DRG中表达,但最近的数据表明它位于海马体中,在那里它被BDNF激活。NaV1.9的表达不仅限于DRG,这使得DRG作为疼痛治疗的候选药物的吸引力大大降低。相比之下,抑制NaV1.8通道已被发现可有效减少体细胞传入轴突损伤或组织炎症后的疼痛。也有研究表明,膀胱化学刺激后,NaV1.8通道参与传入神经的激活。

Nav1.9在DRG组织中的表达
IONIX制药公司已经基于NaV1.8结构和功能开发了针对NaV1.8的药物。一种是NaV1.8阻滞剂,另一种是NaV1.8调节剂,它下调了NaV1.8通道的功能表达
NaV1.8和NaV1.9在疼痛中的作用仍有争议。以下几点支持它们参与疼痛过程:
① DRG神经元内的有多个主要表达的Na+通道。
② 这两个通道的模式和表达水平的改变和会同时带来损伤或炎症
然而,Na+通道影响痛觉的机制仍有待进一步研究。
3. 疼痛信号传播至CNS
电压门控钙离子通道
电压门控Ca2+通道(VGCCs)也在痛觉感受器中表达,主要在背角的DRG神经元突触前末端,在那里它们控制神经递质的释放42。Ca2+通道由几个亚基组成,气孔形成的α1亚基和辅助亚基;β、γ、α2δ调节α1的功能。α1子单元定义了通道子类型。到目前为止,已有10个编码VGCCs的基因被确定为3个家族:CaV1。(CaV1.1- 1.4对应l型电流),即CaV2。其中包括CaV2.1(对应P/Q电流)、CaV2.2 (n型电流)、CaV2.3 (r型电流)和CaV3。(CaV3.1-3.3对应t型电流)
N型钙离子通道
在寻找止痛药或止痛药的过程中,人们对n型通道(CaV2.2)特别感兴趣。一些证据表明n型Ca2+通道对脊髓疼痛信号的传递至关重要43。使用n型Ca2+通道阻滞剂可阻止神经肽如P物质的释放。这些通道的抑制导致疼痛的抑制。在缺乏编码n型通道42基因的敲除小鼠中,对神经性和炎症性疼痛的敏感性降低。在感觉神经元上表达的CaV2.2通道是吗啡(通过GPCR阿片受体)和其他n型选择性肽阻滞剂的靶点,研究表明,在人类和动物的脊髓内或周围注射时,这些阻滞剂可减轻疼痛44。然而,由于所有n型通道的非选择性封锁,这些肽也可能导致严重的副作用,而不是专门针对那些位于痛觉受体上的通道。最近,发现n型通道的另一种剪接亚型主要表达在一组小的痛觉神经元上44,45。针对这种亚型的药物可能没有副作用,因为它们阻断了特定的通道。尽管有副作用,一些小型的n型通道有机阻滞剂已经在开发中。
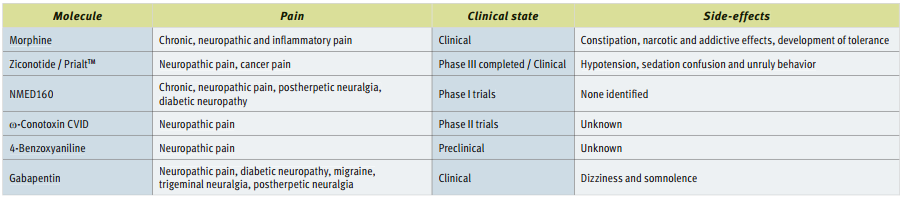
N型钙离子通道阻断剂/拮抗剂
P/Q型钙离子通道
偏头痛的特征是严重的单侧头痛发作,困扰10-15%的人口。Ca2+通道CaV2.1 (P/ q型)的错义突变已被发现是约50%患有家族偏瘫性偏头痛的受测家庭的偏头痛原因。
T型钙离子通道
t型Ca2+通道首次在DRG的外周感觉神经元中被描述,但其功能尚不清楚42。虽然有证据表明t型通道在疼痛处理过程中起作用,但缺乏选择性阻断剂的t型通道使得评估其在神经性疼痛表现中的作用变得困难。
α2δ-1辅助单元
有证据表明辅助亚基α2δ-1在神经痛的处理过程中起着重要作用。实验神经损伤后,DRG中的α2δ-1亚基在mRNA和蛋白水平均上调50。它与加巴喷丁(一种有效治疗临床神经性疼痛的抗惊厥药物)具有高亲和力。加巴喷丁鞘内注射以剂量依赖的方式抑制动物模型的异位痛,对非异位痛大鼠的行为没有任何影响51。由于α2δ-1的上调不伴随着α1亚基的上调,β辅助亚基也不伴随着α1亚基的上调,因此它似乎除了调节VGCCs外,还具有独特的功能作用。

