文献解读:相关多尺度冷冻成像揭示新冠病毒的组装和排出
2023-11-24 来源:本站 点击次数:1150
内容摘要
自SARS-CoV-2大流行爆发以来,对纯化的病毒成分和灭活病毒进行了深入的结构研究。然而,关于SARS-CoV-2感染如何在天然细胞环境中进行的结构和超微结构证据很少,并且缺乏关于SARS-CoV-2复制周期的全面知识。为了将SARS-CoV-2诱导的细胞病变事件与冷冻水合细胞中的病毒复制过程相关联,我们建立了一个独特的多模式、多尺度冷冻相关平台,以对Vero细胞中SARS-CoV-2感染进行成像。该平台将连续低温FIB/SEM体积成像和软X射线低温层析成像与基于细胞薄片的低温电子层析成像(CryoET)和亚同步图平均相结合。在这里,我们报告了关键的SARS-CoV-2结构事件,例如病毒RNA转运入口、病毒组装中间体、病毒出口途径和天然病毒刺突结构,在整个细胞体积的背景下,揭示了剧烈的细胞化学变化。这种综合方法允许从整个细胞到单个分子全面观察SARS-CoV-2感染。
自2019年12月以来,世界一直处于被称为“本世纪最大的流行病”的中期。病原体是严重急性呼吸综合征冠状病毒2(SARS-CoV-2),由此引发的疾病是2019年冠状病毒病。冠状病毒是具有阳性非分段RNA基因组的小型包膜病毒。在RNA病毒中,冠状病毒拥有最大的基因组之一,它们的复制是复杂的,包括移码和复制酶跳跃,产生大量的RNA双链体。冠状病毒和大多数RNA病毒一样,诱导一系列膜室的发育,这些膜室隔离并保护病毒成分,从而提高复制效率和先天免疫识别逃逸。
所有冠状病毒结构蛋白都是由正义亚基因组RNA片段的翻译产生的,正义亚基因RNA片段是由负义亚基因组RNAs片段产生的,而负义亚基因RNAs片段又是由病毒基因组转录时的复制酶跳跃产生的。其中,S蛋白构成病毒刺突,负责细胞附着、进入和融合。它采用两种主要构象:融合前,由亚基S1和S2的三聚体组成;融合后,仅由S2组成的非活性构象。N蛋白负责包裹和保护基因组病毒RNA(vRNA),形成驻留在病毒颗粒内部空间的核糖核蛋白复合物。E蛋白是最小的结构蛋白,被认为是离子通道。最后,M蛋白在SARS-CoV-2中含量最高,是一种跨膜蛋白,分布在病毒脂质膜的内表面。

在这项研究中,我们利用了一种独特的相关多模态多尺度冷冻成像方法来研究在接近自然条件下Vero细胞中SARS-CoV-2的复制。该方法使SARS-CoV-2感染从整个细胞到单个病毒刺突分子的整体观点成为可能,揭示了SARS-CoV-2组装的途径以及SARS-CoV-1感染的出口和细胞病变效应。这些结果证实了之前通过对染色的塑料包埋样品进行薄片电子显微镜(EM)和连续聚焦离子束扫描电子显微镜(FIB/SEM)获得的发现,并进一步扩展了我们对SARS-CoV-2组装和出口以及其在其他膜室中的存在的了解。它验证了连续低温FIB/SEM和软X射线断层扫描作为研究与高分辨率低温电子断层扫描(cryoET)相关的全细胞形态的技术,具有冷冻水合条件和快速直接制备样品的优势。
实验方法
细胞系和病毒
将非洲绿猴肾Vero Cc-81细胞(雌性)(ATCC,Ccl-81)保存在补充有5%胎牛血清、10单位/mL青霉素(Gibco)、10µg/mL链霉素(Gibco)和2mM L-谷氨酰胺的默克高糖培养基(D-MEM)中。细胞系未经验证。SARS-CoV-2分离株Beta CoV/England/02/2020(EPI_ISL_407073)由Maria Zambon教授贮藏,并通过BEI资源、NIAID、NIH:SARS相关冠状病毒2,分离株England/02/2020NR-52359获得。本研究中使用的病毒原液已通过Vero Ccl-81细胞中的菌斑测定进行滴定,并进行测序,以确认通过扩增传代保留了核苷酸呋喃裂解位点(FCS)。
样品制备
Vero Ccl-81细胞(ATCC)保持如上所述。将16000个细胞接种在六孔板孔中经纤维连接蛋白处理的G300F1 R2/2金电镜载网的碳膜侧。使用SARS-CoV-2 England/02/2020的第3代进行感染,MOI为0.5、0.1或0(阴性对照)。从Vero Ccl-81细胞(ATCC)中取出培养基,并用1%胎牛血清、10单位/mL青霉素(Gibco)、10µg/mL链霉素(Gibco)和2 mM L-谷氨酰胺(Gibco)稀释在0.5mL D-MEM高糖培养基(Merck)中的适量病毒替换。将细胞在室温下孵育15分钟,然后向每个孔中再加入1.5mL培养基。然后将平板在37°C下孵育24小时,然后丢弃上清液并用2 mL PBS洗涤细胞。然后通过在PBS中加入3mL 4%多聚甲醛在室温下固定细胞1小时。固定后,将载网放置在徕卡GP2中,将1µl BSA(EMS)中的浓缩10nm金基准点施加到电镜载网的背面,并从背面进行印迹,印迹后将载网浸入液态乙烷中冷冻。玻璃化载网储存在液氮中,直到收集数据。
CryoET数据采集
倾斜系列采集是在FEI Titan Krios G2(Thermo Fisher Scientific)透射电镜上进行的,该电镜可在300kV下操作,并配备了能量过滤器和post-GIF K3探测器。使用SerialEM 3.8版倾斜系列控制器记录倾斜系列,完整细胞的像素大小为1.63、2.13和4.58Å,薄片的像素大小为2.13和7.58Å。零损耗成像用于具有20eV狭缝宽度的所有倾斜系列。散焦值范围为−2至−7µm,但使用50µm散焦的7.58Å像素大小的薄片除外。插入100µm物镜光阑。所有倾斜系列均采用分组剂量对称方案;在+/-60度范围内以3度增量收集完整细胞,每组3个,总剂量为120–135 e/Å2;对于薄片,在+/-54度范围内以3度增量收集,在4.58Å时为每组3个,总剂量为120–135 e/Å2,在7.58 Å时为每组10个,总剂量为70–90 e/Å2。在每次倾斜时进行自动聚焦和跟踪,并以10Å/s的目标速率在倾斜反转时进行漂移测量。在每次倾斜时,在超分辨率模式下使用相关双采样记录5个影片帧,并以lzw压缩tif格式保存,无增益归一化。影片随后在运动校正期间进行增益归一化,并将傅里叶裁剪回物理像素大小。在每个倾斜系列之后,运行脚本以获取新的暗参考并重置散焦偏移。总共收集了294个倾斜序列,其中56个倾斜序列来自未感染的对照细胞(20个来自细胞薄片,36个来自细胞外周),238个倾斜序列源自SARS-CoV-2感染的细胞(90个来自薄片,148个来自细胞外周)。
CryoFIB薄片制备
SARS-Cov-2感染细胞的薄片铣切是使用配备有PP3010冷冻传输系统(Quorum Technologies)的Scios DualBeam CryoFIB(ThermoFisher Scientific)和使用xT v7.6软件(ThermoFisher Scientific)进行的。在PP3010制备腔室内保持−175°C冷台上对载网进行溅射镀膜。在传输转载到Scios腔室内−168°C冷台后,使用SEM(在5kV和13pA下操作)检查载网,并鉴定出与透射电子显微镜(TEM)相关的感染细胞。使用气体注入系统[三甲基(甲基环戊二烯基)铂(IV),ThermoFisher Scientific]涂覆载网表面3秒,形成厚度约为3µm的铂保护层。使用在30kV下操作的离子束和从300到30pA递减的电流进行铣切。在30pA下,薄片厚度小于300nm。在铣切的最后阶段,在2kV和13pA下对薄片进行SEM检查。
系列CryoFIB/SEM体积成像
样品在配备有Quorum PP3010冷冻制备传输系统的Zeiss Crossbeam 550XL双束电镜上成像。将它们装在定制样品架上,并在Quoum冷冻制备腔室的冷台上以10mA电流溅射镀铂60秒,然后传输转移至电镜冷台。电镜冷台温度设置为−165°C,同时防污染冷阱保持在−185°C。在Pt气体储存保持在25°C的前提下,使用FIB-SEM的内部GIS系统,再次用Pt涂覆2×30 s后,然后以45°倾斜对样品进行成像。在30 kV、7 nA、15μm宽度条件下铣切出初始梯形沟槽,最终深度为10μm,以30 kV和1.5 nA条件对深度为10μm的矩形面进行精铣。连续切片和图像采集如下:使用30 kV、700 pA探针电流设置FIB铣切,z切片步进为20 nm,贯穿深度为10µm的整个研磨面;SEM成像是在3024×2304像素数量下进行,这导致像素尺寸为6.5nm,电子束设置为2kV,35pA,束驻留时间100ns,扫描速度1,将100行扫描上的信号平均化作为降噪策略。使用的软件版本为Zeiss SmartSEM v6.06和Zeiss SmartFIB v1.11.10。



CryoET image processing,Subtomogram averaging,
Soft X-ray cryo-tomography,Quantification and statistical analyses and so on
(限于篇幅从略,仅呈现数据图表)
结论
SARS-CoV-2复制在宿主细胞中诱导深刻的细胞病变效应。为了在接近生理条件下对细胞内体系中SARS-CoV-2的复制进行成像和研究,我们用SARS-CoV-2以0.1和0.5倍感染率(MOI)去感染在编码的电镜载网上生长的Vero细胞。在感染后24小时(hpi),将细胞用4%多聚甲醛固定并浸入液体乙烷中冷冻。如工作流程所示(补充图1),首先在Titan Krios中对含有SARS-CoV-2感染细胞的电镜载网进行成像,以通过检测细胞外围的大量病毒颗粒来识别感染细胞(MOI为0.1时为39.2%,MOI为0.5时为45.4%)。Vero细胞中SARS-CoV-2复制动力学小于24小时。因此,我们的样本可能包含不同复制周期阶段的感染细胞混合物。在感染细胞的外围收集CryoET倾斜系列。然后将载网转移到FIB/SEM双束电镜上,用连续冷冻FIB/SEM体积成像法对相同的感染细胞进行成像,或冷冻FIB铣切目标区域的细胞薄片,以便收集额外的cryoET倾斜系列。同时,我们通过软X射线冷冻断层扫描对其他感染细胞进行了成像。受感染和未受感染细胞的定量和相关数据集,以及不同观察结果的定量分析,在补充表1中予以总结。这些成像模式在不同长度尺度上提供了必要的结构和超微结构信息,以便在其细胞环境中可视化感染病毒,并且具有高度互补性。事实上,这种独特的方法能够以多模式、多尺度和相关的方式直接可视化SARS-CoV-2复制和细胞病变效应。
与未感染细胞相比(补充图2和补充影片1),五个SARS-CoV-2感染细胞的连续冷冻FIB/SEM全细胞成像显示了广泛的细胞病理学改变,如图1和补充影片2-6所示。在细胞外围,有许多电子致密颗粒,其大小与SARS-CoV-2病毒一致(图1A,黑色箭头)。观察到许多膜隧道状结构从细胞膜向细胞质深入细胞,含有病毒样颗粒(图1A,“T”和补充影片2)。这些隧道状结构类似于在HIV-1感染的巨噬细胞中观察到的结构,病毒通过这些结构离开感染的细胞。此外,在与细胞膜不相连的细胞内小泡中也发现了电子密集的病毒样颗粒(图1A,红色箭头)。在细胞深处,我们发现大部分细胞质(图1B),尤其是核周区域(图1C)被大量小泡“V”占据(补充影片2-5)。SARS-CoV-2感染细胞和未感染细胞中的核孔清晰可辨(图1C和补充图2A,C,蓝色箭头)。我们在感染的细胞中观察到电子致密的复合膜室(图1B,粉红色箭头)。先前已经观察到类似的结构,并将其描述为在染色的塑料包埋细胞的薄切片中的大型含病毒囊泡(LVCV)。与对照细胞相比,在感染细胞中观察到的一个更显著的特征是细胞核的细胞病变损伤,在极端情况下,近一半的细胞核被内陷的细胞质占据(图1D,补充影片6和补充图3G)。在SARS-CoV-2感染的肺细胞和肠细胞的染色塑料切片的电镜观察中也注意到这种细胞质内陷,这表明SARS-CoV-2感染具有强烈的细胞病变效应。
利用软X射线冷冻断层扫描提供的高通量全细胞成像能力,我们分析了5个感染细胞,这些细胞通过冷冻ET成像在细胞外围识别并确认SARS-CoV-2感染,另外还有12个来自对照网格的未感染细胞。在整个细胞水平上,软X射线图像显示了线粒体的实质性变化,因为在未感染细胞的整个细胞质中存在长管状线粒体(补充图3A,C,黄色箭头),在感染细胞中很少见到(补充图3B,D)。我们观察到SARS-CoV-2感染细胞中线粒体的数量显著减少(SARS-CoV感染细胞中每断层图像15.4±10.2,对照细胞中91.3±32,p=0.0001;补充图4A)。这与先前描述SARS-CoV-2感染肺细胞导致线粒体网络改变的研究结果一致。对三个感染细胞和两个未感染细胞的人工分割的全细胞冷冻FIB/SEM体积的测量表明,SARS-CoV-2感染细胞中线粒体的长度明显短于对照细胞(SARS-CoV-2感染细胞的线粒体长度为0.60±0.70μm,对照细胞为0.90±1.14μm;p=0.0012;补充图4B),线粒体体积没有显著减少(SARS-CoV-2感染的细胞为0.058±0.196μm3,对照细胞为0.141±0.763μm3,p=0.113;补充图4C),表明线粒体形态发生了变化。我们还在核周区域观察到许多小泡(补充图3F),其大小与感染细胞中的DMV和细胞质内陷(补充图3G)一致。总之,这些冷冻成像结果证实并扩展了先前与SARS-CoV-2感染相关的细胞病理学改变的发现。
讨论
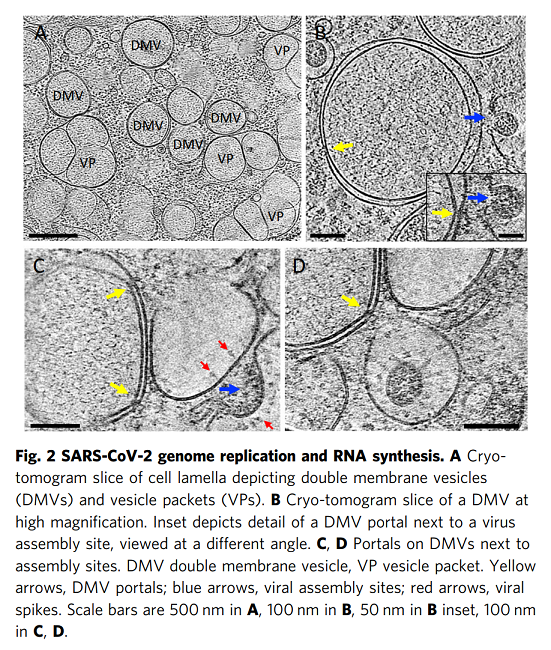
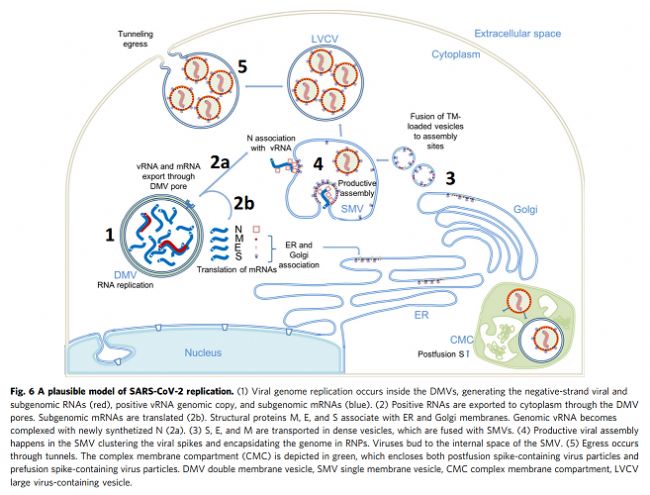
我们使用相关方法对近天然玻璃化细胞中SARS-CoV-2感染进行成像,包括从整个细胞水平到亚细胞和分子水平的多个空间尺度。这种方法产生了感染过程的整体视图,描述了病毒诱导的细胞病变及其与原位结构的相关性。至关重要的是,通过该工作流实现的多尺度成像数据的整合(补充图1)使我们能够在感染细胞的细胞病变后果的背景下直接可视化SARS-CoV-2复制的结构事件。鉴于先前研究中对SARS-CoV-2和其他冠状病毒的先验知识,这些图像使我们提出了SARS-CoV-2复制的增强模型,特别是病毒基因组复制、组装和出口,如下所述。SARS-CoV-2复制过程的图像显示,它是一个空间组织良好且高效的过程。从基因组复制到蛋白质合成和运输,再到病毒组装和出芽,每一步都发生在特定目的的紧密联系的细胞质隔间中。如图6所示,RNA复制,包括基因组vRNA和亚基因组mRNA,发生在DMV中,将其从宿主细胞固有免疫应答中分离出来(步骤1)。然后,新合成的vRNA通过跨膜入口从DMV运输到这些DMV附近的病毒组装位点(步骤2a),而mRNA通过相同的入口排出到细胞质,随后转移到ER/Golgi以产生蛋白质(步骤2b)。在ER/Golgi网络中产生的三聚体预融合形式的病毒尖峰通过小的运输囊泡运输到组装位点(步骤3)。这些囊泡与SMV膜融合,其中在存在vRNA和N蛋白的情况下,病毒尖峰聚集在组装位点,导致正的膜弯曲,并最终将病毒粒子萌发到SMV中(步骤4)。组装和出芽过程产生含有病毒的囊泡,囊泡可以含有多种病毒颗粒。然后,病毒颗粒可以通过通道排出,可能通过溶酶体胞吐(步骤5)。该模型的某些方面仍然是推测性的,需要在未来的研究中进行进一步的实验验证。
对SARS-CoV-2病毒在细胞内传播过程中的基因组复制、组装和排出过程进行多尺度观察,对于促进我们对这种病原体的理解至关重要,因为它具有阐明新信息和激发医学干预以阻止生产性感染的手段。这一过程的许多方面有待进一步研究,以剖析SARS-CoV-2复制的分子机制,包括其他病毒蛋白(如M和E)以及宿主蛋白和核心机构的作用。这项研究提供了SARS-CoV-2复制周期在接近自然条件下的直接观察,以及直接来自细胞组装和细胞外释放的病毒颗粒的融合前尖峰的结构。通过这项研究开发的独特方法和工作流程可广泛应用于SARS-CoV-2以外的其他人类病原体感染过程的研究。
科学家团队简介


