细胞核分离试剂盒的应用:探索人脊髓胶质细胞异质性
2024-08-30 来源:本站 点击次数:956
影响因子:5.07
伯豪生物产品:伯优®细胞核分离试剂盒
研究背景
尽管有大量证据表明脊髓的神经胶质细胞在感觉感知和处理以及运动行为中起着关键作用,但其细胞、功能和空间分布的异质性在很大程度上仍不清楚。来自单细胞和单细胞核RNA测序(scRNA-seq和snRNA-seq)研究的新兴数据揭示了中枢神经系统(CNS)特定神经胶质细胞类型之间的细胞和分子异质性。Zheng等人过scRNA-seq比较了大脑皮层和脊髓的小胶质细胞亚型,在大脑皮层中发现了三个亚群,在脊髓中发现了两个亚群,并显示了脊髓和皮层小胶质细胞之间的不同亚群。Floriddia等人也使用scRNA-seq将小鼠CNS中的成熟少突胶质细胞分为六个不同的亚群,这些亚群对脊髓损伤表现出不同的反应。虽然对小鼠CNS中神经胶质细胞的细胞和功能异质性已有相对较好的了解,但技术障碍和高质量组织样本获取受限限制了人类脊髓研究方面的此类进展。
研究目的
通过空间转录组学和snRNA-seq来绘制人类脊髓中神经胶质细胞的异质性。并通过比较人类和小鼠的转录组谱来探讨种间异质性。通过本研究的探索和验证人类脊髓神经胶质细胞的功能和空间分布,有望成为未来研究神经胶质细胞相关人类生理和病理条件分子基础的重要资源。
伯豪产品
伯优®细胞核分离试剂盒
研究结果
1. 神经胶质细胞亚型的鉴定
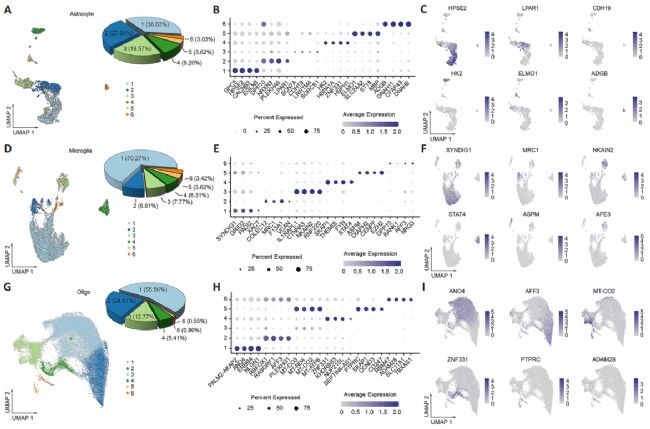
为了实现单细胞分辨率,本研究对来自9名成人腰椎膨大区域的脊髓中分离出的64,021个细胞核进行了单细胞核RNA测序(snRNA-seq)。根据这些数据,我们确定了八种主要细胞类型,它们具有独特的分子标记物。星形胶质细胞(占总细胞核的5.2%)通过表达代表性标记物AQP4、ATP1A2和SLC1A2进行鉴定;小胶质细胞(占总细胞核的13.1%)通过PTPRC、CTSS和ITGAM进行鉴定;少突胶质细胞(占总细胞核的58.8%)则通过MBP、MOBP、MOG和PLP1进行鉴定。
后续又通过空间转录组数据探索了这三种神经胶质细胞类型的空间位置。数据表明,星形胶质细胞在脊髓中广泛存在,但在白质中的表达高于灰质。这一发现通过免疫荧光染色得到了验证。小胶质细胞和少突胶质细胞则主要分布在白质中。

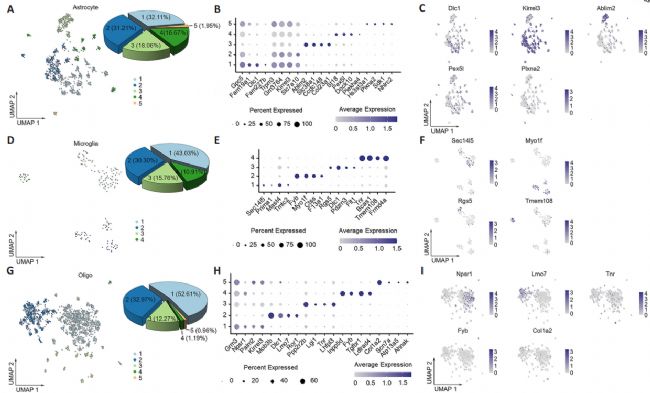
为了确定人类脊髓中每种神经胶质细胞类型内的异质性,根据它们的转录特征,将星形胶质细胞、小胶质细胞和少突胶质细胞各自分类为六个亚群。在小鼠脊髓中,基于先前的研究结果,星形胶质细胞、小胶质细胞和少突胶质细胞分别被分类为五个、四个和五个亚群。通过进一步分析每个亚群中独特高表达的代表性标记基因,最终鉴定出与躯体感觉系统障碍相关的几种标记基因。这些包括:人类星形胶质细胞亚群1(C1)中的CACNB2(钙电压门控通道辅助亚基β2);人类星形胶质细胞亚群3(C3)和小鼠少突胶质细胞亚群5(C5)中的SCN7A(钠电压门控通道α亚基7);人类小胶质细胞亚群1(C1)中的GRID2(谷氨酸离子型受体δ型亚基2);小鼠小胶质细胞亚群2(C2)中的Ctss(组织蛋白酶S);以及小鼠少突胶质细胞亚群1(C1)中的Grm3(代谢型谷氨酸受体3)。
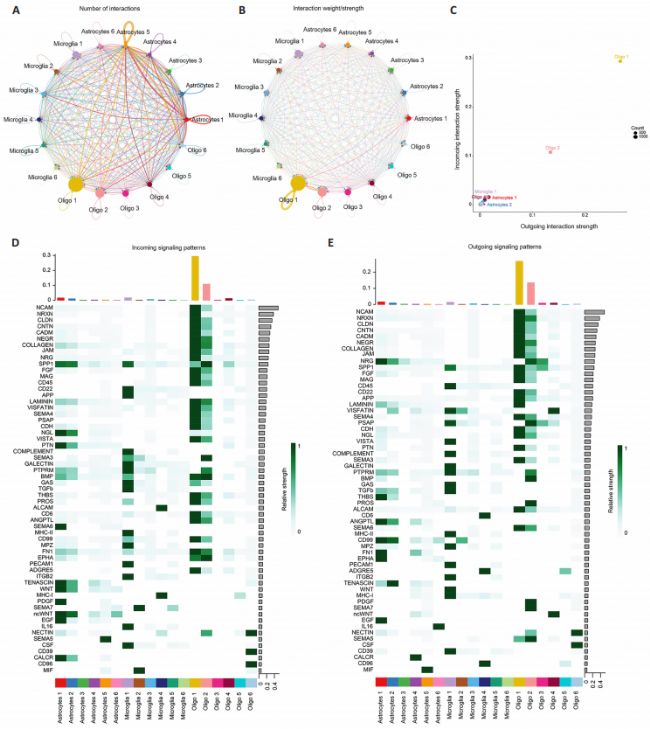
2. 神经胶质亚型的细胞间通讯分析和RNA速度分析
为了探究不同亚型星形胶质细胞、小胶质细胞和少突胶质细胞之间的相互作用,研究又分析了相互作用的强度和数量。发现所有亚型的神经胶质细胞均存在关联,其中星形胶质细胞C1和C5之间联系尤为紧密。接下来,我们比较了每种细胞类型的传出和传入相互作用强度。不同亚型的脊髓神经胶质细胞参与的信号通路在活跃程度上存在显著差异。一些神经胶质细胞亚型表现出重叠的信号通路,如小胶质细胞C1和少突胶质细胞C1及C2。
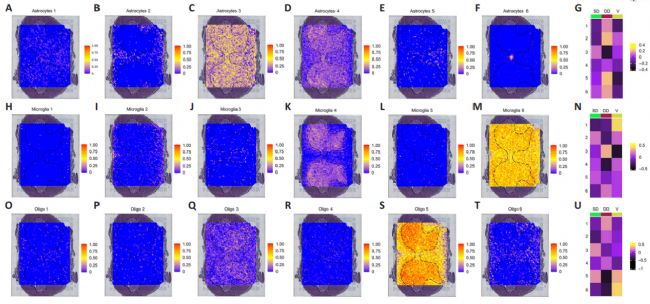
3. 神经胶质细胞亚型的空间可视化
接下来,研究利用空间转录组数据探索了神经胶质亚型的空间位置。从最具代表性的腰椎膨大节段中选择空间转录组数据,并用每个样本的相应节段进行分析,最终确定了五种主要的细胞亚型。利用SpaCET软件,将每个样本的snRNA-seq数据与相应的空间切片相结合,以表征神经胶质亚型的分布模式。为了更详细地分析不同神经胶质亚型的空间分布,研究将人类脊髓灰质分为三个区域:浅背角(板层I-II)、深背角(板层III-VI)和腹角(板层VII-IX)(Todd, 2010)。小胶质细胞C2和C5,以及少突胶质细胞C3和C5,主要分布在浅背角;星形胶质细胞C2、C5和C6,小胶质细胞C3和C6,以及少突胶质细胞C1、C2和C4,则出现在深背角;而小胶质细胞C1和少突胶质细胞C6则位于腹角。
4. 人与鼠的神经胶质细胞亚型异质性
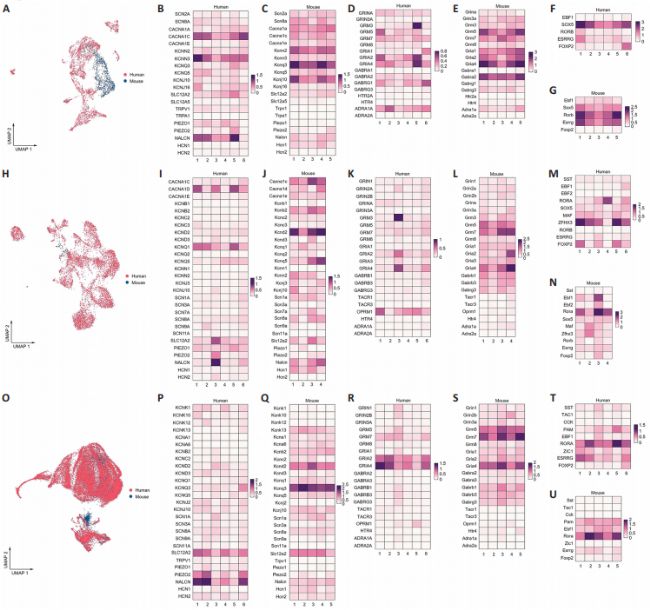
在UMAP分析中,人类脊髓的整体胶质细胞数据与小鼠的数据重叠良好。然而,按细胞类型细分数据后,发现小鼠和人类在所有类型的胶质细胞(包括星形胶质细胞、小胶质细胞和少突胶质细胞)中都存在显著的异质性。为了更深入地了解人类和小鼠之间经典脊髓标志物的保守性和差异性,后续分析了这些标志物在两种物种中的表达谱。这些标志物包括众所周知的离子通道、神经递质受体、神经肽和转录因子。
首先,研究分析了胶质细胞亚群之间多个基因表达的差异。在星形胶质细胞、小胶质细胞和少突胶质细胞中,多个基因的表达水平在亚群之间显示出显著的异质性。这些基因包括NALCN、Kcnj10、GRM3、Gria2、SOX5、CACNA1D、RORA和KCND2。
接下来,研究还比较了人类和小鼠胶质细胞中这些标志物基因的转录组数据。总体而言,转录模式在人类和小鼠之间存在显著差异。在人类脊髓的星形胶质细胞中,CACNA1C的表达显著高于CACNA1E和CACNA1A;而在小鼠脊髓的星形胶质细胞中,这些基因的表达没有显著差异。在人类脊髓星形胶质细胞中,GRINA的表达高于GRIN3A,而在小鼠脊髓星形胶质细胞中则相反。在人类脊髓星形胶质细胞中,SOX5的表达高于RORB和ESRRG,而在小鼠脊髓星形胶质细胞中,它们的表达水平相当。在人类脊髓小胶质细胞中,KCND2和KCND3的表达水平相当,而在小鼠脊髓小胶质细胞中,Kcnd2的表达水平高于Kcnd3。在人类脊髓小胶质细胞中,OPRM1的表达高于HTR4;而在小鼠脊髓小胶质细胞中,两者表达无显著差异。在人类脊髓小胶质细胞中,ZFHX3的表达高于RORA,而在小鼠脊髓小胶质细胞中则相反。在小鼠脊髓少突胶质细胞中,Kcnq3的表达高于Kcnq1;而在人类脊髓少突胶质细胞中,它们的表达相似。
5. 神经胶质细胞中与疾病相关的基因
首先,本研究探索了两种慢性疼痛(神经病理性和炎症性)相关的基因表达模式。在星形胶质细胞中,常见的神经病理性/炎症性疼痛基因RNF19A/Rnf19a在人类中高表达,但在小鼠中不表达,而GRM5/Grm5在小鼠中高表达,但在人类中仅略有表达。与神经病理性疼痛相关的基因HMGB1/Hmgb1和DPYSL2/Dpysl2在人类星形胶质细胞中高表达,但在小鼠中仅略有表达。DNMT3A/Dnmt3a在小鼠星形胶质细胞中高表达,但在人类中仅略有表达。然而,与炎症性疼痛相关的基因PRKCA/Prkca在人类和小鼠星形胶质细胞中均表现出高表达水平。
在小胶质细胞中,GRM5/Grm5在小鼠中高表达,但在人类中仅略有表达。与神经病理性疼痛相关的基因HMGB1/Hmgb1、MAPK14/Mapk14、PIK3CB/Pik3cb和CRK/Crk在人类中高表达,但在小鼠中仅略有表达。与炎症性疼痛相关的基因P2RX4/P2rx4在人类中高表达,但在小鼠中仅略有表达。在少突胶质细胞中,GRM5/Grm5在小鼠中高表达,但在人类中仅略有表达。GRAP2/Grap2在人类C5中高表达,但在小鼠中仅略有表达。与小胶质细胞和星形胶质细胞一样,PRKCA/Prkca在人类和小鼠少突胶质细胞中均表现出高表达。

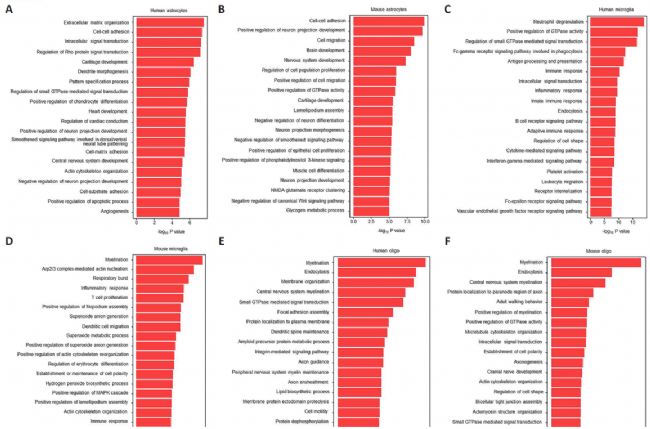
6. 神经胶质细胞簇的功能分配
为了探索每种胶质细胞中富集基因的功能特性,进行了GO术语分析,结果揭示了人类和小鼠之间几个共同的生物过程。人类和小鼠星形胶质细胞中的富集基因主要与神经系统发育有关,包括细胞-细胞粘附、细胞外基质组织、树突形态发生、神经元投射发育的调节、神经系统发育和细胞迁移。在人类和小鼠的小胶质细胞中,富集基因主要与免疫反应有关,包括抗原加工和呈递、免疫反应、炎症反应、先天免疫反应、T细胞增殖以及参与炎症反应的白三烯产生。在人类和小鼠的少突胶质细胞中,富集基因主要与髓鞘形成有关,包括髓鞘形成、轴突导向、轴突包绕、髓鞘形成的调节和轴突发生。
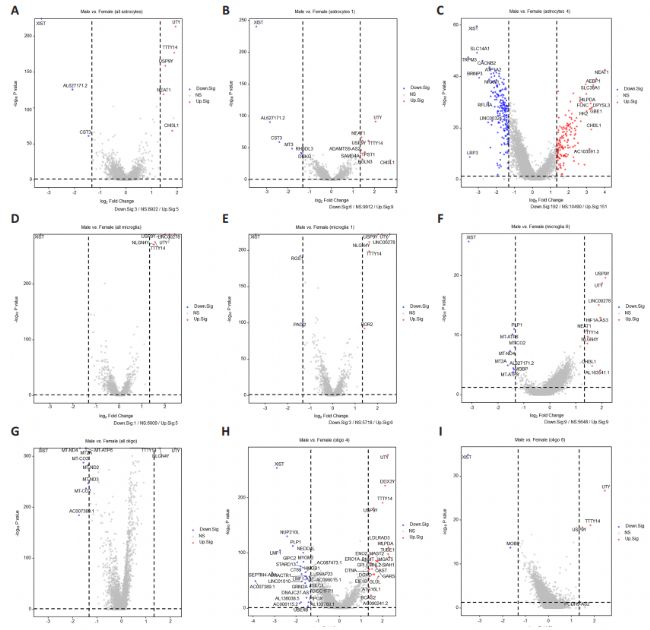
7. 人类脊髓胶质细胞基因表达的性别差异
通过对男性和女性人类不同脊髓胶质亚群中的基因表达模式进行比较,发现当FC(倍数变化)≥1.33且调整后的P值<0.05时,将基因分类为差异表达。值得注意的是,星形胶质细胞、小胶质细胞和少突胶质细胞中基因表达的最大差异与参与X染色体失活的性别特异性基因(如XIST)和Y染色体基因(包括UTY、USP9Y、TTTY14和NLGN4Y)有关,这为我们结果的可靠性提供了有力支持。
在人类脊髓的所有星形胶质细胞群中,与女性相比,男性NEAT1和CHI3L1的表达水平较高,而CST3的表达水平较低。值得注意的是,与女性相比,男性在星形胶质细胞C5中的NEAT1和在C2及C5中的CHI3L1表达水平也较低。在星形胶质细胞C1中,与女性相比,男性MT3的表达水平较高,而NEAT1、EGLN3和CHI3L1的表达水平较低。在星形胶质细胞C4中,与女性相比,男性SLC14A1、TRPM3和CACNB2的表达水平较高,而SLC38A1、Dpysl3和NEAT1的表达水平较低。
在人类脊髓的所有小胶质细胞群中,所有差异表达基因(DEGs)均位于X染色体和Y染色体上。在小胶质细胞C1中,与女性相比,男性ROR2的表达水平较低。在小胶质细胞C6中,与女性相比,男性MT-ATP6的表达水平较高,而CHI3L1的表达水平较低。
在人类脊髓的所有少突胶质细胞群中,与男性相比,女性MT-ND4、MT2A、MT-ATP6、MT-CO3、MT-ND2、MT-ND3和MT-CO2的表达水平较高。在少突胶质细胞C4中,与男性相比,女性PLP1和HMGB1的表达水平较高,而SIAH1的表达水平较低。在少突胶质细胞C6中,女性MOBP的表达水平高于男性。
研究总结
本研究利用(snRNA-seq)和空间转录组学技术,绘制了人类脊髓中星形胶质细胞、小胶质细胞和少突胶质细胞的细胞及分子异质性图谱。结果显示,星形胶质细胞、小胶质细胞和少突胶质细胞各自被分为6个不同的转录组亚群,揭示了人类和小鼠脊髓神经胶质细胞类型中存在显著的物种间异质性。此外,研究还检测到人类脊髓神经胶质细胞中的性别特异性基因表达差异。这些发现为脊髓相关疾病的研究提供了重要资源。
参考文献:
https://doi.org/10.7554/eLife.92046

