用户文章 : 鉴定不同发酵时间的羊乳开菲尔中潜在的生物活性肽
2024-12-31 来源:本站 点击次数:1416
羊奶营养价值高,富含蛋白质、钙、维生素A和B,且易消化,脂肪含量高,特别适合生产奶酪及其他乳制品。发酵乳制品(包括开菲尔)含有丰富的生物活性肽,这些肽由天然蛋白质释放而来,对健康有益[1,2],如抗菌、降胆固醇、预防肥胖、控制血糖、抗高血压、免疫系统调节、抗氧化活性、抗癌和抗过敏[3,4,5],具有重要的科学、医学和商业价值[6]。据报道,绵羊奶和山羊奶富含诸多生物功能多肽,主要来源于 α-、β-和 κ-酪蛋白[7]。虽然奶源本身就含有很多生物活性肽,但在开菲尔发酵过程中微生物蛋白酶又进一步增加了其他活性肽的数量。开菲尔菌种加入到乳源后通常需要发酵12至48小时,据悉尚未有文献报道过羊奶开菲尔发酵乳中的多肽成分。
来自科尔多瓦大学生物与生物学分子系的Manuel J. Rodríguez-Ortega教授团队在“Identification of Potential Bioactive Peptides in Sheep Milk Kefir through Peptidomic Analysis at Different Fermentation Times”研究中对不同时间段的发酵产物进行了全面的多肽组分析,探究由于微生物蛋白酶水解而产生的多肽序列,并筛选了78条潜在的生物活性肽。该研究是首次通过蛋白质组学技术来表征羊奶开菲尔发酵乳中生物活性肽的研究,加强了对该产品的潜在益处的认识。
开菲尔菌发酵过程中不同物质成分的变化
表1显示了开菲尔发酵0-48h不同时间段的pH值、乳酸、乙醇、乳糖和 D-半乳糖浓度以及蛋白水解活性的变化。非发酵羊奶的pH值接近中性值(6.67),随着发酵的进行pH值逐渐变酸,发酵48小时后达到3.80。乳酸浓度在发酵12小时后增加了13倍,在12小时后(24小时)增加了一倍,此后乳酸浓度变化不大。非发酵乳中乙醇含量约为0.01%,发酵12小时后乙醇含量增加了8倍多,并且随着发酵的进行而持续增加,发酵48小时后,乙醇含量为2.8 g/L,相当于乙醇含量接近0.3%。D-半乳糖的含量趋势与乳酸非常相似,发酵12小时后,浓度增加了约12倍,发酵24小时后增加了17倍,在36小时达到峰值。然而,在发酵过程中乳糖的含量略有下降,但不明显。作者还用OPA法测定了蛋白水解活性,以确定微生物蛋白酶的活性变化。与未发酵乳相比,发酵12小时后蛋白水解活性增加了一倍,在24和36小时又增加了20%,在48小时后达到最大值,与未发酵乳相比增加了约 3.6 倍。
表1 不同组份随发酵时间的变化

羊奶开菲尔发酵过程的多肽组学分析
作者通过microLC–timsTOF Pro-MS/MS结合PEAKS Studio和PEAKS Online分析了用开菲尔菌发酵12、24、36 和 48 小时和对照组未发酵羊奶的多肽组变化,共鉴定到来源于11种不同蛋白质的1942条肽段(图1A),其中约91.7%的1780个肽段属于羊奶中的四种酪蛋白(αs1、αs2、β和κ),此外还发现了另外七种至少鉴定到3条肽段的蛋白。然后,作者对比了高度相似的绵羊和山羊蛋白质发酵多肽产物,发现开菲尔菌针对不同物种的同一种蛋白质的水解机制是不同的。
图1B显示了每个样品中鉴定出的多肽的总数及其与11种蛋白质的对应关系。12小时开菲尔发酵产物与对照组之间差异不大(878 vs 864)。微生物水解羊奶蛋白产生的多肽总数在发酵24小时后开始增加,48小时后达到1185,比未发酵样品增加了35%。与对照组相比,发酵48小时后β-酪蛋白肽增加了19%(从434增加到 516),αs1-酪蛋白肽增加了35%(从155增加到210),αs2-酪蛋白增加了47%(从137增加到202),κ-酪蛋白增加了133%(从79增加到184),血清淀粉样蛋白A增加了59%(从22增加到35)。然而,β-乳球蛋白和骨桥蛋白在发酵样品中的肽数量均低于非发酵乳。对照组中没有鉴定到α-乳清蛋白肽,但发酵36和48小时后检测到。血清白蛋白肽只在非发酵乳中发现,纤维蛋白原α链以及β-2-微球蛋白肽则在对照组和部分发酵乳中发现。不过,不能排除这些低丰度肽未检测到是收到其高丰度蛋白的影响。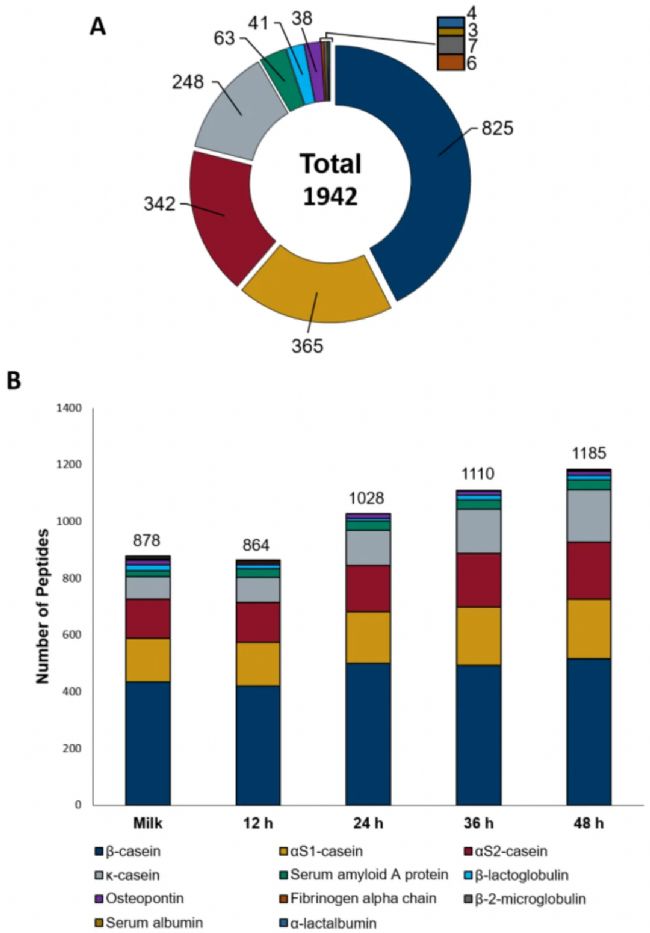
 图2 多肽随着发酵时间的变化
图2 多肽随着发酵时间的变化
微生物蛋白酶对羊乳蛋白的水解机制
作者将鉴定到的多肽与羊奶中主要的四个酪蛋白(β、αS1、αS2和κ)序列进行比对,以观察开菲尔菌对乳蛋白的水解模式。从图3可以看出,不同蛋白的消化模式并不统一。β-酪蛋白水解程度最高,其中Q34-F52、T78-F119、L 139-S161三个区域产生的多肽随着发酵时间的延长而增加。V162-F188之间的区域释放的多肽数量差异不大。此外,与非发酵乳相比,发酵产物在E2-K28、Q56-P76和P194-P204区域鉴定到的多肽数量略有减少。对于αs1-酪蛋白,随着发酵时间的延长,R22-N36和I37-M60两个连续区域释放的多肽数量明显增多。发酵0h和12h的样品中K124-Q172区域内未检测到任何多肽,发酵24h后该区域释放的多肽数量略有增加,G63-K79区域释放的多肽数量随发酵进行而减少。对于αs2-酪蛋白而言,N84-P119和T152-N200两个区域释放的多肽数量随着发酵而增加,而E9-E24和Q128-K151两个区域则减少。对于κ-酪蛋白,F18-L74和A96-K116之间的区域随着发酵进行,多肽释放量显著增加。相反,在S127-N143之间多肽释放量减少。此外,在A144-C末端之间,在未发酵乳中检测到的肽数量高于在发酵12小时的乳中检测到的肽数量。从这些结果得出的一般结论是,随着发酵的进行,羊奶中主要酪蛋白多肽的水解模式有显著差异,但不同蛋白受到的影响程度并不相同,从而显示出对微生物蛋白酶作用的敏感程度不同。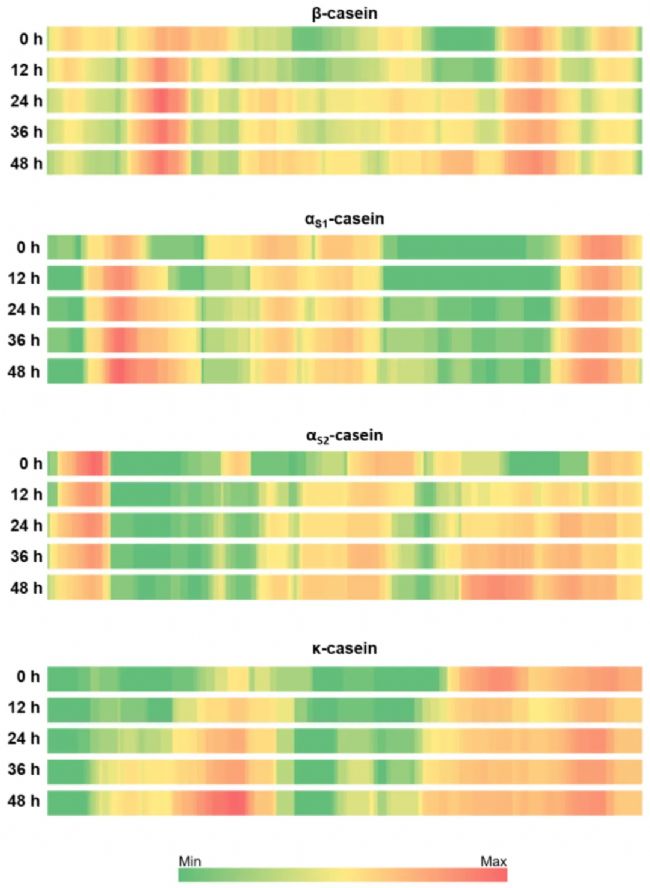 图3 开菲尔菌对羊奶的β、αS1、αS2和κ酪蛋白水解序列的覆盖度
图3 开菲尔菌对羊奶的β、αS1、αS2和κ酪蛋白水解序列的覆盖度
筛选潜在的生物活性肽
随后,作者在9个在线活性肽数据库中搜索了本次质谱实验所鉴定的羊奶开菲尔肽,并仅保留与数据库中100%同源的活性多肽,结果共筛选出78 条潜在活性肽(表2),这些多肽都来源于四种主要酪蛋白。据相关报道,这些潜在生物活性肽大部分仅具有ACE抑制活性,但其中一些还具抗菌、抗炎或免疫调节等功能,五种肽具有抗氧化活性,一种肽具有抗血栓活性,另一种肽具有抗菌活性。在 78种生物肽中,有7种已在牛奶开菲尔发酵乳中被报道过[8,9],12种与之前在山羊奶开菲尔发酵乳中发现的肽完全一致[10,11,12]。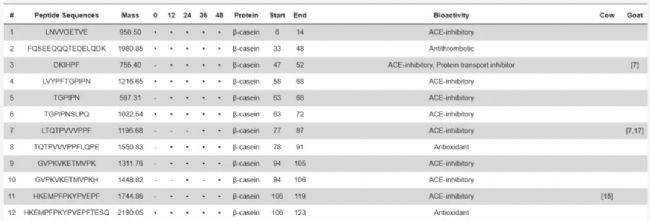
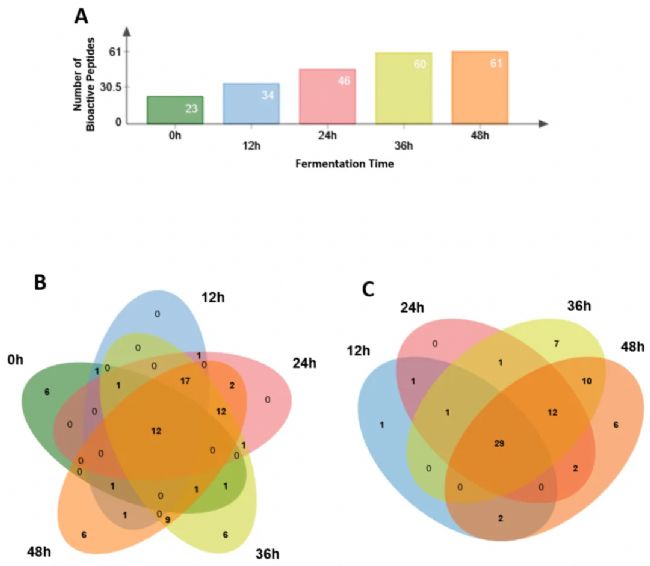
随着发酵时间的延长,开菲尔发酵产物中鉴定出的活性肽数量明显增加(图4A)。在未发酵乳样品中鉴定出23种活性肽,而在发酵48小时后,增加到61种肽。在所有样品中共检测到12种肽(图4B),仅在对照36或48小时样品中检测到6种不同的肽,而有29条活性肽在所有发酵样品中均被检测到(图4C)。
小结
作者鉴定了开菲尔菌对11种乳蛋白水解释放的近2000种肽,其中大多数肽来自四种主要乳酪蛋白,占总乳蛋白丰度的80%左右[13,14],β-酪蛋白的水解肽数量最多。筛选出的78 种活性肽中,有55种在对照组中不存在,表明这些多肽是在发酵过程中因微生物蛋白酶的特殊作用而出现的,且对人体健康有益。该研究首次对不同发酵时间收集的羊奶开菲尔乳的多肽组进行全面分析,该分析有助于了解随着发酵过程的推进,羊奶蛋白质消化模式和多肽成分的变化。在发酵过程中会出现具有多种生物学特性的生物活性肽,这些活性肽随时间而变化,时间越长,含量越高。但仍需进一步研究以了解这些活性肽是否以及如何在体内保持活性,尤其是在胃肠消化后。
原文链接:https://www.mdpi.com/2304-8158/12/15/2974
参考文献
1.Azizi, N.F.; Kumar, M.R.; Yeap, S.K.; Abdullah, J.O.; Khalid, M.; Omar, A.R.; Osman, M.A.; Mortadza, S.A.S.; Alitheen, N.B. Kefir and Its Biological Activities. Foods 2021, 10, 1210.
2. Chourasia, R.; Chiring Phukon, L.; Abedin, M.M.; Padhi, S.; Singh, S.P.; Rai, A.K. Bioactive Peptides in Fermented Foods and Their Application: A Critical Review. Syst. Microbiol. Biomanuf. 2023, 3, 88–109.
3.Miao, J.; Guo, H.; Chen, F.; Zhao, L.; He, L.; Ou, Y.; Huang, M.; Zhang, Y.; Guo, B.; Cao, Y.; et al. Antibacterial Effects of a Cell-Penetrating Peptide Isolated from Kefir. J. Agric. Food Chem. 2016, 64, 3234–3242.
4. de Lima, M.D.S.F.; da Silva, R.A.; da Silva, M.F.; da Silva, P.A.B.; Costa, R.M.P.B.; Teixeira, J.A.C.; Porto, A.L.F.; Cavalcanti, M.T.H. Brazilian Kefir-Fermented Sheep’s Milk, a Source of Antimicrobial and Antioxidant Peptides. Probiotics Antimicrob. Proteins 2018, 10, 446–455.
5.Vieira, C.P.; Rosario, A.I.L.S.; Lelis, C.A.; Rekowsky, B.S.S.; Carvalho, A.P.A.; Rosário, D.K.A.; Elias, T.A.; Costa, M.P.; Foguel, D.; Conte-Junior, C.A. Bioactive Compounds from Kefir and Their Potential Benefits on Health: A Systematic Review and Meta-Analysis. Oxidative Med. Cell. Longev. 2021, 2021, 9081738.
6. Mudgil, P.; Gan, C.-Y.; Affan Baig, M.; Hamdi, M.; Mohteshamuddin, K.; Aguilar-Toalá, J.E.; Vidal-Limon, A.M.; Liceaga, A.M.; Maqsood, S. In-Depth Peptidomic Profile and Molecular Simulation Studies on ACE-Inhibitory Peptides Derived from Probiotic Fermented Milk of Different Farm Animals. Food Res. Int. 2023, 168, 112706.
7.Tomazou, M.; Oulas, A.; Anagnostopoulos, A.K.; Tsangaris, G.T.; Spyrou, G.M. In Silico Identification of Antimicrobial Peptides in the Proteomes of Goat and Sheep Milk and Feta Cheese. Proteomes 2019, 7, 32.
8.Ebner, J.; Aşçı Arslan, A.; Fedorova, M.; Hoffmann, R.; Küçükçetin, A.; Pischetsrieder, M. Peptide Profiling of Bovine Kefir Reveals 236 Unique Peptides Released from Caseins during Its Production by Starter Culture or Kefir Grains. J. Proteom. 2015, 117, 41–57.
9. Liu, Y.; Pischetsrieder, M. Identification and Relative Quantification of Bioactive Peptides Sequentially Released during Simulated Gastrointestinal Digestion of Commercial Kefir. J. Agric. Food Chem. 2017, 65, 1865–1873.
10.Zhao, Z.; Sun, X.; Liu, N.; Cheng, J.; Wang, C.; Guo, M. Comparative Analysis of Caseins in Saanen Goat Milk from 3 Different Regions of China Using Quantitative Proteomics. J. Dairy Sci. 2022, 105, 5587–5599.
11. Izquierdo-González, J.J.; Amil-Ruiz, F.; Zazzu, S.; Sánchez-Lucas, R.; Fuentes-Almagro, C.A.; Rodríguez-Ortega, M.J. Proteomic Analysis of Goat Milk Kefir: Profiling the Fermentation-Time Dependent Protein Digestion and Identification of Potential Peptides with Biological Activity. Food Chem. 2019, 295, 456–465.
12. Jia, W.; Du, A.; Fan, Z.; Shi, L. Novel Insight into the Transformation of Peptides and Potential Benefits in Brown Fermented Goat Milk by Mesoporous Magnetic Dispersive Solid Phase Extraction-Based Peptidomics. Food Chem. 2022, 389, 133110.
13. Chourasia, R.; Chiring Phukon, L.; Abedin, M.M.; Padhi, S.; Singh, S.P.; Rai, A.K. Bioactive Peptides in Fermented Foods and Their Application: A Critical Review. Syst. Microbiol. Biomanuf. 2023, 3, 88–109.
14.Zhao, Z.; Sun, X.; Liu, N.; Cheng, J.; Wang, C.; Guo, M. Comparative Analysis of Caseins in Saanen Goat Milk from 3 Different Regions of China Using Quantitative Proteomics. J. Dairy Sci. 2022, 105, 5587–5599.
作为生物信息学的领军企业,BSI专注于蛋白质组学和生物药领域,通过机器学习和先进算法提供世界领先的质谱数据分析软件和蛋白质组学服务解决方案,以推进生物学研究和药物发现。我们通过基于AI的计算方案,为您提供对蛋白质组学、基因组学和医学的卓越洞见。旗下著名的PEAKS®️系列软件在全世界拥有数千家学术和工业用户,包括:PEAKS®️ Studio,PEAKS®️ Online,PEAKS®️ GlycanFinder, PEAKS®️ AB,DeepImmu®️ 免疫肽组发现服务和抗体综合表征服务等。
联系方式:021-60919891;sales-china@bioinfor.com
来自科尔多瓦大学生物与生物学分子系的Manuel J. Rodríguez-Ortega教授团队在“Identification of Potential Bioactive Peptides in Sheep Milk Kefir through Peptidomic Analysis at Different Fermentation Times”研究中对不同时间段的发酵产物进行了全面的多肽组分析,探究由于微生物蛋白酶水解而产生的多肽序列,并筛选了78条潜在的生物活性肽。该研究是首次通过蛋白质组学技术来表征羊奶开菲尔发酵乳中生物活性肽的研究,加强了对该产品的潜在益处的认识。
开菲尔菌发酵过程中不同物质成分的变化
表1显示了开菲尔发酵0-48h不同时间段的pH值、乳酸、乙醇、乳糖和 D-半乳糖浓度以及蛋白水解活性的变化。非发酵羊奶的pH值接近中性值(6.67),随着发酵的进行pH值逐渐变酸,发酵48小时后达到3.80。乳酸浓度在发酵12小时后增加了13倍,在12小时后(24小时)增加了一倍,此后乳酸浓度变化不大。非发酵乳中乙醇含量约为0.01%,发酵12小时后乙醇含量增加了8倍多,并且随着发酵的进行而持续增加,发酵48小时后,乙醇含量为2.8 g/L,相当于乙醇含量接近0.3%。D-半乳糖的含量趋势与乳酸非常相似,发酵12小时后,浓度增加了约12倍,发酵24小时后增加了17倍,在36小时达到峰值。然而,在发酵过程中乳糖的含量略有下降,但不明显。作者还用OPA法测定了蛋白水解活性,以确定微生物蛋白酶的活性变化。与未发酵乳相比,发酵12小时后蛋白水解活性增加了一倍,在24和36小时又增加了20%,在48小时后达到最大值,与未发酵乳相比增加了约 3.6 倍。
表1 不同组份随发酵时间的变化

羊奶开菲尔发酵过程的多肽组学分析
作者通过microLC–timsTOF Pro-MS/MS结合PEAKS Studio和PEAKS Online分析了用开菲尔菌发酵12、24、36 和 48 小时和对照组未发酵羊奶的多肽组变化,共鉴定到来源于11种不同蛋白质的1942条肽段(图1A),其中约91.7%的1780个肽段属于羊奶中的四种酪蛋白(αs1、αs2、β和κ),此外还发现了另外七种至少鉴定到3条肽段的蛋白。然后,作者对比了高度相似的绵羊和山羊蛋白质发酵多肽产物,发现开菲尔菌针对不同物种的同一种蛋白质的水解机制是不同的。
图1B显示了每个样品中鉴定出的多肽的总数及其与11种蛋白质的对应关系。12小时开菲尔发酵产物与对照组之间差异不大(878 vs 864)。微生物水解羊奶蛋白产生的多肽总数在发酵24小时后开始增加,48小时后达到1185,比未发酵样品增加了35%。与对照组相比,发酵48小时后β-酪蛋白肽增加了19%(从434增加到 516),αs1-酪蛋白肽增加了35%(从155增加到210),αs2-酪蛋白增加了47%(从137增加到202),κ-酪蛋白增加了133%(从79增加到184),血清淀粉样蛋白A增加了59%(从22增加到35)。然而,β-乳球蛋白和骨桥蛋白在发酵样品中的肽数量均低于非发酵乳。对照组中没有鉴定到α-乳清蛋白肽,但发酵36和48小时后检测到。血清白蛋白肽只在非发酵乳中发现,纤维蛋白原α链以及β-2-微球蛋白肽则在对照组和部分发酵乳中发现。不过,不能排除这些低丰度肽未检测到是收到其高丰度蛋白的影响。

图1 发酵过程中多肽成分变化
图2A的PCA图表明多肽成分在发酵过程中发生了明显变化。24h、36h和48h的样品接近但不重叠,表明分离程度适中。除了多肽种类的增加外,发酵期间样品中原有多肽的丰度变化也可能是造成总体变化的一个因素。多肽长度的分布也表明,随着发酵的进行,短序列(特别是具有4-12个氨基酸残基的序列)明显增加(图2B),而长序列肽的数量基本保持不变。在所有鉴定到的1942个多肽中,大多数肽的长度为7-9,其次是11-12。
 图2 多肽随着发酵时间的变化
图2 多肽随着发酵时间的变化微生物蛋白酶对羊乳蛋白的水解机制
作者将鉴定到的多肽与羊奶中主要的四个酪蛋白(β、αS1、αS2和κ)序列进行比对,以观察开菲尔菌对乳蛋白的水解模式。从图3可以看出,不同蛋白的消化模式并不统一。β-酪蛋白水解程度最高,其中Q34-F52、T78-F119、L 139-S161三个区域产生的多肽随着发酵时间的延长而增加。V162-F188之间的区域释放的多肽数量差异不大。此外,与非发酵乳相比,发酵产物在E2-K28、Q56-P76和P194-P204区域鉴定到的多肽数量略有减少。对于αs1-酪蛋白,随着发酵时间的延长,R22-N36和I37-M60两个连续区域释放的多肽数量明显增多。发酵0h和12h的样品中K124-Q172区域内未检测到任何多肽,发酵24h后该区域释放的多肽数量略有增加,G63-K79区域释放的多肽数量随发酵进行而减少。对于αs2-酪蛋白而言,N84-P119和T152-N200两个区域释放的多肽数量随着发酵而增加,而E9-E24和Q128-K151两个区域则减少。对于κ-酪蛋白,F18-L74和A96-K116之间的区域随着发酵进行,多肽释放量显著增加。相反,在S127-N143之间多肽释放量减少。此外,在A144-C末端之间,在未发酵乳中检测到的肽数量高于在发酵12小时的乳中检测到的肽数量。从这些结果得出的一般结论是,随着发酵的进行,羊奶中主要酪蛋白多肽的水解模式有显著差异,但不同蛋白受到的影响程度并不相同,从而显示出对微生物蛋白酶作用的敏感程度不同。
 图3 开菲尔菌对羊奶的β、αS1、αS2和κ酪蛋白水解序列的覆盖度
图3 开菲尔菌对羊奶的β、αS1、αS2和κ酪蛋白水解序列的覆盖度筛选潜在的生物活性肽
随后,作者在9个在线活性肽数据库中搜索了本次质谱实验所鉴定的羊奶开菲尔肽,并仅保留与数据库中100%同源的活性多肽,结果共筛选出78 条潜在活性肽(表2),这些多肽都来源于四种主要酪蛋白。据相关报道,这些潜在生物活性肽大部分仅具有ACE抑制活性,但其中一些还具抗菌、抗炎或免疫调节等功能,五种肽具有抗氧化活性,一种肽具有抗血栓活性,另一种肽具有抗菌活性。在 78种生物肽中,有7种已在牛奶开菲尔发酵乳中被报道过[8,9],12种与之前在山羊奶开菲尔发酵乳中发现的肽完全一致[10,11,12]。
表 2. 在羊奶和羊奶开菲尔中鉴定出的肽(部分)

随着发酵时间的延长,开菲尔发酵产物中鉴定出的活性肽数量明显增加(图4A)。在未发酵乳样品中鉴定出23种活性肽,而在发酵48小时后,增加到61种肽。在所有样品中共检测到12种肽(图4B),仅在对照36或48小时样品中检测到6种不同的肽,而有29条活性肽在所有发酵样品中均被检测到(图4C)。

图4 发酵过程中活性肽的检出
小结
作者鉴定了开菲尔菌对11种乳蛋白水解释放的近2000种肽,其中大多数肽来自四种主要乳酪蛋白,占总乳蛋白丰度的80%左右[13,14],β-酪蛋白的水解肽数量最多。筛选出的78 种活性肽中,有55种在对照组中不存在,表明这些多肽是在发酵过程中因微生物蛋白酶的特殊作用而出现的,且对人体健康有益。该研究首次对不同发酵时间收集的羊奶开菲尔乳的多肽组进行全面分析,该分析有助于了解随着发酵过程的推进,羊奶蛋白质消化模式和多肽成分的变化。在发酵过程中会出现具有多种生物学特性的生物活性肽,这些活性肽随时间而变化,时间越长,含量越高。但仍需进一步研究以了解这些活性肽是否以及如何在体内保持活性,尤其是在胃肠消化后。
原文链接:https://www.mdpi.com/2304-8158/12/15/2974
参考文献
1.Azizi, N.F.; Kumar, M.R.; Yeap, S.K.; Abdullah, J.O.; Khalid, M.; Omar, A.R.; Osman, M.A.; Mortadza, S.A.S.; Alitheen, N.B. Kefir and Its Biological Activities. Foods 2021, 10, 1210.
2. Chourasia, R.; Chiring Phukon, L.; Abedin, M.M.; Padhi, S.; Singh, S.P.; Rai, A.K. Bioactive Peptides in Fermented Foods and Their Application: A Critical Review. Syst. Microbiol. Biomanuf. 2023, 3, 88–109.
3.Miao, J.; Guo, H.; Chen, F.; Zhao, L.; He, L.; Ou, Y.; Huang, M.; Zhang, Y.; Guo, B.; Cao, Y.; et al. Antibacterial Effects of a Cell-Penetrating Peptide Isolated from Kefir. J. Agric. Food Chem. 2016, 64, 3234–3242.
4. de Lima, M.D.S.F.; da Silva, R.A.; da Silva, M.F.; da Silva, P.A.B.; Costa, R.M.P.B.; Teixeira, J.A.C.; Porto, A.L.F.; Cavalcanti, M.T.H. Brazilian Kefir-Fermented Sheep’s Milk, a Source of Antimicrobial and Antioxidant Peptides. Probiotics Antimicrob. Proteins 2018, 10, 446–455.
5.Vieira, C.P.; Rosario, A.I.L.S.; Lelis, C.A.; Rekowsky, B.S.S.; Carvalho, A.P.A.; Rosário, D.K.A.; Elias, T.A.; Costa, M.P.; Foguel, D.; Conte-Junior, C.A. Bioactive Compounds from Kefir and Their Potential Benefits on Health: A Systematic Review and Meta-Analysis. Oxidative Med. Cell. Longev. 2021, 2021, 9081738.
6. Mudgil, P.; Gan, C.-Y.; Affan Baig, M.; Hamdi, M.; Mohteshamuddin, K.; Aguilar-Toalá, J.E.; Vidal-Limon, A.M.; Liceaga, A.M.; Maqsood, S. In-Depth Peptidomic Profile and Molecular Simulation Studies on ACE-Inhibitory Peptides Derived from Probiotic Fermented Milk of Different Farm Animals. Food Res. Int. 2023, 168, 112706.
7.Tomazou, M.; Oulas, A.; Anagnostopoulos, A.K.; Tsangaris, G.T.; Spyrou, G.M. In Silico Identification of Antimicrobial Peptides in the Proteomes of Goat and Sheep Milk and Feta Cheese. Proteomes 2019, 7, 32.
8.Ebner, J.; Aşçı Arslan, A.; Fedorova, M.; Hoffmann, R.; Küçükçetin, A.; Pischetsrieder, M. Peptide Profiling of Bovine Kefir Reveals 236 Unique Peptides Released from Caseins during Its Production by Starter Culture or Kefir Grains. J. Proteom. 2015, 117, 41–57.
9. Liu, Y.; Pischetsrieder, M. Identification and Relative Quantification of Bioactive Peptides Sequentially Released during Simulated Gastrointestinal Digestion of Commercial Kefir. J. Agric. Food Chem. 2017, 65, 1865–1873.
10.Zhao, Z.; Sun, X.; Liu, N.; Cheng, J.; Wang, C.; Guo, M. Comparative Analysis of Caseins in Saanen Goat Milk from 3 Different Regions of China Using Quantitative Proteomics. J. Dairy Sci. 2022, 105, 5587–5599.
11. Izquierdo-González, J.J.; Amil-Ruiz, F.; Zazzu, S.; Sánchez-Lucas, R.; Fuentes-Almagro, C.A.; Rodríguez-Ortega, M.J. Proteomic Analysis of Goat Milk Kefir: Profiling the Fermentation-Time Dependent Protein Digestion and Identification of Potential Peptides with Biological Activity. Food Chem. 2019, 295, 456–465.
12. Jia, W.; Du, A.; Fan, Z.; Shi, L. Novel Insight into the Transformation of Peptides and Potential Benefits in Brown Fermented Goat Milk by Mesoporous Magnetic Dispersive Solid Phase Extraction-Based Peptidomics. Food Chem. 2022, 389, 133110.
13. Chourasia, R.; Chiring Phukon, L.; Abedin, M.M.; Padhi, S.; Singh, S.P.; Rai, A.K. Bioactive Peptides in Fermented Foods and Their Application: A Critical Review. Syst. Microbiol. Biomanuf. 2023, 3, 88–109.
14.Zhao, Z.; Sun, X.; Liu, N.; Cheng, J.; Wang, C.; Guo, M. Comparative Analysis of Caseins in Saanen Goat Milk from 3 Different Regions of China Using Quantitative Proteomics. J. Dairy Sci. 2022, 105, 5587–5599.
联系方式:021-60919891;sales-china@bioinfor.com
相关文章
更多 >

