胍丁胺对糖尿病神经病理性疼痛大鼠的干预效应及机制
2019-08-27 来源:本站 点击次数:6327
胍丁胺对糖尿病神经病理性疼痛大鼠的干预效应及机制
摘要:
目的:观寮胍丁胺(AGM)对糖尿病神经病理性疼痛(ⅠNP)模型大鼠的干预效应,并探讨其可能的机制。
方法:将40只雄性SD大鼠随机分为5组各8只,除对照组外其余各组单次腹腔注射链脲佐菌素65mg/kg构建糖尿病模型;足底触痛伩测量糖尿病大鼠杋械缩足阈偵(\wT)和热缩足潜伏期(Tw),降嘔〉20%基础阈值视为DNP大鼠模型制爷成功。ACM50组、ACM300组、GP组分别腹腔注射AGM150、300mg/kg和加巴喷丁100mg/g,对照组、模型组腹腔注射等量生理盐水。分别于STZ注射前1d(0d),SYZ注射后7、14、21、28d,取尾静脉血检测血糖,烂底触痛仪测量MWT、TWL:检査后处死大鼠取脊髓组织,釆用 Western blotting法检测磷酸化细胞外调节蛋白激酶活性。结果与对照组比较,其他各组血糖均升高,MWT降低、TW.缩短(P均<0.01)。与模型组比较,AGM150组、AGⅥ300组于STZ注射后21、28d血糖降低(P<0.05或<0.01),GP组血糖差异无统计学意义:AGM150组、AGM300组MwT(21、28d)升高、TW.(28d)延长(P均<0.01),GP组21、28d时MWT升高TWL延长(P<0.05或<0.01);于SIz注射后28d,模型组pERK蛋白表达量高于对照组(P<0.05),AGM450组、AGM300组、GP组大鼠脊髓pRK表达量均低于模型组(P<0.05或<0.01)。
结论:AGM具有明显地调节血糖及镇痛效应,其镇痛机制可能与其对血糖的调节及抑制脊髓ERK蛋臼的活化有关
关键词:糖尿病神经病理性疼痛:胍丁胺;加巴曠丁;血糖:镇痛作用;细胞外调节蛋白激酶∷大鼠
糖尿病神经病理性疼痛(DNP)是指由糖尿病诱发的外周及中枢神经病变所致的顽固性疼痛,严重影响患者的生活质量。目前DNP治疗药物主要有醛糖还原酶抑制剂、血管扩张剂、神经营养剂、自由基清除剂等,临床应用结果显示以上药物对患者肢端麻木的改善效果较好,但对减轻疼痛效果不明显。作为二线治疗的阿片类药物或非甾体类抗炎药,虽然具有良好的镇痛活性,但多伴有较严重的不良反应并易导致严重的躯体或心理依赖。因此,DNP的治疗已成为世界疼痛领域面临的一大难题,寻找新的安全有效的治疗药物迫在眉睫。胍丁胺(AGM)是精氨酸在左旋精氨酸脱羧酶(LADC)催化下脱羧基而成的一种内源性生物活性物质,对炎性疼痛或慢性神经源性疼痛都有
定的镇痛效应。然而,有关AGM治疗DNP的效果及作用机制的报道鲜见。2018年3~8月,我们采用链脲佐菌素(STZ)构建DNP大鼠模型,以经典神经病理性疼痛治疗药加巴喷丁(GP)为阳性对照,通过观察其行为学和脊髓组织中磷酸化细胞外调节蛋白激酶(pRK)表达变化,探索AGM的镇痛机制,旨在为DNP的临床治疗提供安全有效的新型治疗药物奠定理论支持。
1材料与方法
1.1主要材料:SPF级SD雄性大鼠,体质量180-200g,由湖南斯莱克景达实验动物有限公司提供,动物许可证号SCXK(湘)20160002,所有操作符合动物伦理委员会的要求。STZ(批号S0130)、AGM(批号A7127)均购自美国 Sigma公司,加巴喷丁(批号G122413)购自上海阿拉丁生化科技股份有限公司;ERK1/2及p玊RK12兔抗大鼠多克隆抗体购自南京巴傲得生物科技有限公司,辣根过氧化物酶标记的羊抗兔二抗购自武汉博士德公司,蛋白提取试剂盒、ECL增强化学发光试剂盒和BCA蛋白定量检测试剂盒均购自美国 Thermo公司; Imark酶标仪、 Trans-lotl703920蛋白电泳仪均购自美国BioRad公司, Alpha ImagerHP凝胶成像系统购自美国Alpha公司YS22A型足底触痛仪购自北京众实迪创科技发展有限责任公司。
1.2实验方法
1.2.1DNP模型构建
大鼠在自然光线,自由摄食、饮水条件下适应性喂养7d。进行基础阈值检测,剔除先天对痛觉不敏感的大鼠。大鼠夜间禁食不禁水12h后,单次腹腔注射新鲜配制SⅣZ溶液6540mg/kg;于注射后72h,测量尾静脉空腹血糖,随机鼠模型成功。于注射14d后,测定糖尿病大鼠机械缩足阈值(MWT)、热缩足潜伏期(TWL),降低幅度>20%基础阈值视为DNP模型制备成功。
1.2.2动物分组及药物干预
取32只DNP模型大鼠,釆用随机数字表法分为4组各8只。注射STZ后第15天起,AGM150、AGM-300组分别腹腔注射AGM150、300mg/kg,GP组腹腔注射GP100mg/kg,模型组腹腔注射等量生理盐水;另取8只正常小鼠作为对照组,腹腔注射等量生理盐水。各组均腹腔注射1次/d,连续14d。1.2.3大鼠血糖测定分别于STZ注射前1d(0-d),SⅣZ注射后7、14、21、28d,取尾静脉血,用三诺安稳型血糖仪测定空腹血糖
1.2.4大鼠疼痛行为学检查
分别于STZ注射前1d(0d),STZ注射后7、14、21、28d,测量MWT和TWL等疼痛行为学指标,测定时间均于每日9:00~16:00完成。维持室温25℃左右,将大鼠置于足底触痛仪实验箱中适应30min后即可开始进行测量。按照激光定位大鼠后肢足底掌心,视频屏幕协助定位;用足底触痛仪记录底部针头或热触头从上升至接触大鼠足底到引起大鼠足部挪开刺激位置的力(即为MWT)或时间(即为TWL),读数精确至0.1N或0.1s;重复3次,取平均值作为统计数据,每次测量间隔时间不少于3min。为避免损伤动物,选取的最大测试压力为55N、触发温度为35℃。
1.2.5大鼠脊髓组织pRK蛋白检测采用
Western blotting法。行为学检查后,冰上迅速断头处死大鼠,快速剪取脊髓L~L。节段;加入细胞裂解液后置于匀浆器中充分匀浆,冰上裂解30min后转至1.5mL离心管;4℃下以12000r/min离心15min,取上清液。BCA法测定样本蛋白浓度后,按1:4加入5×上样缓冲液,煮沸变性5min后-20℃C保存。将样本蛋白在10% SDS-PGE凝胶系统中上样电泳,采用浓缩胶电压80V,分离胶电压120V电泳。电泳完成后裁取所需分子量的凝胶,湿转法将目的蛋白转移至PVDF膜上,5%脱脂牛奶封闭1h加入兔源pRK一抗(1:1000),4℃孵育过夜,洗涤液漂洗滤膜3次,每次10min;加入辣根过氧化物酶标记山羊抗兔二抗(1:5000)室温摇床孵育1h,Washing buffer漂洗3次,每次l0min。凝胶成像仪血糖浓度≥16.7mmol/L且稳定认为制备糖尿病大
曝光成像,用 Image j图像分析软件对目标条带进行软件。计量资料以x±s表示,多组间比较行单因素测定。曝光结束后,膜再生液洗脱pERK抗体;将方差分析( One Way ANOVA)。P<0.05为差异具PVDF膜与兔源ERK(1:1000)一抗孵育,再按前述有统计学意义方法操作后曝光成像。以pERK与总ERK蛋白条2结果带灰度值的比值来表示PERK的表达变化水平
1.3统计学方法采用 Graphpad Prism6.0统计2.2各组大鼠MWT、TWL比较见表2、表3。
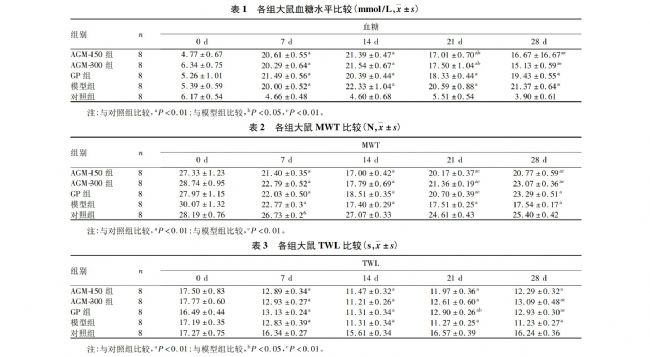
2.1各组大鼠血糖水平比较见表1。
2.3各组大鼠脊髓P玊RK表达比较与对照组大阈值,证明DNP大鼠模型制备成功。鼠脊髓p玊RK表达量(2460.55±10.41)比较,模型组pERK蛋白表达量(4431.22±434.78)增加的神经递质/调质,参与多种疾病的病理过程,具有(P<0.05);与模型组比较,AGM150组(2422.35神经细胞保护、镇痛,促细胞增殖,预防和治疗阿片±145.42)、AGM30组(3375.4±304.38)、GP组所致躯体、精神依赖和复吸等重要药理作用,有良好(2761.19±37.71)大鼠脊髓pRK表达量均降的开发前景及应用价值。内源性AGM可能通过激低(P<0.05或<0.01)。
3讨论
DNP的发病机制十分复杂,目前尚缺乏确切的醋酸扭体实验中,外源性给予AGM可以观察到明病因学解释。约87%的糖尿病患者长期承受着神显的镇痛活性。兰忠平等采用蜜蜂毒新型炎经病变所致的慢性疼痛,治疗上主要依赖于改善患性痛模型,鞘内同时注射AGM与吗啡可发挥协同者血糖水平及促进外周神经损伤的修复。由于镇痛作用。坐骨神经结扎大鼠海马内注射AGM(1疼痛是一种不愉快的主观情感体验,只能将疼痛阈值作为疼痛的评估标准。研究表明,腹腔注射SⅣZ可能与海马σ受体调节肿瘤坏死因子α(TNFα)表可引起机械痛觉过敏和触觉异常性疼痛凹。本研达减少有关间。本研究结果表明,AGM(150、300究采用单次腹腔注射SⅣZ65mg/kg制备糖尿病大mg/kg)能显著提高DNP大鼠的MWT、延长TWL,鼠模型,利用MWT、TWL作为疼痛指标,造模后大且AGM300mg/kg作用效果与GP相当,证明AGM鼠MWT、TWL均明显下降,且降低幅度>20%基础能减轻糖尿病大鼠神经病理性疼痛。本硏究中AGM对DNP大鼠TWL的延长效果没有MWT增高的明显,可能与仪器探头接触大鼠足部肉垫有关。
除了对大鼠行为学上的影响,本研究发现AGM(150、300mg/kg)均可降低DNP大鼠血糖水平,与Moldering等的研究结论一致。Ii等研究发现,在细胞水平上,AGM对SZ诱导的胰岛β细胞损伤具有抑制作用,可能与其激活咪唑啉受体I3亚型有关。这提示AGM可能通过激活咪唑啉受体,降低血糖水平来延缓DNP进程,改善DNP症状。ERK家族有5个亚族,其中ERK1/2通过级联信号将细胞外刺激传递至细胞核、磷酸化转录因子,可调节细胞功能,参与细胞增殖、分化、存活、死亡等神经细胞重要功能的调控,在疼痛及痛觉过敏信号传导过程中起重要作用。ERKl/2的磷酸化含量可反映多种刺激诱发的神经细胞的快速变化,是一种新型神经细胞活动的功能指标。在多种病理性疼痛模型中,均发现ERK信号通路参与了脊髓水平伤害性信号调节和中枢敏感化的形成"。伤害性刺激使脊髓背角或背根神经节神经细胞ERK发生磷酸化,磷酸化的ERK一方面通过磷酸化神经细胞膜离子通道或受体,调节神经细胞的兴奋性;另一方面激活核内转录因子调节伤害性刺激引起的靶基因表达,介导疼痛及痛觉敏化信号转导。Han等2研究发现,在大鼠坐骨神经慢性压迫性损伤(CCⅠ)模型中,脊髓背角pERK水平显著上调;早期鞘内注射促分裂原活化蛋白激酶激酶(MEK)抑制剂U0126,可有效阻断和延迟CCⅠ诱导的机械性异常性疼痛和热痛觉过敏。秦晓辉等研究结果表明,AGM对甲醛所致大鼠疼痛反应有明显的镇痛作用;并且,在甲醛致痛前预先给予AGM160mg/kg,能明显抑制甲醛所致脊髓背角磷酸化ERK表达量的上调。以上研究提示,ERK信号通路可能在DNP中同样起到了至关重要的作用。本实验结果表明,AGM(150、300mg/kg)可降低DNP大鼠脊髓ERK磷酸化水平。这提示AGM对DNP大鼠的镇痛机制可能与抑制脊髓p£RK的激活,减少脊髓内伤害性信号传导有关AGM为中国人民解放军军事医学科学院毒物药物研究所承担的重大新药创制课题在研项目,目前尚未在国内上市,故而国内未有相关临床应用报道。在国外,已有研究表明高剂量硫酸胍丁胺方案(2.670g/d)可连续安全食用长达5年,且在整个研究期间未出现不良反应。研究表明,在膳食中添加AGM可用于缓解腰椎间盘相关神经根病的疼痛,改善生活质量。综上所述,本研究基于大鼠DNP模型,揭示了AGM具有明显地调节血糖及镇痛效应,其镇痛机制化有关,为其临床应用奠定了一定的理论基础。
参考文献
Ll] Schreiber AK, Nones CF, Reis RC, et al. Diabetic neuropathic pain: physiopathology and treatment [J]. World J Diabetes, 2015 6(3):3244
2] Malcangio M, Tomlinson DR. A pharmacologic analysis of mechanical hyperalgesia in streptozotocin/ diabetic rats L].Pain,1998
3 Li F, Wu N, Su R, et al. Imidazoline receptor antisera-selected Nischarin regulates the effect of agmatine on the development of orphine dependence [n. Addict Biol, 2012, 17(2): 392-408
4] Li J, Li X, Pei G, et al. Analgesic effect of agmatine and itsehancement on morphine analgesia in mice and rats [].ActaPharmacol sin,199,20(1):8185
5]兰忠平,陈雅慧,顾楠,等.脊髓水平给予胍丁胺对鞘内吗啡镇痛的影响.中国应用生理学杂志,2014,30(3):197-98
6 Kotagale NR, Shirbhate SH, Shukla P, et al. Agmatine attenuates neuropathic pain in sciatic nerve ligated rats: Modulation by hippocampal sigma receptors LJ]. Eur J Pharmacol, 2013, 714(1-3)424-431
[] Molderings GJ, HaenischB. Agmatine decarboxylated L-arginine).physiological role and therapeutic potential [J. Pharmacol Ther,2012,133(3):351-365
8] Li Y, Cheng KC, Asakawa A, et al. Activation of imidazoline-H3receptors ameliorates pancreatic damage []. Clin Exp Pharmacol Physiol,2015,42(9):964971
9] Pan B, Zhong P, Sun D, et al. Extracellular signal-regulated kinase signaling in the ventral tegmental area mediates cocaine-induced synaptic plasticity and rewarding effects [J]. JNeuro-science,20l1,31(31):1124411255 L1oJ Xu X, Chen H, Ling BY, et al. Extracellular signal-regulated protein kinase activation in spinal cord contributes to pain hypersenstivity in a mouse model of type 2 diabetes [J]. Neurosci Bull 2014,30(1):5366Lll White JP, Cibelli M, Fidalgo AR, et al. Extracellular signal-regulated kinases in pain of peripheral origin LJI. Eur J Pha 2011,650(1):817
[12] Han M, Huang RY, Du YM, et al. Early intervention of ERK activation in the spinal cord can block initiation of peripheral nerveinjury-induced neuropathic pain in rats []. Acta Physiologica Sinica,2011,63(2):106114
13]秦晓辉,吴宁,苏瑞斌,等.胍丁胺抑制炎性疼痛诱导脊髓磷酸化细胞外信号调节激酶表达上调D].中国临床药理学与治疗学,2007,12(9):101841022
14] Gilad GM, Gilad VH. Long-term (5 years), high daily dosage of dietary agmatine-evidence of safety a case report [J].JMedFood,2014,17(11):12564259
15.Keynan O, Mirovsky Y, Dekel S, et al. Safety and efficacy of diet-ary agmatine sulfate in lumbar dise-associated radiculopathy. an open -abel, dose-escalating study followed by a randomized, doub le-blind, placebo-eontrolled trial [J]. Pain Med, 2010, 11(3)
摘要:
目的:观寮胍丁胺(AGM)对糖尿病神经病理性疼痛(ⅠNP)模型大鼠的干预效应,并探讨其可能的机制。
方法:将40只雄性SD大鼠随机分为5组各8只,除对照组外其余各组单次腹腔注射链脲佐菌素65mg/kg构建糖尿病模型;足底触痛伩测量糖尿病大鼠杋械缩足阈偵(\wT)和热缩足潜伏期(Tw),降嘔〉20%基础阈值视为DNP大鼠模型制爷成功。ACM50组、ACM300组、GP组分别腹腔注射AGM150、300mg/kg和加巴喷丁100mg/g,对照组、模型组腹腔注射等量生理盐水。分别于STZ注射前1d(0d),SYZ注射后7、14、21、28d,取尾静脉血检测血糖,烂底触痛仪测量MWT、TWL:检査后处死大鼠取脊髓组织,釆用 Western blotting法检测磷酸化细胞外调节蛋白激酶活性。结果与对照组比较,其他各组血糖均升高,MWT降低、TW.缩短(P均<0.01)。与模型组比较,AGM150组、AGⅥ300组于STZ注射后21、28d血糖降低(P<0.05或<0.01),GP组血糖差异无统计学意义:AGM150组、AGM300组MwT(21、28d)升高、TW.(28d)延长(P均<0.01),GP组21、28d时MWT升高TWL延长(P<0.05或<0.01);于SIz注射后28d,模型组pERK蛋白表达量高于对照组(P<0.05),AGM450组、AGM300组、GP组大鼠脊髓pRK表达量均低于模型组(P<0.05或<0.01)。
结论:AGM具有明显地调节血糖及镇痛效应,其镇痛机制可能与其对血糖的调节及抑制脊髓ERK蛋臼的活化有关
关键词:糖尿病神经病理性疼痛:胍丁胺;加巴曠丁;血糖:镇痛作用;细胞外调节蛋白激酶∷大鼠
糖尿病神经病理性疼痛(DNP)是指由糖尿病诱发的外周及中枢神经病变所致的顽固性疼痛,严重影响患者的生活质量。目前DNP治疗药物主要有醛糖还原酶抑制剂、血管扩张剂、神经营养剂、自由基清除剂等,临床应用结果显示以上药物对患者肢端麻木的改善效果较好,但对减轻疼痛效果不明显。作为二线治疗的阿片类药物或非甾体类抗炎药,虽然具有良好的镇痛活性,但多伴有较严重的不良反应并易导致严重的躯体或心理依赖。因此,DNP的治疗已成为世界疼痛领域面临的一大难题,寻找新的安全有效的治疗药物迫在眉睫。胍丁胺(AGM)是精氨酸在左旋精氨酸脱羧酶(LADC)催化下脱羧基而成的一种内源性生物活性物质,对炎性疼痛或慢性神经源性疼痛都有
定的镇痛效应。然而,有关AGM治疗DNP的效果及作用机制的报道鲜见。2018年3~8月,我们采用链脲佐菌素(STZ)构建DNP大鼠模型,以经典神经病理性疼痛治疗药加巴喷丁(GP)为阳性对照,通过观察其行为学和脊髓组织中磷酸化细胞外调节蛋白激酶(pRK)表达变化,探索AGM的镇痛机制,旨在为DNP的临床治疗提供安全有效的新型治疗药物奠定理论支持。
1材料与方法
1.1主要材料:SPF级SD雄性大鼠,体质量180-200g,由湖南斯莱克景达实验动物有限公司提供,动物许可证号SCXK(湘)20160002,所有操作符合动物伦理委员会的要求。STZ(批号S0130)、AGM(批号A7127)均购自美国 Sigma公司,加巴喷丁(批号G122413)购自上海阿拉丁生化科技股份有限公司;ERK1/2及p玊RK12兔抗大鼠多克隆抗体购自南京巴傲得生物科技有限公司,辣根过氧化物酶标记的羊抗兔二抗购自武汉博士德公司,蛋白提取试剂盒、ECL增强化学发光试剂盒和BCA蛋白定量检测试剂盒均购自美国 Thermo公司; Imark酶标仪、 Trans-lotl703920蛋白电泳仪均购自美国BioRad公司, Alpha ImagerHP凝胶成像系统购自美国Alpha公司YS22A型足底触痛仪购自北京众实迪创科技发展有限责任公司。
1.2实验方法
1.2.1DNP模型构建
大鼠在自然光线,自由摄食、饮水条件下适应性喂养7d。进行基础阈值检测,剔除先天对痛觉不敏感的大鼠。大鼠夜间禁食不禁水12h后,单次腹腔注射新鲜配制SⅣZ溶液6540mg/kg;于注射后72h,测量尾静脉空腹血糖,随机鼠模型成功。于注射14d后,测定糖尿病大鼠机械缩足阈值(MWT)、热缩足潜伏期(TWL),降低幅度>20%基础阈值视为DNP模型制备成功。
1.2.2动物分组及药物干预
取32只DNP模型大鼠,釆用随机数字表法分为4组各8只。注射STZ后第15天起,AGM150、AGM-300组分别腹腔注射AGM150、300mg/kg,GP组腹腔注射GP100mg/kg,模型组腹腔注射等量生理盐水;另取8只正常小鼠作为对照组,腹腔注射等量生理盐水。各组均腹腔注射1次/d,连续14d。1.2.3大鼠血糖测定分别于STZ注射前1d(0-d),SⅣZ注射后7、14、21、28d,取尾静脉血,用三诺安稳型血糖仪测定空腹血糖
1.2.4大鼠疼痛行为学检查
分别于STZ注射前1d(0d),STZ注射后7、14、21、28d,测量MWT和TWL等疼痛行为学指标,测定时间均于每日9:00~16:00完成。维持室温25℃左右,将大鼠置于足底触痛仪实验箱中适应30min后即可开始进行测量。按照激光定位大鼠后肢足底掌心,视频屏幕协助定位;用足底触痛仪记录底部针头或热触头从上升至接触大鼠足底到引起大鼠足部挪开刺激位置的力(即为MWT)或时间(即为TWL),读数精确至0.1N或0.1s;重复3次,取平均值作为统计数据,每次测量间隔时间不少于3min。为避免损伤动物,选取的最大测试压力为55N、触发温度为35℃。
1.2.5大鼠脊髓组织pRK蛋白检测采用
Western blotting法。行为学检查后,冰上迅速断头处死大鼠,快速剪取脊髓L~L。节段;加入细胞裂解液后置于匀浆器中充分匀浆,冰上裂解30min后转至1.5mL离心管;4℃下以12000r/min离心15min,取上清液。BCA法测定样本蛋白浓度后,按1:4加入5×上样缓冲液,煮沸变性5min后-20℃C保存。将样本蛋白在10% SDS-PGE凝胶系统中上样电泳,采用浓缩胶电压80V,分离胶电压120V电泳。电泳完成后裁取所需分子量的凝胶,湿转法将目的蛋白转移至PVDF膜上,5%脱脂牛奶封闭1h加入兔源pRK一抗(1:1000),4℃孵育过夜,洗涤液漂洗滤膜3次,每次10min;加入辣根过氧化物酶标记山羊抗兔二抗(1:5000)室温摇床孵育1h,Washing buffer漂洗3次,每次l0min。凝胶成像仪血糖浓度≥16.7mmol/L且稳定认为制备糖尿病大
曝光成像,用 Image j图像分析软件对目标条带进行软件。计量资料以x±s表示,多组间比较行单因素测定。曝光结束后,膜再生液洗脱pERK抗体;将方差分析( One Way ANOVA)。P<0.05为差异具PVDF膜与兔源ERK(1:1000)一抗孵育,再按前述有统计学意义方法操作后曝光成像。以pERK与总ERK蛋白条2结果带灰度值的比值来表示PERK的表达变化水平
1.3统计学方法采用 Graphpad Prism6.0统计2.2各组大鼠MWT、TWL比较见表2、表3。

2.3各组大鼠脊髓P玊RK表达比较与对照组大阈值,证明DNP大鼠模型制备成功。鼠脊髓p玊RK表达量(2460.55±10.41)比较,模型组pERK蛋白表达量(4431.22±434.78)增加的神经递质/调质,参与多种疾病的病理过程,具有(P<0.05);与模型组比较,AGM150组(2422.35神经细胞保护、镇痛,促细胞增殖,预防和治疗阿片±145.42)、AGM30组(3375.4±304.38)、GP组所致躯体、精神依赖和复吸等重要药理作用,有良好(2761.19±37.71)大鼠脊髓pRK表达量均降的开发前景及应用价值。内源性AGM可能通过激低(P<0.05或<0.01)。
3讨论
DNP的发病机制十分复杂,目前尚缺乏确切的醋酸扭体实验中,外源性给予AGM可以观察到明病因学解释。约87%的糖尿病患者长期承受着神显的镇痛活性。兰忠平等采用蜜蜂毒新型炎经病变所致的慢性疼痛,治疗上主要依赖于改善患性痛模型,鞘内同时注射AGM与吗啡可发挥协同者血糖水平及促进外周神经损伤的修复。由于镇痛作用。坐骨神经结扎大鼠海马内注射AGM(1疼痛是一种不愉快的主观情感体验,只能将疼痛阈值作为疼痛的评估标准。研究表明,腹腔注射SⅣZ可能与海马σ受体调节肿瘤坏死因子α(TNFα)表可引起机械痛觉过敏和触觉异常性疼痛凹。本研达减少有关间。本研究结果表明,AGM(150、300究采用单次腹腔注射SⅣZ65mg/kg制备糖尿病大mg/kg)能显著提高DNP大鼠的MWT、延长TWL,鼠模型,利用MWT、TWL作为疼痛指标,造模后大且AGM300mg/kg作用效果与GP相当,证明AGM鼠MWT、TWL均明显下降,且降低幅度>20%基础能减轻糖尿病大鼠神经病理性疼痛。本硏究中AGM对DNP大鼠TWL的延长效果没有MWT增高的明显,可能与仪器探头接触大鼠足部肉垫有关。
除了对大鼠行为学上的影响,本研究发现AGM(150、300mg/kg)均可降低DNP大鼠血糖水平,与Moldering等的研究结论一致。Ii等研究发现,在细胞水平上,AGM对SZ诱导的胰岛β细胞损伤具有抑制作用,可能与其激活咪唑啉受体I3亚型有关。这提示AGM可能通过激活咪唑啉受体,降低血糖水平来延缓DNP进程,改善DNP症状。ERK家族有5个亚族,其中ERK1/2通过级联信号将细胞外刺激传递至细胞核、磷酸化转录因子,可调节细胞功能,参与细胞增殖、分化、存活、死亡等神经细胞重要功能的调控,在疼痛及痛觉过敏信号传导过程中起重要作用。ERKl/2的磷酸化含量可反映多种刺激诱发的神经细胞的快速变化,是一种新型神经细胞活动的功能指标。在多种病理性疼痛模型中,均发现ERK信号通路参与了脊髓水平伤害性信号调节和中枢敏感化的形成"。伤害性刺激使脊髓背角或背根神经节神经细胞ERK发生磷酸化,磷酸化的ERK一方面通过磷酸化神经细胞膜离子通道或受体,调节神经细胞的兴奋性;另一方面激活核内转录因子调节伤害性刺激引起的靶基因表达,介导疼痛及痛觉敏化信号转导。Han等2研究发现,在大鼠坐骨神经慢性压迫性损伤(CCⅠ)模型中,脊髓背角pERK水平显著上调;早期鞘内注射促分裂原活化蛋白激酶激酶(MEK)抑制剂U0126,可有效阻断和延迟CCⅠ诱导的机械性异常性疼痛和热痛觉过敏。秦晓辉等研究结果表明,AGM对甲醛所致大鼠疼痛反应有明显的镇痛作用;并且,在甲醛致痛前预先给予AGM160mg/kg,能明显抑制甲醛所致脊髓背角磷酸化ERK表达量的上调。以上研究提示,ERK信号通路可能在DNP中同样起到了至关重要的作用。本实验结果表明,AGM(150、300mg/kg)可降低DNP大鼠脊髓ERK磷酸化水平。这提示AGM对DNP大鼠的镇痛机制可能与抑制脊髓p£RK的激活,减少脊髓内伤害性信号传导有关AGM为中国人民解放军军事医学科学院毒物药物研究所承担的重大新药创制课题在研项目,目前尚未在国内上市,故而国内未有相关临床应用报道。在国外,已有研究表明高剂量硫酸胍丁胺方案(2.670g/d)可连续安全食用长达5年,且在整个研究期间未出现不良反应。研究表明,在膳食中添加AGM可用于缓解腰椎间盘相关神经根病的疼痛,改善生活质量。综上所述,本研究基于大鼠DNP模型,揭示了AGM具有明显地调节血糖及镇痛效应,其镇痛机制化有关,为其临床应用奠定了一定的理论基础。
参考文献
Ll] Schreiber AK, Nones CF, Reis RC, et al. Diabetic neuropathic pain: physiopathology and treatment [J]. World J Diabetes, 2015 6(3):3244
2] Malcangio M, Tomlinson DR. A pharmacologic analysis of mechanical hyperalgesia in streptozotocin/ diabetic rats L].Pain,1998
3 Li F, Wu N, Su R, et al. Imidazoline receptor antisera-selected Nischarin regulates the effect of agmatine on the development of orphine dependence [n. Addict Biol, 2012, 17(2): 392-408
4] Li J, Li X, Pei G, et al. Analgesic effect of agmatine and itsehancement on morphine analgesia in mice and rats [].ActaPharmacol sin,199,20(1):8185
5]兰忠平,陈雅慧,顾楠,等.脊髓水平给予胍丁胺对鞘内吗啡镇痛的影响.中国应用生理学杂志,2014,30(3):197-98
6 Kotagale NR, Shirbhate SH, Shukla P, et al. Agmatine attenuates neuropathic pain in sciatic nerve ligated rats: Modulation by hippocampal sigma receptors LJ]. Eur J Pharmacol, 2013, 714(1-3)424-431
[] Molderings GJ, HaenischB. Agmatine decarboxylated L-arginine).physiological role and therapeutic potential [J. Pharmacol Ther,2012,133(3):351-365
8] Li Y, Cheng KC, Asakawa A, et al. Activation of imidazoline-H3receptors ameliorates pancreatic damage []. Clin Exp Pharmacol Physiol,2015,42(9):964971
9] Pan B, Zhong P, Sun D, et al. Extracellular signal-regulated kinase signaling in the ventral tegmental area mediates cocaine-induced synaptic plasticity and rewarding effects [J]. JNeuro-science,20l1,31(31):1124411255 L1oJ Xu X, Chen H, Ling BY, et al. Extracellular signal-regulated protein kinase activation in spinal cord contributes to pain hypersenstivity in a mouse model of type 2 diabetes [J]. Neurosci Bull 2014,30(1):5366Lll White JP, Cibelli M, Fidalgo AR, et al. Extracellular signal-regulated kinases in pain of peripheral origin LJI. Eur J Pha 2011,650(1):817
[12] Han M, Huang RY, Du YM, et al. Early intervention of ERK activation in the spinal cord can block initiation of peripheral nerveinjury-induced neuropathic pain in rats []. Acta Physiologica Sinica,2011,63(2):106114
13]秦晓辉,吴宁,苏瑞斌,等.胍丁胺抑制炎性疼痛诱导脊髓磷酸化细胞外信号调节激酶表达上调D].中国临床药理学与治疗学,2007,12(9):101841022
14] Gilad GM, Gilad VH. Long-term (5 years), high daily dosage of dietary agmatine-evidence of safety a case report [J].JMedFood,2014,17(11):12564259
15.Keynan O, Mirovsky Y, Dekel S, et al. Safety and efficacy of diet-ary agmatine sulfate in lumbar dise-associated radiculopathy. an open -abel, dose-escalating study followed by a randomized, doub le-blind, placebo-eontrolled trial [J]. Pain Med, 2010, 11(3)
相关文章
更多 >

