HINT-快速检测和评价冠状病毒药物的方法实例
2020-09-14 来源:Nexcelom 点击次数:9695COVID-19 的出现,使全球的公共卫生面临了严峻的挑战。尽快开发针对SARS-CoV-2的药物和疫苗是科学家们的当务之急。根据以往的经验,具有病毒中和能力的单克隆抗体在这两方面应用都具有很好的潜力。本文将为大家介绍由美国国立卫生研究院(NIH), 美国疾病预防控制中心(CDC), MedImmune 等权威机构及制药公司开发及推荐的快速筛选病毒中和抗体的新方法。
病毒中和抗体的功能研究主要涉及两方面:病毒结合和中和能力。抗体结合能力通常采用ELISA、生物膜干涉技术 (Biolayer Interferometry, BLI)、流式细胞术(FACS)等方法研究。抗体中和能力通常通过假病毒报告基因或病毒蚀斑减少中和实验(PRNT)来评估。但以上几种方法均存在各自的弊端与局限性(见下表),难以满足严峻疫情下快速高通量筛选的迫切要求。因此,开发快速有效地检测抗体结合和功能的方法,将有助于评估和筛选靶向病毒的抗体。
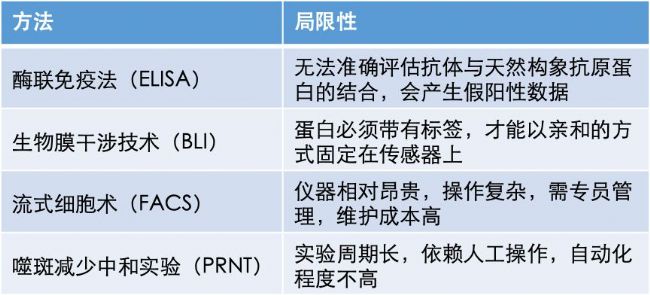
近年来,研究者们开发出了一种称为“HINT” (High Content Imaging-Based Neutralization Test)的方法,通过高内涵成像设备对微孔板中的荧光标记样本进行高速成像和分析,快速得出反映抗体结合与中和能力的实验数据。
SARS-CoV-2 于2020年2月11日被WHO正式命名。它也是继SARS-CoV(严重急性呼吸综合征病毒)和MERS-CoV(中东呼吸综合征病毒)之后人类历史上第三种可引发致命疾病的冠状病毒。这里我们就以NIH在2019年发表的一篇文章为例,给大家详细介绍研究者们如何用Celigo全视野细胞扫描分析仪开展HINT实验来检测和评估MERS-CoV中和抗体的功能的(点击文末“阅读全文”下载文献) 。
MERS-CoV与SARS-CoV-2 的病毒结构类似,在病毒颗粒表面均具有突刺(S)蛋白。S蛋白的原聚体包括两个部分,一个是头部区域(S1),有助于病毒的附着;另一个是茎区(S2),包括融合复合物。MERS-CoV S1进一步分为与宿主细胞受体二肽基肽酶-4(DPP4)结合的受体结合域(RBD)与N-末端结构域(NTD)[1,2]。由于RBD涉及到受体结合,所以目前很多抗体开发都集中于MERS-CoV的RBD [3,4,5]。随着对全长MERS-CoV S蛋白三聚体的结构解析 [6,7],其他区域也成为了潜在的抗体靶点。许多开发出的单克隆抗体在动物模型中已经显示出治疗潜力 [3,4,5,8],而且多克隆抗体也在I期临床中被证明具有安全性 [9],但是尚无MERS-CoV特异性抗体被批准在人体使用。
研究者们利用Celigo全视野细胞扫描分析仪开发了一种高通量蛋白结合抑制检测方法,能直接通过图像和分析判断蛋白或抗体与靶细胞的结合能力。Celigo可以在明场和荧光通道中直接捕获和分析微孔板中用荧光抗体标记的细胞图像,避免了细胞裂解或胰酶消化等过程对细胞自然状态的干扰。Celigo的操作流程十分简单,不需要特殊的材料或耗时的维护。
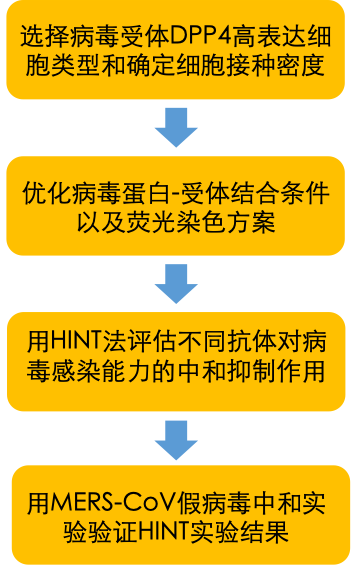
选择DPP4高表达细胞类型用于抗体结合和抑制分析
二肽基肽酶-4 (DPP4)是MERS-CoV进入宿主细胞的受体。为了更好地在细胞水平研究MERS-CoV,研究者们需先建立DPP4高表达株。A549, BHK21和VeroE6细胞被转染了不同浓度的DPP4 质粒。两天后,细胞被固定和染色。Celigo对所有样本进行全孔成像并识别单个细胞的荧光强度。数据以FCS文件导出至FlowJo 10软件进行转染效率分析。BHK-21在0.1 µg质粒浓度显示出了最高表达,因而被选择用于后续分析。
优化用于抗体结合和抑制检测的细胞数
优化细胞接种密度对于基于荧光的细胞分析至关重要。细胞数太少会降低数据的可重复性,细胞数太高可能会造成细胞堆叠,影响分析。研究者们将不同密度的BHK-21细胞接种过夜并转染DPP4, 通过Celigo的明场通道查看和分析细胞形态和融合率,最终选择5×10^3个细胞/孔作为最佳接种密度。
开发基于图像分析的病毒蛋白结合检测方法
为了确定病毒蛋白与DPP4高表达BHK-21细胞结合的适合条件,研究者们对多个参数进行了优化:蛋白构建体(MERS-CoV S三聚体或S1单体),蛋白量(0.1–10 µg)和染色方案(AL488抗His-Tag 抗体、不同的MERS-CoV单克隆抗体和AF488抗MERS-CoV S蛋白抗体 )。在蛋白构建体方面,Celigo的荧光细胞图片显示MERS-CoV S三聚体和S1单体都能有效地结合到细胞上。然而荧光强度分析说明,与S1单体相比,MERS-CoV S三聚体显示出比对照组更大的峰移。此外,利用全长MERS-CoV S三聚体可以评估抗体与整个S蛋白的相互作用。因此,MERS-CoV S三聚体被用于后续的实验。
开发基于图像分析的病毒蛋白结合抑制检测方法
RBD特异性抗体通过阻断S蛋白和DPP4的结合,从而主导了MERS-CoV的宿主免疫原性反应。抗体也可以作用于其他表位,包括NTD和S2区域。研究者们测定了结合MERS-CoV S不同区域的单克隆抗体抑制MERS-CoV S与DPP4表达细胞的结合能力。以下的流程图为该方法的实验步骤。
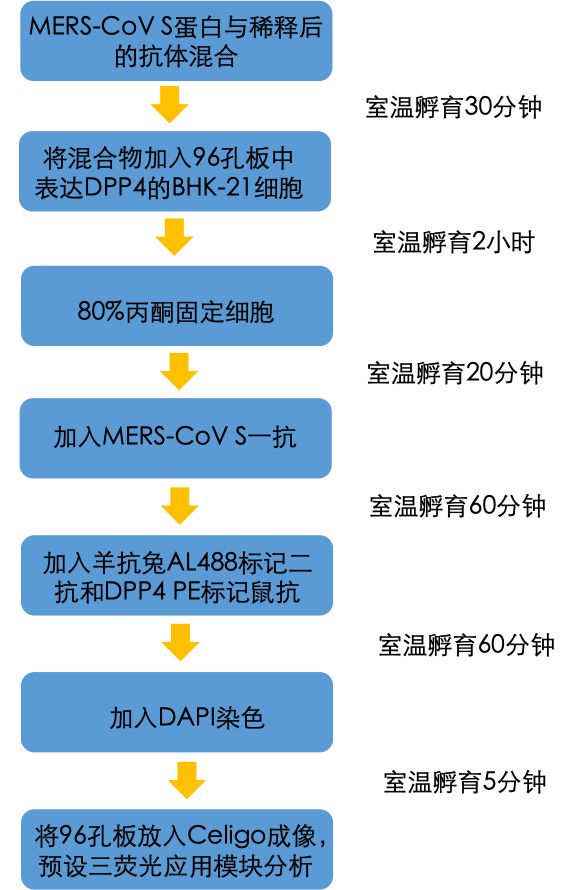
Celigo通过绿色(AL488)、红色(PE)和蓝色(DAPI)荧光通道对样本进行了全孔成像和分析荧光细胞图片显示D12抗体(RBD特异性)(图4A,B)和G2抗体(NTD特异性,数据未显示)均以剂量依赖性方式抑制MERS-CoV S蛋白结合,病毒S蛋白的荧光强度(绿色荧光)随着抗体浓度的降低而减弱。FlowJo分析结果表明这两种抗体具有相似的IC50值(~7.5 nM),和它们已知的与MERS-CoV S的结合常数具有可比性 [5]。此结果与先前证明这些单克隆抗体与MERS-CoV S1结合的BLI实验结果一致。作为阴性对照,G4抗体的结合区域为S2,在空间上与RBD-DPP4的相互作用较远,因此没有显示出任何抑制作用,如图4E所示。
用假病毒中和实验验证结合抑制结果
以往的研究显示,测试的三种单克隆抗体(G2,D12和G4)都可有效中和MERS-CoV假病毒感染天然表达DPP4的Huh 7.5细胞 [5]。为了验证抑制结果的可靠性,研究者们进行了MERS-CoV England 1假病毒中和实验,以确定抗体对表达DPP4的BHK21细胞的中和模式与结合抑制方式是否相似。正如所预期的,G2和D12具有相似的中和曲线(图5),IC50值在0.5–0.8 nM范围内。而G4的IC50(图5)比D12和G2高一个数量级,与结合抑制结果一致。以往的研究也在Huh 7.5细胞中显示出D12 / G2和G4之间存在相同数量级的差异 [5]。
结语
近年来,HINT已被多家机构和制药公司用于病毒的抗体中和能力检测,例如被美国CDC用于H3N2型甲流病毒 [10], MedImmune用于呼吸道合胞病毒 [11],中国食药监局用于H7N9型禽流感病毒等 [12]。HINT中的”Neutralization”(中和)不仅指抗体的中和作用,也可以广义地理解为非抗体类病毒药物/疫苗抑制病毒感染细胞的能力,因此在mRNA、DNA疫苗,佐剂,化学合成药物等的评估中也有很好的应用潜力。Celigo全视野细胞扫描分析仪具有分析整孔细胞的能力,在96孔板中扫描所有样品仅需10-15分钟,并且可以得到细胞数,细胞形态和荧光表达(包括未转染的细胞,细胞面积,平均荧光强度和总荧光强度)等结果。该方法可以快速地优化试验参数,例如细胞接种密度、细胞类型、蛋白选择和染色方法。另外,一块微孔板上可设置多个复孔和比较各种条件组合,能大大降低实验成本。Celigo高通量、高速度的特点以及强大的软件分析能力结合HINT技术可加速抗病毒药物和疫苗的开发,成为研究传染病的一种有价值的工具。
Nexcelom Bioscience对奋战在防疫一线的医护人员和科研人员工作者致以最高崇高的敬意!同时为贡献一份力量,我们将对所有研究新冠病毒的单位和人员提供力所能及的无偿服务与帮助。如有任何需要,请欢迎致电021-5886 0038。
愿我们能赢得这场与病毒的较量,挽救和保护更多的生命!Better tool for better biology for better life!
参考文献
1. Du L, et al., 2013. Identification of a receptor-binding domain in the S protein of the novel human coronavirus Middle East respiratory syndrome coronavirus as an essential target for vaccine development. J. Virol. 87, 9939-9942.
2. Raj VS, et al., 2013. Dipeptidyl peptidase 4 is a functional receptor for the emerging human coronavirus-EMC. Nature 495, 251.
3. Corti D, et al., 2015. Prophylactic and postexposure efficacy of a potent human monoclonal antibody against MERS coronavirus. Proc. Natl. Acad. Sci. 112, 10473-10478.
4. Johnson RF, et al., 2016. 3B11-N, a monoclonal antibody against MERS-CoV, reduces lung pathology in rhesus monkeys following intratracheal inoculation of MERS-CoV Jordan-n3/2012. Virology 490, 49-58.
5. Wang L, et al.,2015. Evaluation of candidate vaccine approaches for MERS-CoV. Nat. Commun. 6, 7712.
6. Pallesen J, et al., 2017. Immunogenicity and structures of a rationally designed prefusion MERS-CoV spike antigen. Proc. Natl. Acad. Sci. 114, E7348-E7357.
7. Yuan Y, et al., 2015. Structural basis for the neutralization of MERS-CoV by a human monoclonal antibody MERS-27. Sci. Rep. 5, 13133.
8. Chen Y, et al., 2017. A novel neutralizing monoclonal antibody targeting the N-terminal domain of the MERS-CoV spike protein. Emrg. Microbes Infect. 6, e37.
9. Beigel JH, et al., 2018. Safety and tolerability of a novel, polyclonal human anti-MERS coronavirus antibody produced from transchromosomic cattle: a phase 1 randomised, double-blind, single-dose-escalation study. Lancet Infect. Dis. 18, 410-418.
10. Jorquera PA, et al., 2019. Insights into the antigenic advancement of influenza A (H3N2) viruses, 2011-2018. Sci Rep. 9, 2676.
11. Shambaugh C, et al., 2017. Development of a high-throughput respiratory syncytial virus fluorescent focus-based microneutralization assay. 24, e00225-17.
12. Tian Y, et al., 2018. Development of in vitro and in vivo neutralization assays based on the pseudotyped H7N9 virus. Sci Rep. 8, 8484.

