Nanolive无标记成像方法在肿瘤细胞和免疫细胞3D成像的应用
2021-09-10 来源:本站 点击次数:330101 要点概括
1.对肿瘤细胞进行连续、长期、无标记的活细胞成像,了解它们对不同治疗的反应以及它们与免疫细胞的相互作用,对于理解药物治疗效果、免疫反应过程以及导致疾病进展的因素等至关重要。
2. Nanolive的无标记成像方法允许研究人员以高时空分辨率、不受干扰、无光毒性的方式监测巨噬细胞、自然杀伤细胞和T细胞对癌细胞的协同反应
3. Nanolive技术使得免疫细胞和癌细胞相互作用过程中发生的细胞形态和行为包括入侵、迁移和转移到细胞死亡的疾病过程的各个阶段的变化变得可视化。还可以对细胞增殖进行定量分析,使研究人员能够比较癌细胞对不同抗体或免疫检查点抑制剂的反应。
4. Nanolive技术无标记,无光毒性,使连续监测活细胞成为可能。因此,它是跟踪细胞共培养中发生的动态互动的理想选择。
02 肿瘤细胞和免疫细胞互作3D无标记成像
本应用有六个案例:检查T细胞、树突状细胞和巨噬细胞之间的相互作用(案例1);Nanolive用于T细胞对癌细胞的反应(案例2)以及T细胞和巨噬细胞之间发生的相互作用(案例3)进行成像;Nanolive活细胞成像用于监测癌细胞对有前景的抗体-药物结合物(ADC)产品(案例4)和新型双特异性抗体(案例5和6)。
案例一:细胞参与天性和适应性免疫
背景
Nanolive技术无标记,无光毒性,使连续监测活细胞成为可能,非常适合高时空分辨率跟踪在共培养中发生的相互作用,以及先天性和适应性免疫系统中不同细胞类型之间的动态互作,且不受基于荧光的成像或终点分析的限制。
试验方法:
从骨髓中分离提前刺激来自C57BL/6小鼠的抗原呈递树突状细胞和巨噬细胞并进行体外分化。然后将它们与来自OT-I小鼠的新鲜分离的幼稚T细胞一起孵育。使用3D Cell Explorer每隔6秒采集一张图像,持续约11分钟。
试验结果:
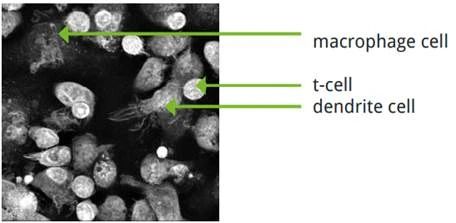
观察内容
1. 由于这三种细胞的大小、密度以及折射率(RI)的不同,我们可以清楚地将它们区分开来。T细胞是最小和最密集的,因此它们在RI图像上看起来最亮。巨噬细胞则相反;这些细胞很大,因此在RI图像中它们较暗。树突状细胞通过其大量的膜突起很容易区分。
2. Nanolive活细胞成像的高时空分辨率使我们能够观察不同细胞类型之间的行为差异。视频中最显著的特征之一是树突状细胞膜突起的动态行为。细胞膜不断以快速、随机的方式延伸出细胞表面,这种行为很可能与细胞感知外界环境信号有关。
3. 树突状细胞包膜含有检测细胞因子、病原体相关和损伤相关分子模式的受体,抑制这些受体并观察其对树突状细胞行为的影响是未来可能研究的课题。
案例二:T细胞和癌细胞互作
背景
免疫系统与癌症之间的关系是复杂而动态的。荧光显微镜是研究免疫细胞和癌细胞之间相互作用最常用的方法,但它有许多局限性,脆弱的原代免疫细胞受到耗时、复杂和昂贵的染色步骤的干扰,受到大量光毒性。相比之下,Nanolive成像提供了一种高分辨率、无标标记的方式对免疫细胞和癌细胞之间的相互作用进行成像。
试验方法:
使用从OT-I小鼠分离的T细胞,其携带对卵清蛋白残基257-264(SIINFEKL肽)有反应的细胞受体,与来自MC38-OVA细胞系和表达卵清蛋白(OVA)抗原的结肠癌细胞一起孵育。
试验结果:
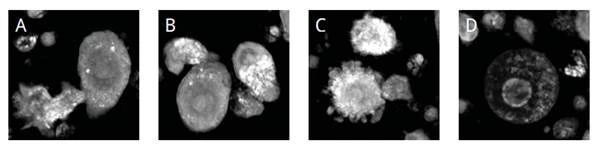
观察内容
1. T细胞和癌细胞之间的相互作用: T细胞接近并连接到结肠癌细胞表面(A)。癌细胞抵抗这种诱导凋亡的接触,但随后吸引了更多的T细胞。
2. 三个T细胞现在包围着癌细胞,并通过不止一个T细胞(B)进行接触。
3. 细胞凋亡被激活,癌细胞收缩并开始失去其结构(C)。
4. 癌细胞被中和(D)。
案例三:T细胞和巨噬细胞互作
背景
Nanolive为确定T细胞和巨噬细胞相互作用的基本动力学提供了一个良好的解决方案,使复杂的细胞间相互作用能够在空间和时间上以清晰的对比度和高分辨率被捕获,从而允许对细胞内的动态的细节进行检查。
试验方法:
从C57BL/6小鼠中分离巨噬细胞,并用卵清蛋白肽、γ-干扰素和脂多糖处理以诱导抗原呈递。从OT-1小鼠中分离T细胞。使用3D Cell Explorer每隔6秒采集一张图像,持续16小时。对z轴上的数据应用后处理数字着色标尺,将空间信息添加到我们的图像中(靠近培养皿底部的细胞为蓝色,而远离培养皿的细胞为粉红色)
试验结果:
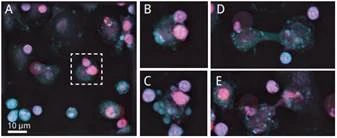
观察内容
1. 由于Nanolive技术的非侵入性和允许长时间连续成像,能够捕捉到T细胞介导的巨噬细胞死亡和巨噬细胞-巨噬细胞循环的镜头。
2. 细胞类型通过其独特的形态很容易识别:巨噬细胞比T细胞大。两个T细胞接近并接触巨噬细胞(A)。这种接触足以使T细胞识别存在于巨噬细胞表面的抗原(B)并引发凋亡(C)。之后,相邻的巨噬细胞识别细胞死亡,并开始吞噬(D)。
3. Nanolive高时空分辨率确保不会遗漏细节,甚至观察到从死细胞到活细胞(E)的囊泡转移。
4. 在后期数字化处理视频突出Nanolive技术的另一个优势:添加有关细胞深度等信息。
案例四:检测抗肿瘤治疗的效果
背景
不断增殖是癌症的重要特征之一。抗体-药物结合物(ADC)是近年来发展起来的一种新型癌症治疗药物。ADC将单克隆抗体的靶向特异性与细胞毒性药物的抗癌能力结合起来,使区分健康细胞和癌细胞成为可能,并大大减少了常规抗癌治疗的副作用。Nanolive的非侵入性、无标记和允许长时间连续监测细胞增殖;保证了测试抗癌治疗有效性和安全性。本案例研究是与瑞士生物技术公司NBE Therapeutics合作进行的。
试验方法:
肿瘤特异性ADC和同型ADC,两种ADC在小鼠乳腺癌细胞系上进行了测试。使用Nanolive每隔2秒拍摄一次图像,持续60小时。将细胞随时间的增殖量化为视野中细胞所占表面积的百分比(%融合度),绘制为线图并覆盖在处理上。
试验结果:
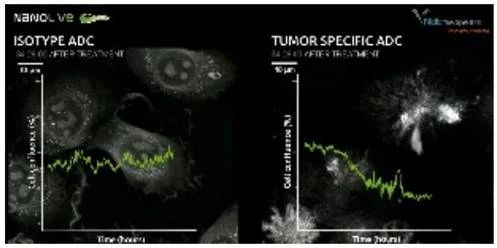
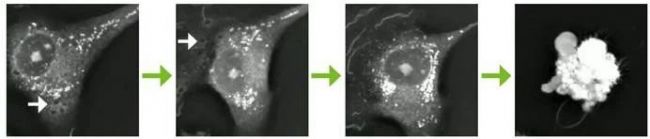
观察内容
1. Nanolive成像60小时,连续监测细胞(每2秒一张图像)。从得到的图像可以很容易地计算出细胞融合率,从而可以量化处理过的细胞群的生长或衰退,并将其与实验对照的性能进行比较。在本病例研究中,暴露于对照同型ADC的细胞分裂不受干扰(A),而暴露于肿瘤特异性性ADC的细胞(B)在同一时期内死亡(给药后34小时30分钟)。
2. 除了能够进行简单的细胞增殖分析外,Nanolive也能够观察细胞在反应过程中发生的形态变化,提供细胞被杀死机制的参照。
3. 在添加肿瘤特异性ADC(白色箭头,A,B)后早期观察到内吞作用(空泡形成)增加。脂滴(细胞内的白色小结构)的分布也发生了变化,在细胞凋亡完成之前聚集在细胞核周围(C)。
4. 活细胞增殖分析与单细胞分辨率的结合是一个强大的组合,可以用来测试多种抗癌药物的有效性和安全性。未来的研究可以考虑对每个细胞面积/质量/体积形成的液泡的数量进行量化,确定是否达到某个阈值才能完成细胞凋亡。
案例五:使用双异性抗体药物提高细胞毒性T细胞的疗效
背景
细胞毒性T细胞是一种强大的效应T细胞,能够杀死带有抗原复合物(肽-MHC)的靶细胞,该抗原复合物由T细胞受体(TCR)识别。然而,大多数T细胞无法识别和杀死肿瘤细胞,因为其TCR缺乏肿瘤特异性。通过在癌细胞上使用针对肿瘤相关抗原(TAA)的双特异性抗体和T细胞上的CD3蛋白复合物结合,可以独立于其TCR的特异性来定向和激活针对肿瘤细胞的任何T细胞。我们使用CX-A的自动网格扫描成像模式,在高时空分辨率下实时跟踪这一过程。这项研究是与瑞士生物技术公司Light Chain Bioscience合作进行的。
试验方法:
人类癌细胞与设计用于靶向癌细胞上的肿瘤相关抗原(TAA)和T细胞上的CD3复合物的双特异性抗体混合,比例为5 T细胞:1癌细胞。使用Nanolive CX-A上的5x5网格扫描模式,以4分钟30秒每帧的速度采集图像。随后拼接生成的图像以显示细胞的群体水平反应。
试验结果:
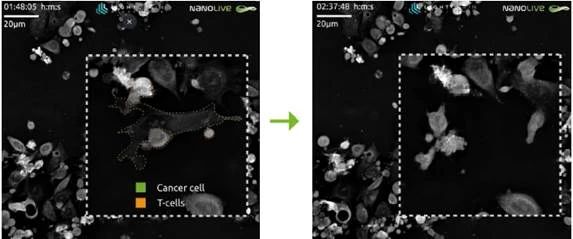
观察内容
CX-A的网格扫描模式产生的大视场使观察TAAxCD3 bsAb对T细胞/癌细胞相互作用的影响成为可能。TAAxCD3 bsAb能够使T细胞更接近其目标癌细胞,从而使T细胞更活跃,T细胞介导肿瘤细胞杀伤。
案例六:检测靶向双特异性抗体CD47的疗效
背景
CD47使癌细胞能够逃避免疫监视和先天免疫细胞(如巨噬细胞)的杀伤。免疫治疗希望使用抗CD47抗体靶向和抑制CD47-SIRPα相互作用,进而激活先天免疫,巨噬细胞破坏癌细胞。该试验展示了Nanolive的无标记成像在临床前测试抗CD47双特异性抗体效力。这项研究是与瑞士Light Chain生物科学公司合作进行的。
试验方法:
将人肿瘤细胞与(1)具有针对肿瘤相关抗原的高亲和力TAAxCD47双特异性抗体(治疗组)或(2)低亲和力CD47 bsAb(对照组)混合,并在人单核细胞源性巨噬细胞存在下培养3小时。使用Nanolive以每30秒一幅图像的速度获取图像。
试验结果:
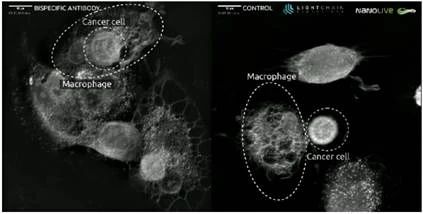
观察内容
由于CD47(A)的阻断,暴露于双特异性抗体的癌细胞被巨噬细胞吞噬并迅速降解。相反,暴露于对照抗体的癌细胞抵抗来自巨噬细胞的攻击,巨噬细胞的吞噬活性(B)受到阻碍。上面的详细画面说明了Nanolive活细胞成像如何评估癌症免疫治疗的新抗体。图像的卓越分辨率允许观察巨噬细胞细胞质中被吞噬的癌细胞的消化情况(部分视频放大)。
结论:
1.自动化、无标记成像,加快了数据收集;
2.捕捉细胞对药物的真实反应,而不是细胞对外界的反应(例如光毒性),保证数据的真实性;
3.产生连续数据,允许细胞响应的时间分辨率;
4.以定量、公正的方式验证功能;
5.由于其捕获多种生物过程的能力,允许进行同时观察。
03 参考文献
1. Germain, R. N., Robey, E. A. & Cahalan,M. D. A Decade of imaging cellular motility and interaction dynamics in the immunesystem. Science (80). 336, 1676–1681 (2012).
2. Wculek, S. K. et al. Dendritic cells incancer immunology and immunotherapy. Nat. Rev. Immunol. 20, 7–24 (2019)
3. Coutu, D. L. & Schroeder, T. Probingcellular processes by long-term live imaging - historic problems and currentsolutions. J. Cell Sci. 126, 3805–3815 (2013).
4. Clarke, S. RMcK. et al. Characterization ofthe ovalbumin-specific TCR transgenic line OT-I: MHC elements for positive andnegative selection. Immunol. Cell Biol. 78, 110–117 (2000).
5. Germain, R. N., Miller, M. J., Dustin, M. L.& Nussenzweig, M. C. Dynamic imaging of the immune system: Progress,pitfalls and promise. Nat. Rev. Immunol. 6, 497–507 (2006).5. Liang W.et al. Sci. Rep. 1;6(1): 1-12 (2016).
6. Hanahan, D. & Weinberg, R.A. Thehallmarks of cancer. Cell. 100(1), 57-70 (2000).
7. Diamantis, N. & Banerji, U. Antibody-drugconjugates - an emerging class of cancer treatment. Br. J. Cancer. 114(4),362-367. (2016).
8. Lambert, J.M. & Berkenblit, A. Antibody-drugconjugates for cancer treatment. Ann. Rev. Med. 69, 191-207 (2018).

