多重基因工程编辑NK细胞助力癌症治疗的策略
2023-05-06 来源:本站 点击次数:2420
达雷木单抗(Daratumumab,DARA)是一种与CD38结合的单抗,在治疗多发性骨髓瘤方面显示具临床疗效,使其成为增强NK细胞输注的一个有吸引力的候选药物。然而,由于循环NK细胞表达高水平的CD38, DARA可导致ADCC依赖的NK自相残杀,限制了这种组合疗法的疗效。结合DARA和过继转移CD38基因敲除的NK细胞具有最大化ADCC并阻止DARA诱导的自相残杀的潜力,增强NK细胞持久性。为了进一步增强它们的功效,NK细胞可以被改造成表达高亲和CD16 (CD16-158V)受体,该受体已被证明可以促进ADCC,从而改善临床结果。
在这里,我们展示了MaxCyte®如何在NK细胞中启用多重基因工程。双编辑NK细胞改善了DARA治疗,增强了体外和体内的抗肿瘤反应。MaxCyte电穿孔技术提供了包括高效率、低毒和临床可扩展性在内的显著优势,使一种有效的癌症治疗方法得以快速发展。
来自Childs实验室的这项令人兴奋的研究使用了互补的基因工程策略来产生具有增强ADCC效力的NK细胞,且在DARA存在下不自相残杀。这些实验表明,MaxCyte电穿孔对细胞活力和功能的影响很小,是一个安全的平台,可以帮助开发基于细胞的癌症治疗方法。
方法
- 从健康供体外周血灰黄层细胞中获取NK细胞。
- 体外扩增分离NK细胞一周。NK细胞与辐照的Epstein–Barr病毒转化的淋巴母细胞饲养细胞和IL-2共培养。
- 使用MaxCyte ATx®和NK-04电穿孔方案将预络合的Cas9和靶向CD38的gRNA递送到扩增的NK细胞。CD16-158V的敲入(KI)通过两种不同的途径完成:电穿孔或AAV转导。
- CD16的瞬时表达ATx®用于传递CD16-158V mRNA在第一次电穿孔7天后转染到CD38KONK细胞中,产生瞬时双编辑NK细胞。
- 稳定CD16KI重组腺相关病毒(rAAV6),含有编码CD16-158V基因的HDR模板,在初始电穿孔30分钟后,将N端FLAG标签添加到CD38KONK细胞中。转导产生稳定CD16-158V在CD38位点的转基因整合.
- 分离工程细胞,采用PCR和流式细胞术对其进行鉴定。分离的NK细胞的功能通过体外杀伤实验和小鼠体内多发性骨髓瘤模型测定。
结果
高效基因敲除
MaxCyte®能够在92%的扩增NK细胞中有效敲除CD38(图1A)。电穿孔对细胞的影响较小,因为转染后几天细胞存活率仍然很高(图1B)。
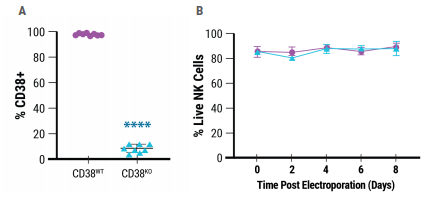
图1.高效基因编辑
A)CD38在野生型(CD38WT)和CD38KO NK细胞中的相对表达。
B)膜联蛋白染色和流式细胞术检测电穿孔后8天NK细胞活力
B)膜联蛋白染色和流式细胞术检测电穿孔后8天NK细胞活力
CD38KO NK细胞的表征
基因工程没有改变NK细胞的增殖或功能特征。未编辑NK细胞和CD38KO NK细胞具有相似的体外扩增率(图2A),并且电穿孔后NK表面受体的表达没有显著改变(图2B)。在靶细胞存在的情况下,通过测量溶酶体相关膜蛋白-1(CD107a)在NK细胞上的表达来确定脱粒,并且在CD38KO和CD38WT细胞中相似(图2C)。此外,NK细胞的细胞毒性在未编辑和工程NK细胞之间具有可比性,这是通过靶细胞存在下细胞内IFN-γ(图2D)和TNF-α(图2E)的产生来确定的。
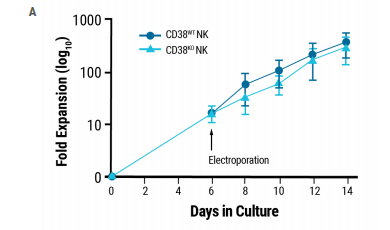

图2.电穿孔后NK细胞的表征
电穿孔后NK细胞的增殖和功能特征保持不变。A)电穿孔后14天CD38KO和CD38WTNK细胞扩增。B-E)用流式细胞术检测CD38KO和CD38WTNK细胞与靶细胞(K562或Raji细胞)共培养后标志物的表达。以利妥昔单抗(RITUX)处理的Raji细胞为阳性对照。B)CD38KO和CD38WTNK细胞表面标记物表达。C)通过CD107a表达测定脱粒。D-E)NK细胞毒性通过细胞内INF-γ和TNF-α的表达测定。
激活CD38KONK细胞
为了确定加入CD16-158V是否可以增强CD38KONK细胞的效力,我们使用电穿孔将CD16-158V mRNA传递到工程细胞中。CD38KONK细胞转染CD16-158V mRNA与经DARA处理的CD38+NCI-H929骨髓瘤细胞共培养时,显示出更好的细胞裂解能力(图3)。MaxCyte电穿孔法证实了CD38KONK细胞表达CD16-158V后可进一步增强效力。
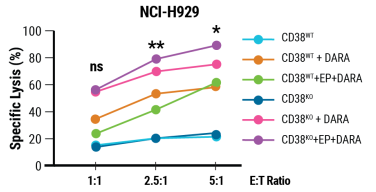
图3.CD16-158V表达增强CD38KONK的功能
电穿孔后一天不同的效靶比(E:T),CD38KONK细胞表达CD16-158V (CD38KO+EP)或不表达CD16-158V存在下,DARA处理的NCI-H929细胞的裂解情况。
多重基因工程技术
通过电穿孔和AAV转导的结合,实现了稳定的多重基因工程。使用CRISPR-Cas9 RNP电穿孔破坏CD38表达,同时重组AAV传递编码CD16-158V的HDR模板。双编辑CD38KO/CD16KINK细胞的生成通过表面FLAG的表达来确定;58%的CD38KO细胞表达CD16-158V(图4A)。双编辑CD38KO/CD16KI NK细胞联合DARA诱导多发性骨髓瘤靶细胞的细胞裂解增加(图4B),并显示MM1.S移植瘤小鼠中肿瘤负荷的最大减少,显示出优越的抗肿瘤活性(图4C)。MaxCyte的电穿孔技术可以与互补的基因工程工具一起使用,比如AAV,开发下一代NK细胞疗法。
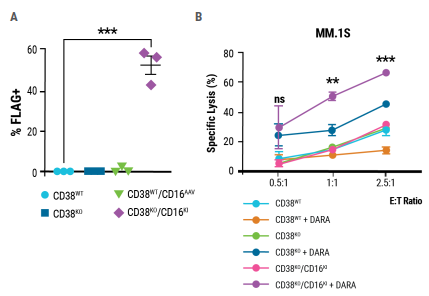
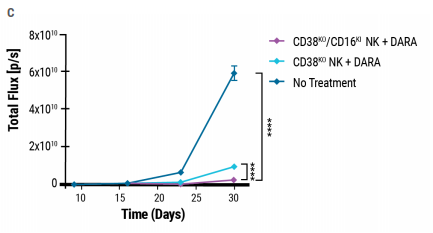
图4.双编辑NK细胞具有较强的抗肿瘤活性
A)在CRISPR-Cas9 RNP电穿孔和AAV转导7天后测量FLAG阳性NK细胞的百分比。B)双编辑(CD38KO/CD16KI)、单编辑(CD38KO)和未编辑(CD38WT) NK细胞在MM.1S靶细胞中增强DARA介导的裂解能力的比较。C)双编辑NK细胞在异种移植小鼠中表现出更高的抗骨髓瘤活性。用于形成肿瘤的MM.1S细胞被慢病毒转导表达萤火虫荧光素酶。在30天内测量MM.1S骨髓瘤肿瘤生长的生物发光定量(光子每秒或总通量)。
结论及未来应用
高效过继NK细胞转移和单克隆抗体联合治疗是一种很有潜力的癌症治疗策略。MaxCyte的电穿孔技术与AAV转导相结合,为NK细胞的多重基因工程开发了一种易于适应的工作流程。利用MaxCyte®电穿孔技术实现的高效率CD38敲除消除了对工程细胞额外富集步骤的需要。此外,随着时间的推移,CD38表达的减少是稳定的,并赋予DARA诱导的NK自相残杀行为耐药性。电穿孔不会损害编辑NK细胞的功能或增殖能力。MaxCyte电穿孔也被用来用高亲和力CD16-158V修饰CD38KO细胞,增强它们在DARA存在下的细胞毒性。电穿孔和AAV转导的结合导致了双编辑NK细胞的高效生产。CD38KO/CD16KI NK细胞在体外和体内均增强了DARA的抗肿瘤活性。MaxCyte为NK细胞的多重工程开发了一种简化的工作流程,当与DARA结合时,代表了一种令人兴奋的组合免疫治疗策略,可以完美地进入临床。
参考文献
1. Wang Y, Zhang Y, Hughes T, et al. Fratricide of NK Cells in Daratumumab Therapy for Multiple Myeloma Overcome by Ex Vivo-Expanded Autologous NK Cells. Clin Cancer Res. 2018;24(16):4006-4017. doi:10.1158/1078-0432.CCR-17-3117.
2. Clara JA, Levy ER, Reger R, Barisic S, Chen L, Cherkasova E, Chakraborty M, Allan DSJ, Childs R. High-affinity CD16 integration into a CRISPR/Cas9-edited CD38 locus augments CD38-directed anti-tumor activity of primary human natural killer cells. J Immunother Cancer. 2022 Feb;10(2):e003804. doi: 10.1136/jitc-2021-003804. PMID: 35135865; PMCID: PMC8830298.
关于MaxCyte
MaxCyte (NASDAQ: MXCT)作为全球领先的细胞工程解决方案供应商,新一代ExPERT流式电转技术,作为专利性的非病毒GMP细胞工程平台,为创新型细胞和基因疗法插上翅膀,提供符合临床治疗和商业化的电转平台,MaxCyte已被全球范围内用户认可,全球前十制药公司都采用MaxCyte技术平台进行药物研发,支持了全球超过75个细胞与基因治疗临床项目,帮助加快科研到临床转化的进程。帮助合作伙伴释放它们产品的所有潜能,为全球生物医药行业的合作伙伴赋能。
相关文章
更多 >

