使用CP-NX超速离心机和P40ST水平转子从大鼠小脑中纯化抗去污剂膜筏
2023-06-26 来源:本站 点击次数:4357
Kohji Kasahara1, Shuichi Kani2, Jan Knop3, Martin Armbrecht3
1Tokyo Metropolitan Institute of Mecical Science, Tokyo, Japan; 2Eppendorf Himac Technologies, Tokyo, Japan; 3Eppendorf SE, Hamburg, Germany

图2:CP-NX系列超速离心机(A)和P40ST水平转子(B)
方法
膜筏组分的分离共分两步进行:
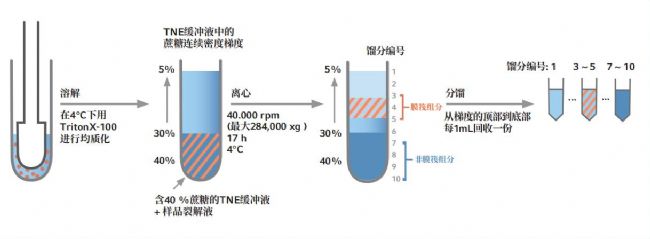
图3:通过一系列非连续蔗糖梯度离心步骤分离膜筏组分
结果验证
如此前文章所述 4,可以使用 SDS-PAGE 和免疫印迹法,通过以下蛋白质标记物来检查是否成功纯化膜筏组分:
1)Csk-binding protein (Cbp) 和 Flotillin (Flt):鉴定脂筏组分(第 3-5 号组分)
2)Calnexin (Cnx) 和 Transferrin receptor (TfR):鉴定非脂筏组分(第 7-10 号组分)
结论
在本方案中,我们展示了如何将 CP-NX 系列超速离心机与P40ST 水平转子以及 13 PA 离心管搭配使用,通过密度梯度离心法完成膜筏的分离。
该方法也发表在“Involvement of Gangliosides in the Process of Cbp/PAG Phosphorylation by Lyn in Developing Cerebellar Growth Cones.”一文中。
参考文献
[1] Hartlova et al., “Membrane Rafts: A potential Gateway for Bacterial Entry into Host Cells,
” Microbiol Immunol 54 (2010): 237–245.
[2] Chazal et al., “Virus Entry, Assembly, Budding, and Membrane Rafts,” Microbiology and Molecular Biology Reviews 67,
no. 2 (June 2003): 226–237.
[3] Kohei Yuyama et al., “Translocation of Activated Heterotrimeric G Protein Gαo to Ganglioside-Enriched Detergent-
Resistant Membrane Rafts in Developing Cerebellum,” Journal of Biological Chemistry 282, no. 36 (2007): 26392–26400.
[4] Naoko Sekino-Suzuki et al., “Involvement of Gangliosides in the Process of Cbp/PAG Phosphorylation by Lyn in
Developing Cerebellar Growth Cones,” Journal of Neurochemistry 124 (2013): 514–522.
[5] Kohji Kasahara, “Physiological Functions of Glycosphingolipids in Transmembrane Signaling,” Tokyo Metropolitan
Institute of Medical Science website: https://www.igakuken.or.jp/biomembrane/english.html.
1Tokyo Metropolitan Institute of Mecical Science, Tokyo, Japan; 2Eppendorf Himac Technologies, Tokyo, Japan; 3Eppendorf SE, Hamburg, Germany
引言

本文中,我们介绍了一种使用密度梯度超速离心法分离细胞膜特殊区域⸺“ 脂筏 ”的方法(图 1)。脂筏不同于细胞膜的其余部分,其脂质和蛋白质组分发生了改变。它们在信号转导和调控过程中发挥着特殊作用。此外,脂筏也可能成为细菌和病毒感染的入口。1,2“ 脂筏 ”(lipid raft)一词来源于漂浮在水面上的木筏形象,而整个细胞膜可以形象地比喻为水面。脂筏不溶于表面活性剂,可以使用非离子型表面活性剂处理,并在蔗糖密度梯度溶液中进行离心,从而从细胞膜上去除。然后,可以在中密度和低密度介质液区域对其进行回收。超速离心法是对细胞膜微结构域内的目标分子进行定位的
标准方法之一。在本文中,我们展示了搭配使用 CP-NX 系列超速离心机与P40ST 水平转子(图 2),通过密度梯度离心法从发育中的小脑组织中纯化抗去污剂膜 (Detergent-resistant membrane,DRM) 筏的方法。3,4

图 1:脂筏及其在膜中的典型组分概述 5(TAG-1 = 瞬时轴突糖蛋白;Goa = GTP结合蛋白的亚基家族;Lyn = Src 家族激酶;Cbp = CREB 结合蛋白)。
本文中,我们介绍了一种使用密度梯度超速离心法分离细胞膜特殊区域⸺“ 脂筏 ”的方法(图 1)。脂筏不同于细胞膜的其余部分,其脂质和蛋白质组分发生了改变。它们在信号转导和调控过程中发挥着特殊作用。此外,脂筏也可能成为细菌和病毒感染的入口。1,2“ 脂筏 ”(lipid raft)一词来源于漂浮在水面上的木筏形象,而整个细胞膜可以形象地比喻为水面。脂筏不溶于表面活性剂,可以使用非离子型表面活性剂处理,并在蔗糖密度梯度溶液中进行离心,从而从细胞膜上去除。然后,可以在中密度和低密度介质液区域对其进行回收。超速离心法是对细胞膜微结构域内的目标分子进行定位的
标准方法之一。在本文中,我们展示了搭配使用 CP-NX 系列超速离心机与P40ST 水平转子(图 2),通过密度梯度离心法从发育中的小脑组织中纯化抗去污剂膜 (Detergent-resistant membrane,DRM) 筏的方法。3,4

图2:CP-NX系列超速离心机(A)和P40ST水平转子(B)
方法
膜筏组分的分离共分两步进行:
第一步,制备蔗糖密度梯度离心的样品:
离心机和配件:
> CP-NX 系列超速离心机
> P40ST 转子和 13PA 离心管
参数:
> 转速:40,000 rpm (RCF: 最大 284,000 x g)
> 时间:17 h
> 温度:4°C
> 加速模式:8
> 减速模式:8
> 样品体积:4 mL
> 密度梯度溶液:6 mL
试剂:
> TNE 缓冲液 (25 mM Tris-HCl, 150 mM NaCl, 1 mM EGTA, pH 7.5)
> 含 5% (w/v) 蔗糖的 TNE 缓冲液
> 含 30% (w/v) 蔗糖的 TNE 缓冲液
Protocol:
> 将 4mL 样品置于 13PA 离心管底部
> 向样品中加入一层 6 mL 含 TNE 缓冲液的连续蔗糖密度梯度溶液(5%-30% [w/v])
> 将离心管放入 P40ST 转子中,并在 40℃下以 40,000rpm(最大 284000 x g)的速度离心 17 小时
> 离心后,按如下方式进行分馏:从顶部到底部依次收获 1 mL 组分,共 10 份,命名为 1-10
> 脂筏 DRM 位于 3-5 号组分中(见图 3)
> 使用 SDS-PAGE/ 免疫印迹分析法进行组分鉴定
| 样品 预 溶解 |
试剂 | 步骤 |
| > TNE 缓冲液 (25 mM Tris-HCl, 150 mM NaCl, 1 mM EGTA, pH 7.5) > 含 1% (w/v) Triton X-100 的 TNE 缓冲液 > 含 80% (w/v) 蔗糖的 TNE 缓冲液 |
1. 将大鼠小脑颗粒细胞 * 悬浮于 2 mL 含 1% (w/v) Triton X-100 的 TNE 缓冲液中 2. 搅匀溶液 3. 添加含 80% (w/v) 蔗糖的 TNE 缓冲液 4. 通过上下来回吹吸混合物,彻底混合整个溶液 样本总体积:4mL |
*原代培养大鼠小脑颗粒神经元/分离自7日龄大鼠
蔗糖密度梯度离心
提取膜筏
离心机和配件:
> CP-NX 系列超速离心机
> P40ST 转子和 13PA 离心管
参数:
> 转速:40,000 rpm (RCF: 最大 284,000 x g)
> 时间:17 h
> 温度:4°C
> 加速模式:8
> 减速模式:8
> 样品体积:4 mL
> 密度梯度溶液:6 mL
试剂:
> TNE 缓冲液 (25 mM Tris-HCl, 150 mM NaCl, 1 mM EGTA, pH 7.5)
> 含 5% (w/v) 蔗糖的 TNE 缓冲液
> 含 30% (w/v) 蔗糖的 TNE 缓冲液
Protocol:
> 将 4mL 样品置于 13PA 离心管底部
> 向样品中加入一层 6 mL 含 TNE 缓冲液的连续蔗糖密度梯度溶液(5%-30% [w/v])
> 将离心管放入 P40ST 转子中,并在 40℃下以 40,000rpm(最大 284000 x g)的速度离心 17 小时
> 离心后,按如下方式进行分馏:从顶部到底部依次收获 1 mL 组分,共 10 份,命名为 1-10
> 脂筏 DRM 位于 3-5 号组分中(见图 3)
> 使用 SDS-PAGE/ 免疫印迹分析法进行组分鉴定
完整的膜筏分离方法
图3:通过一系列非连续蔗糖梯度离心步骤分离膜筏组分

图3:通过一系列非连续蔗糖梯度离心步骤分离膜筏组分
结果验证
如此前文章所述 4,可以使用 SDS-PAGE 和免疫印迹法,通过以下蛋白质标记物来检查是否成功纯化膜筏组分:
1)Csk-binding protein (Cbp) 和 Flotillin (Flt):鉴定脂筏组分(第 3-5 号组分)
2)Calnexin (Cnx) 和 Transferrin receptor (TfR):鉴定非脂筏组分(第 7-10 号组分)
结论
在本方案中,我们展示了如何将 CP-NX 系列超速离心机与P40ST 水平转子以及 13 PA 离心管搭配使用,通过密度梯度离心法完成膜筏的分离。
该方法也发表在“Involvement of Gangliosides in the Process of Cbp/PAG Phosphorylation by Lyn in Developing Cerebellar Growth Cones.”一文中。
参考文献
[1] Hartlova et al., “Membrane Rafts: A potential Gateway for Bacterial Entry into Host Cells,
” Microbiol Immunol 54 (2010): 237–245.
[2] Chazal et al., “Virus Entry, Assembly, Budding, and Membrane Rafts,” Microbiology and Molecular Biology Reviews 67,
no. 2 (June 2003): 226–237.
[3] Kohei Yuyama et al., “Translocation of Activated Heterotrimeric G Protein Gαo to Ganglioside-Enriched Detergent-
Resistant Membrane Rafts in Developing Cerebellum,” Journal of Biological Chemistry 282, no. 36 (2007): 26392–26400.
[4] Naoko Sekino-Suzuki et al., “Involvement of Gangliosides in the Process of Cbp/PAG Phosphorylation by Lyn in
Developing Cerebellar Growth Cones,” Journal of Neurochemistry 124 (2013): 514–522.
[5] Kohji Kasahara, “Physiological Functions of Glycosphingolipids in Transmembrane Signaling,” Tokyo Metropolitan
Institute of Medical Science website: https://www.igakuken.or.jp/biomembrane/english.html.
相关文章
更多 >

