CERO 3D细胞类器官培养系统在推动iPSC衍生CAR-巨噬细胞研究中的应用
2024-11-18 来源:本站 点击次数:1458在癌症免疫治疗领域,巨噬细胞疗法备受瞩目,但面临诸多挑战。传统的巨噬细胞来源受限,而人类诱导多能干细胞(iPSC)的应用为规模化生产提供了可能。由Shifaa M. Abdin等人发表于《Journal for ImmunoTherapy of Cancer》中的‘规模化生产功能性人类诱导多能干细胞(iPSC)衍生的嵌合抗原受体(CAR)巨噬细胞,这些巨噬细胞能有效清除CD19阳性的白血病细胞’,CERO 3D细胞类器官培养系统发挥关键作用,推动了功能性人类 iPSC 衍生 CAR - 巨噬细胞研究取得重要成果。
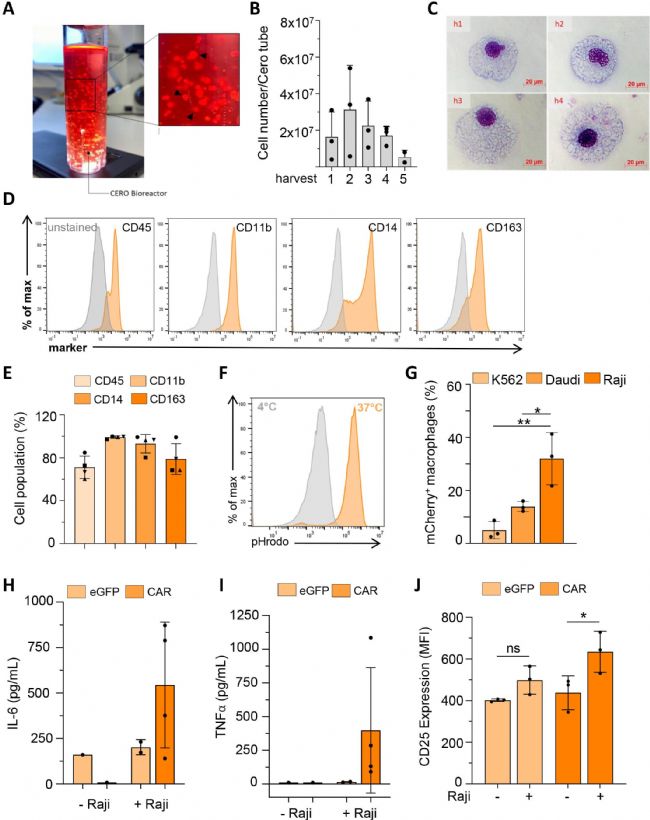
CERO 3D细胞类器官培养系统在生成CAR-iMacs(嵌合抗原受体巨噬细胞)的研究中至关重要,它实现了中间规模的细胞培养,并为诱导多能干细胞(iPSCs)的扩增和分化提供了受控环境。CERO的独特环境能确保细胞在培养中保持良好状态,有效激活T细胞,增强抗癌能力,同时精确控制旋转速度、温度和气体交换等培养条件,对维持细胞健康和促进分化至关重要。研究人员利用 CERO,实现了 CAR - iMacs 的连续规模化生产。其产量稳定,质量、纯度和功能一致,为癌症治疗带来新希望。

研究背景
- 癌症免疫治疗进展:癌症免疫治疗成为抗癌治疗的重要手段,嵌合抗原受体(CAR)修饰的免疫细胞疗法备受关注,但 CAR - T 细胞和 CAR - NK 细胞在实体瘤治疗中面临挑战。
- CAR - 巨噬细胞的潜力与局限:巨噬细胞因其浸润肿瘤能力而成为抗癌治疗的潜在细胞类型,CAR - 巨噬细胞在临床前研究中显示出一定疗效,但临床转化受限于患者单核细胞产量低和体外扩增技术不足,以及巨噬细胞基因工程效率低等问题。
- iPSC 作为巨噬细胞来源的优势:人类诱导多能干细胞(iPSC)具有无限增殖和分化潜能,可作为大规模生产基因工程造血免疫细胞的平台,为 CAR - 巨噬细胞的临床应用提供了可能。
研究方法
1. CAR 构建体与载体生产:构建抗 CD19 的 CAR 序列并克隆到慢病毒载体,制备 CAR 和对照载体。2. 细胞来源与处理
2.1 培养多种癌细胞系(如 RAJI、K562、DAUDI)和患者来源的 ALL 细胞样本。
2.2 从脐带血中分离 CD34 + 细胞,进行慢病毒转导和分化为巨噬细胞,转导 CAR 或对照载体。
2.3 培养 iPSC 并诱导分化为巨噬细胞(iMacs),转导 CAR 或对照载体。
3.2 碱性磷酸酶染色、细胞离心涂片、流式细胞术、Western blot 等检测细胞特性。
3.3 吞噬实验(pHRodo)、共培养实验评估巨噬细胞对癌细胞的吞噬和杀伤能力。
3.4ELISA、多重测定法检测细胞因子分泌。
研究结果
- CD34 + 细胞来源的 CAR - 巨噬细胞特征:CAR 表达不影响巨噬细胞典型表型和基本吞噬能力。
- CAR - iMacs 的抗癌功能
- CD34 + 细胞来源的 CAR - 巨噬细胞功能:与 CD19 + 白血病细胞共培养时,CAR - 巨噬细胞吞噬能力增强,细胞因子分泌增加。
- iPSC 来源的 CAR - iMacs 的生成与特性:成功构建 CAR - iMacs,其生产可持续数月,CAR 表达不改变 iMacs 表型,且具有基本吞噬和分泌功能。
- CAR - iMacs 的分子特征:scRNA - seq 显示 CAR - iMacs 在共培养后具有促炎表型,基因表达与 eGFP 巨噬细胞不同,表现出更强的抗病毒反应和细胞因子介导的反应。
- CAR - iMacs 的规模化生产:使用生物反应器系统实现 CAR - iMacs 的连续规模化生产,产量稳定,质量、纯度和功能一致,对抗原依赖性功能和细胞因子分泌能力保持良好,能激活 T 细胞,在免疫抑制条件下仍保持促炎表型。
研究结论
- 利用脐带血 CD34 + HSPCs 和人 iPSCs 成功生成功能性和抗原特异性 CAR - 巨噬细胞,iPSCs 具有诸多优势,可用于大规模生产 CAR - iMacs。
- CAR - iMacs 对 CD19 + 目标细胞具有时间和抗原依赖性吞噬能力,CAR 构建体促进促炎微环境,scRNA - seq 揭示其信号通路和免疫反应模式。
- 引入CERO 3D细胞类器官培养系统可实现 CAR - iMacs 的规模化生产,为 CAR - 巨噬细胞疗法的临床应用提供了创新平台,有助于深入了解其分子机制。
CERO不仅优化了细胞培养流程,还为深入探究 CAR - 巨噬细胞的分子机制提供了有力支持。这一研究成果充分展示了 CERO 在推动细胞治疗技术发展中的重要价值,为癌症免疫治疗的未来研究和临床应用奠定了坚实基础。选择 CERO ,助力您在细胞治疗领域开启新征程。

