蛋白纯化过程中His标签蛋白纯化填料的选择指南
2024-11-22 来源:博格隆微信公众号 点击次数:1209蛋白纯化是重组蛋白生产流程中关键的下游步骤(Fig.1)。由于重组蛋白自身在化学与结构上的多样性,亲和标签已成为实现高通量蛋白纯化的有效手段,可在复杂背景下特异性富集低丰度蛋白,不仅可以提高目标蛋白质的产量还可赋予目标蛋白质新的特性[1]。
His-Tag(通常为 6 个组氨酸)作为目前最常用的蛋白质纯化亲和标签[2],具有以下特点:
• 分子量小,易表达,免疫原性低
• 可与其他标签构建组合标签
• 洗脱条件温和,易于再生
• 成本低
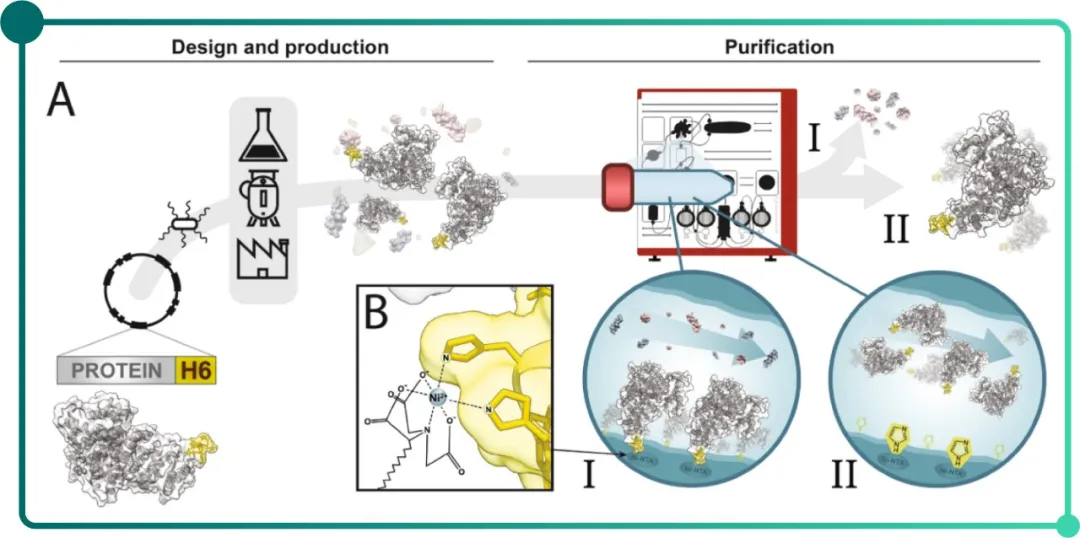
Fig. 1 A. 通过与目标蛋白基因融合的His 标签获得纯重组多肽流程示意图
B. Ni-NTA 和组氨酸咪唑环之间配位键的放大显示[3]
注:活动顺序涉及基因设计、克隆、细胞转化、生产、
基于 His 标签在镍柱(I)中结合,
随后使用咪唑(II)进行洗脱。
组氨酸残基中咪唑环的给电子体基团可与金属形成配位键[4],因此,在纯化过程中,改变标签蛋白与金属离子之间作用力的强弱即可纯化目标蛋白。
纯化时,通常选择在缓冲液中加入高浓度的咪唑,咪唑与组氨酸标签蛋白竞争性结合金属离子,将目标蛋白洗脱下来。
此外,也可适当降低缓冲液 pH,以此减弱标签蛋白与金属离子结合能力,达到蛋白分离纯化的目的。
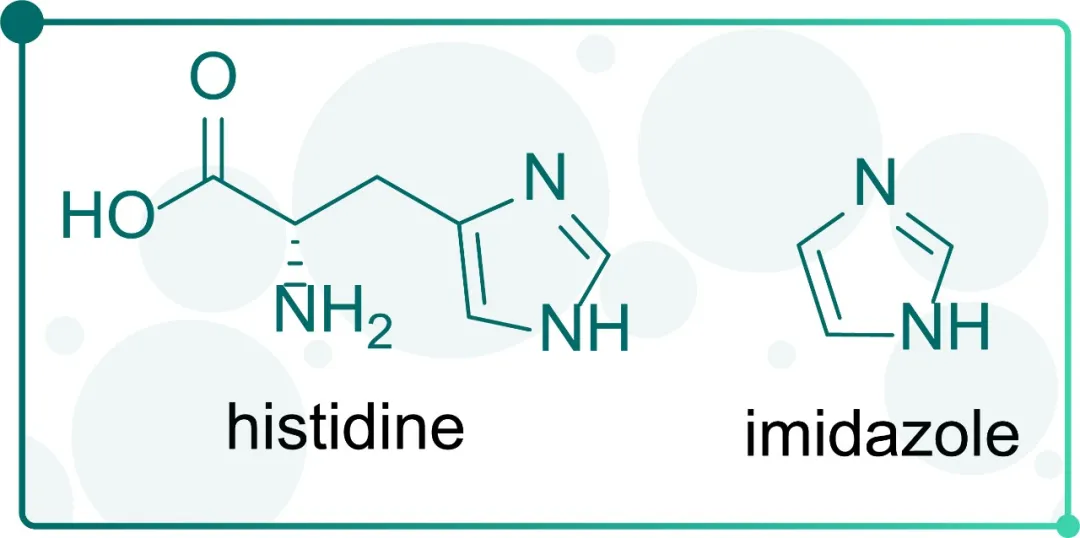
Fig. 2 组氨酸与咪唑结构式
针对 His 标签蛋白的纯化,博格隆提供了三类 His 标签纯化产品(Fig.3),包括已鳌合 Ni²⁺ 的 Ni Bestarose FF/HP 以及未预先鳌合金属离子的 IMAC Bestarose FF/HP 与 Chelating Bestarose FF。
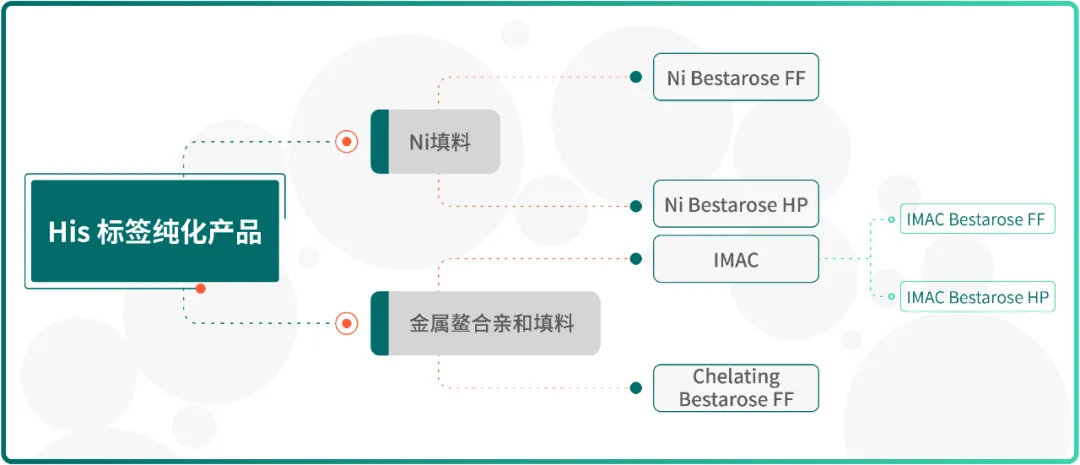
Fig.3 博格隆 His 标签纯化产品
Ni Bestarose FF/HP 是将金属离子 Ni²⁺ 鳌合在以氨三乙酸(NTA)为配基的 6% 高度交联的琼脂糖凝胶上的亲和层析介质。
其中,Ni Bestarose FF 平均粒径为 90 μm,具有载量高、流速快、易再生等优点;Ni Bestarose HP 平均粒径为 34 μm,相较于 Ni Bestarose FF,具有更高的分辨率。
IMAC Bestarose HP/FF 与 Chelating Bestarose FF 均是未预先鳌合金属离子的介质,可供客户自行选择金属离子(Co²⁺、Cu²⁺、Zn²⁺、Ca²⁺等)进行偶联。
IMAC 与 Chelating 在配位方式上有所不同,Chelating Bestarose FF 介质的配基可提供 3 个配位位点同金属离子螯合,同时提供 3 个离子键结合部位高亲和地纯化目的蛋白;IMAC Bestarose FF 介质提供 4 个配位位点同金属离子螯合,2 个离子键结合部位纯化目的蛋白(Fig. 4)。
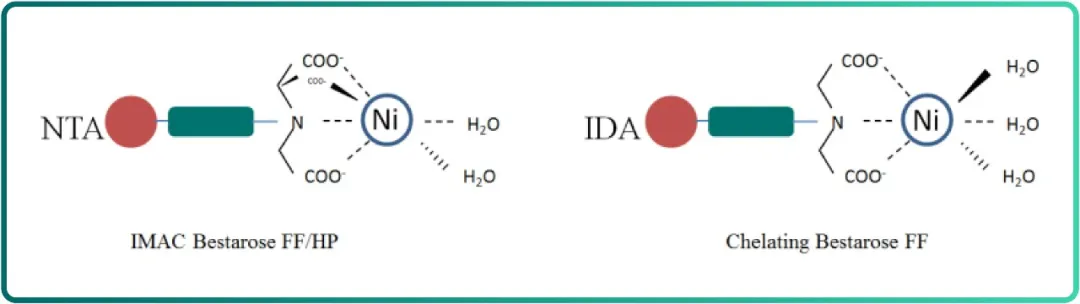
Fig.4 氨三乙酸(NTA)与亚氨基二乙酸(IDA)配位方式
在相同的配基密度、相同金属离子条件下,Chelating Bestarose FF 介质较 IMAC Bestarose FF 的亲和力更强,但同时 IMAC Bestarose FF 介质因为多一个金属离子螯合位点,结合金属离子的能力更强,还可以同还原剂 DTT 及 β- 巯基乙醇兼容。因此,在纯化重组组氨酸标签蛋白时应根据蛋白特点选择介质。
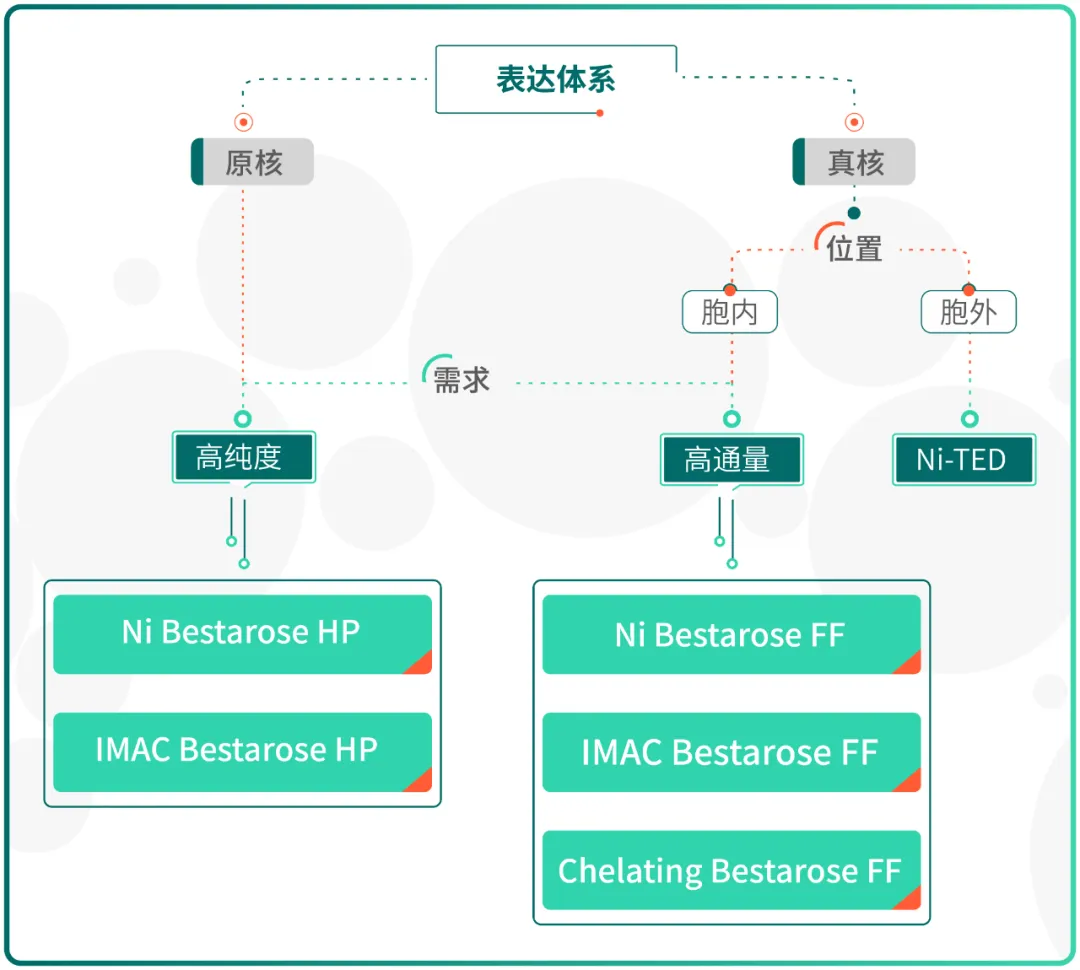
Fig.5 His 标签蛋白纯化亲和填料选择指南
使用 Ni Bestarose FF 纯化带有 His 标签的荧光蛋白
• 填料:Ni Bestarose FF (1 mL EzFast);
• 样品:大肠杆菌裂解液;
• Buffer A:25mM咪唑 pH 7.0;
• Buffer B:500mM咪唑 pH 7.0;
• 流速:1 mL/min。
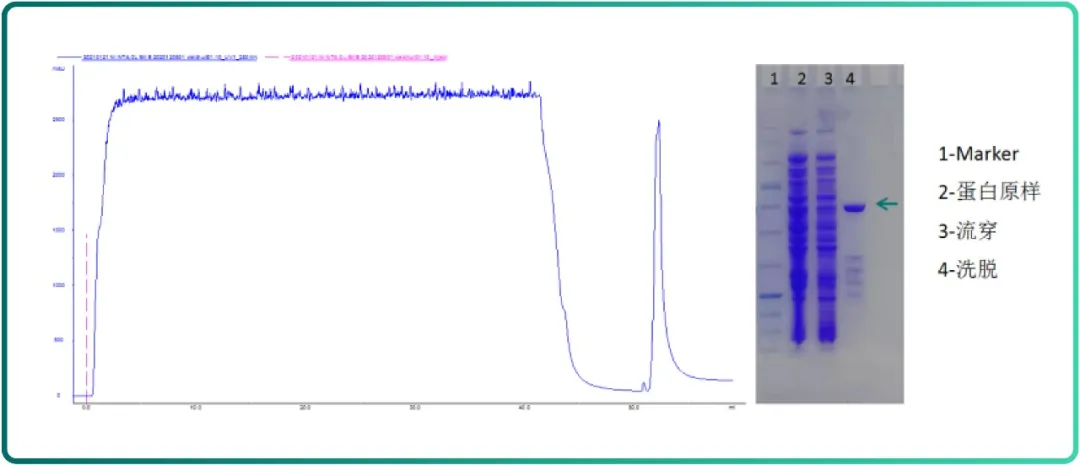
Fig.6 Ni Bestarose FF 纯化荧光蛋白层析图谱及SDS-PAGE 结果
如 Fig.6 所示,Ni Bestarose FF 具有良好的纯化效果。
Tips:由于 Ni 柱不可耐受 DTT、EDTA 等强还原剂与强螯合剂,一般在进行蛋白纯化之前建议通过透析或脱盐的方式进行置换缓冲液。
在产品选择方面,推荐使用 Bestdex G-25 M 凝胶过滤填料或预装柱进行脱盐或缓冲液置换。
Bestdex G-25 M 具有亲水多孔的特点,利用分子筛原理可快速便捷地处理高达脱盐柱总体积 30% 的样品,有效提高His标签蛋白与 Ni 柱结合能力,同样经 Ni 柱纯化后的洗脱样品也可使用 Bestdex G-25 M 去除高浓度咪唑。
Table1.Ni填料技术参数
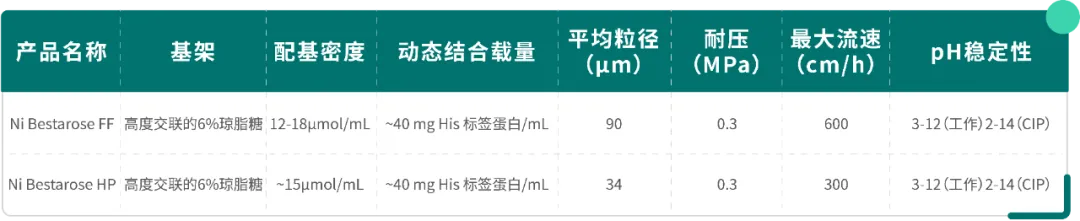
Table2.金属鳌合亲和填料技术参数
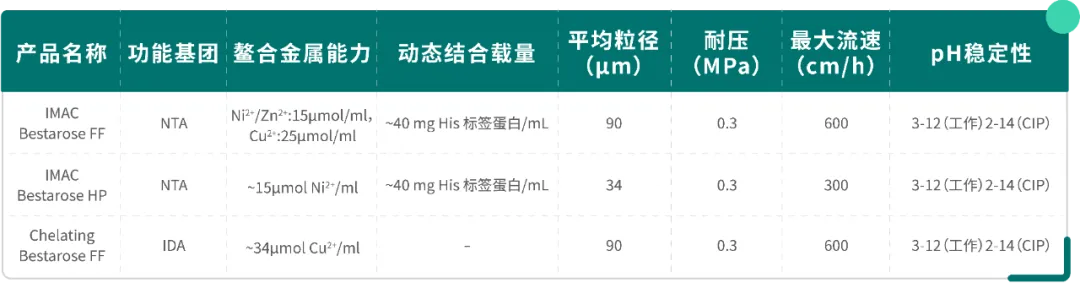
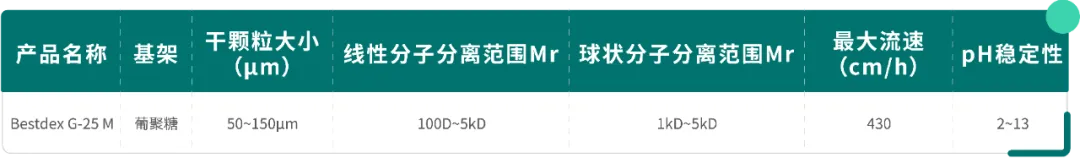
Table3.Bestdex G-25 M技术参数
参考文献
[1] Loughran ST, Bree RT, Walls D. Purification of Polyhistidine-Tagged Proteins. Methods Mol Biol. 2017; 1485:275-303.
[2] Waugh DS. Making the most of affinity tags. Trends Biotechnol. 2005 Jun;23(6):316-20.
[3] López-Laguna H, Voltà-Durán E, Parladé E, Villaverde A, Vázquez E, Unzueta U. Insights on the emerging biotechnology of histidine-rich peptides. Biotechnol Adv. 2022 Jan-Feb; 54:107817.
[4] Watly J, Simonovsky E, Wieczorek R, Barbosa N, Miller Y, Kozlowski H. Insight into the coordination and the binding sites of Cu (2+) by the histidyl-6-tag using experimental and computational tools. Inorg Chem. 2014 Jul 7;53(13):6675-83.

