可温和条件下高分辨率检测m6A修饰的新m6A测序方法开发研究
2025-04-28 来源:本站 点击次数:456
RNA和DNA中的化学修饰在多种生物过程中发挥着关键作用,包括转录调控、RNA降解、蛋白质翻译和免疫调节等。这些修饰已被新的测序方法以单碱基分辨率定量地绘制出来,其中核苷酸脱氨基是一种高效策略,用于选择性地绘制DNA中的5-甲基胞嘧啶(5-methylcytosine)和RNA中的N6-甲基腺苷(m6A)。然而,传统的化学脱氨基方法依赖于在苛刻的酸性条件下使用芳基重氮盐,这限制了其在大多数生物底物中的应用。近年来,基于亚硝酸盐离子的RNA测序方法(如NO-seq和NT-seq)虽然简单且成本效益高,但低转化效率和苛刻的酸处理可能会导致RNA降解,从而影响检测的准确性。此外,GLORI方法虽然提高了脱氨基效率和选择性,但仍受到RNA降解和逆转录停止的限制,需要大量的RNA输入。
为了开发一种温和的化学脱氨基反应,以克服传统方法的局限性。近日,芝加哥大学何川团队通过设计一种接近中性pH值的温和化学脱氨基反应,不仅可以显著保护RNA,还能提高信噪比,从而实现对m6A位点的灵敏且稳健绘制。这种方法有望为研究m6A修饰在基因表达调控中的作用提供有力的工具,推动RNA修饰领域的研究进展。相关成果以《Small-molecule-catalysed deamination enables transcriptome-wide profiling of N6-methyladenosine in RNA》为题,发表于Nature子刊《Nature Chemistry》。

标题:Small-molecule-catalysed deamination enables transcriptome-wide profiling of N6-methyladenosine in RNA
发表时间:2025-4-17
发表期刊:Nature Chemistry
影响因子:IF19.2/Q1
单位:芝加哥大学
研究方法
研究者采用一种N-亚硝化策略,通过羰基有机催化剂和路易斯酸催化剂的协同催化作用,实现对RNA中腺苷(A)的脱氨基反应,将其转化为次黄嘌呤(I)。这种方法被称为化学协同催化辅助m6A测序(chemical cooperative catalysis-assisted m6A sequencing,CAM-seq)。具体实验步骤如下: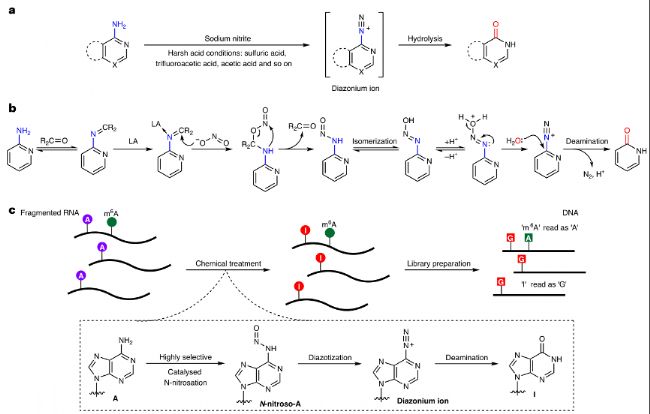
图1:羰基有机催化剂和路易斯酸催化的一级胺协同脱氨基反应。
a. 在苛刻的酸性条件下,亚硝酸盐离子通过逐步的亚硝化和重氮化反应介导脱氨基作用。
b. 本研究和GLORI-seq:由羰基有机催化剂和路易斯酸(LA)催化的协同脱氨基反应。
c. 全转录组m6A测序的m6A-CAM-seq方法示意图。RNA样本被片段化,并在优化的条件下进行处理,随后进行纯化和测序文库制备。
研究结果
(1)温和条件下对底物进行一般脱氨基处理
研究者在温和条件下对多种核苷酸底物进行了脱氨基反应,发现甘油醛与硼酸三氟化物乙醚(BF3·OEt2)组合能高效脱氨基广泛的核苷酸底物。通过改变羰基催化剂,从二羰基有机催化剂改为单羰基有机催化剂(如糠醛),可以显著提高鸟苷类似物的脱氨基产率。研究者推测这可能是因为鸟苷类似物在位置6处可以与甘油醛环化,形成鸟苷-甘油醛加合物。

d. 在优化的催化条件下,对甲基化核苷进行反应。
(2)阐明反应机制
通过15N核磁共振(NMR)光谱学跟踪反应过程,研究者发现,在没有路易斯酸的情况下,15N6腺苷与甘油醛的缩合反应非常缓慢,即使在50℃下加热2小时后,缩合产物的形成仍然很少。然而,加入BF3·OEt2后,15N标记的腺苷在半小时内迅速转化为中间体Int 3。二维1H-15N HMBC光谱学被用来监测路易斯酸催化的缩合反应,具有更高的15N灵敏度。在Na15NO2存在的情况下,15N亚胺信号消失,表明其转化为脂肪族硝基取代的中间体,并随后重排为N-亚硝化加合物。这些结果证实了通过亚胺中间体的反应路径。

b. 提出的脱氨基反应的催化循环。
(3)DNA和RNA中腺苷脱氨基的选择性条件
研究者进一步探索了优化CAM-seq选择性条件,使其对腺苷的脱氨基反应具有更高的选择性。通过测试不同的路易斯酸,发现硼酸在提高反应活性方面最为有效。在硼酸存在的情况下,二羰基化合物比单羰基化合物具有更高的脱氨基效率。通过液相色谱-串联质谱(LC-MS/MS)分析,甘油醛和三氟丙醛都表现出对腺苷的选择性,但由于三氟丙醛导致的显著DNA/RNA降解,研究者选择了甘油醛进行进一步研究。在优化的脱氨基条件下,甘油醛在DNA和RNA中都表现出对腺苷的完全脱氨基反应,而m6A位点保持不变。
c.不同羰基有机催化剂对A和C脱氨基的催化效率比较。二羰基催化剂在A位点的转化率高于C位点。
d.在优化条件下,6碱基DNA寡核苷酸CTCAGC表现出对G保护和A脱氨基的高反应性。
e.使用5碱基m6A RNA寡核苷酸探针(ACm6AGU),在与d相似条件下展示A和m6A的选择性。
f-h. LC–MS/MS监测DNA寡核苷酸脱氨基反应中甘油醛(f)、硼酸(g)和亚硝酸盐(h)浓度的优化(n=3)。
i-k. LC–MS/MS监测RNA寡核苷酸脱氨基反应中甘油醛(i)、硼酸(j)和亚硝酸盐(k)浓度的优化(n=3)。
(4)CAM-seq m6A检测的优化条件
研究者注意到,尽管甘油醛作为一种有机催化剂非常有效,但它倾向于与鸟苷形成加合物,这可能导致逆转录酶在逆转录过程中停止(RT stops)。因此,研究者选择了kethoxal作为保护基团,因为它具有更高的反应速率和更好的可逆性。在优化条件下,CAM-seq能够在接近中性的pH值下进行,显著减少RNA降解。通过测试11种不同的逆转录酶和3种不同的dNTP比例(dTTP/dCTP比例为1:1、1:40和1:400),研究者发现RevertAid RT在dTTP/dCTP比例为1:40时,背景噪声水平最低,约为0.36%。

b. 使用kethoxal保护的RNA寡核苷酸探针在与a相似的条件下展示了RT停止比率。
c-f. 在中性条件下,使用甘油醛(c,d)和kethoxal(e,f)对DNA寡核苷酸的笼化(caging)(c,e)和去笼化(decaging)(d,f)动态比较。
g. 在中性条件下,甘油醛对kethoxal完全笼化的DNA寡核苷酸的竞争。
h-i. 使用完整的RNA(h)和200个核苷酸片段化的RNA(i)进行RNA降解实验。
j. 通过插入寡核苷酸测序数据优化逆转录酶条件。测试了11种逆转录酶和3种dTTP/dCTP比例(1:1、1:40和1:400)。一个突出的条件(RevertAid RT在1:40比例下)显示出低于0.36%的背景噪声水平。
(5)人、拟南芥、玉米等不同物种转录组中的m6A全面图谱
使用优化的CAM-seq协议,研究者在人类HEK293T细胞系中鉴定了282281个高度可信的m6A位点(P<0.001)。其中,235173个和180056个位点的修饰比例分别大于5%和10%。GAC motif最为富集,占HEK293T转录组中可信位点的54%,其次是AAC motif,占27%。值得注意的是,YAC(CAC/UAC)和RAU(GAU/AAU)motif,这些与RAC motif仅相差一个核苷酸的motif,也显示出一定程度的m6A修饰。在人类转录组中,m6A富集的motif(如GAC)在3'-UTR区域的终止密码子附近表现出明显的富集信号,进一步证实了CAM-seq能够提供整个转录组的高质量m6A图谱。
研究者还对拟南芥和玉米的RNA样本进行了分析,发现RAC motif在这些植物中也是最富集的m6A修饰motif。然而,与人类样本不同的是,RAC motif仅占植物中所有m6A位点的40%,而在人类样本中约为85%。此外,植物中AAC motif丰度最高,而在人类中则是GAC motif丰度最高。这些结果表明,植物中的m6A修饰模式与人类存在差异,可能与植物中m6A修饰的调控机制有关。

b. 多种方法检测到的m6A位点与估计背景噪声的比较。
c. CAM-seq和GLORI-seq在126362个重叠位点上m6A水平的相关性(r=0.883)。红色虚线表示相等水平。红色三角形标记的区域突出了GLORI-seq高估m6A水平的位点。
d. 在三种基于脱氨基的方法中观察到的所有m6A位点中,AAC motif的比例,计算为所有位点的(m6A比率×覆盖率)之和与所有位点的(m6A比率×覆盖率)之和的比值。
e. 人类样本中所有A位点(无过滤)的平均甲基化水平与相对motif频率的关系。GAC和AAC motif(红色)高于背景水平。整体m6A水平表示为0.41%。
f-g. 拟南芥(f)和玉米(g)中所有A位点的平均甲基化水平与相对motif频率的关系。整体m6A水平分别表示为0.77%和0.69%。
h. 人类、拟南芥和玉米中通过过滤的16 three-letter motif的频率与平均甲基化水平之间的关系。
i-k. 人(i)、拟南芥(j)和玉米(k)中相对于m6A位点的每个位置核苷酸重要性评分。
(6)饱和分析将转录速率与m6A水平关联分析
研究者通过饱和m6A图谱分析发现,基因表达水平与平均m6A水平呈负相关。具体来说,高转录率基因倾向于具有较低m6A水平,可能是由于m6A沉积复合物的可用性有限,或者甲基转移酶复合物与转录机制在细胞内的动态关联。此外,研究者还发现,基因的最大m6A修饰水平可以作为区分基因的一个重要参数。将基因分为两组:一组是所有m6A位点的修饰水平普遍较低的基因,另一组是具有高修饰潜力的基因。这两组基因的表达水平与m6A水平都呈现出显著的负相关性。

b. 基于meta基因分析,终止密码子附近的-20到+180核苷酸区域被确定为m6A沉积的热点区域。
c. 基因间和单个基因内的变异对应数据。
d. log10基因表达水平与平均m6A水平之间的关系,以等高线图表示,并带有虚线趋势线。
e. 所有基因的最大m6A修饰水平分布。低甲基化和高甲基化组的拟合曲线分别用蓝色和红色虚线标记。
f. 基因内平均m6A修饰水平与最大m6A修饰水平之间的相关性。
g-h. 仅低修饰基因(g)和仅高修饰基因(h)的log10基因表达水平与平均m6A水平之间的关系。
i. 所有基因(黑色)、无m6A修饰基因(蓝色)、低m6A修饰基因(黄色)和高m6A修饰基因(红色)的m6A水平与基因表达之间的总体关系。
CAM-seq、NO-seq、NT-seq、GLORI、MeRIP-seq等m6A测序方法介绍及比较
(1)CAM-seq(化学协同催化辅助的m6A测序)
原理:通过化学协同催化策略,利用羰基催化剂和路易斯酸催化剂的协同作用,将RNA中的腺苷(A)转化为次黄嘌呤(I),而m6A位点抵抗脱氨基反应,保持为腺苷。通过逆转录酶或DNA聚合酶读取时,I被读作鸟嘌呤(G),从而实现m6A检测。
优点:
温和条件:反应在接近中性的pH值下进行,避免了RNA降解。
低背景噪声:背景噪声低至0.5%,远低于其他方法。
低输入量:仅需10ng的RNA输入即可实现高分辨率检测。
高灵敏度:能够检测到低比例的m6A修饰位点。
应用场景:
适用于低输入量的RNA样本,如单细胞RNA测序、微量组织样本等。
(2)NO-seq(硝酸盐介导的m6A测序)
原理:通过硝酸盐离子介导的化学脱氨基反应,将RNA中的腺苷(A)转化为次黄嘌呤(I),从而实现m6A的检测。
优点:
操作简单:不需要复杂的酶反应步骤。
成本低:试剂成本较低。
缺点:
反应条件苛刻:需要在酸性条件下进行,可能导致RNA降解。
背景噪声高:由于反应不完全,背景噪声较高,影响检测准确性。
(3)NT-seq(硝酸盐介导的转录组测序)
原理:与NO-seq类似,通过硝酸盐离子介导的化学脱氨基反应,将RNA中的腺苷(A)转化为次黄嘌呤(I),从而实现m6A的检测。
优点:
操作简单:不需要复杂的酶反应步骤。
成本低:试剂成本较低。
缺点:
反应条件苛刻:需要在酸性条件下进行,可能导致RNA降解。
背景噪声高:由于反应不完全,背景噪声较高,影响检测准确性。
(4)GLORI(化学保护基团介导的m6A测序)
原理:通过化学保护基团(如甘油醛)保护鸟苷(G),然后进行化学脱氨基反应,将RNA中的腺苷(A)转化为次黄嘌呤(I),从而实现m6A的检测。
优点:
选择性高:通过保护基团的选择性保护,提高了脱氨基反应的选择性。
高灵敏度:能够检测到低比例的m6A修饰位点。
缺点:
反应条件苛刻:需要在酸性条件下进行,可能导致RNA降解。
背景噪声高:由于保护基团的不完全去除,可能导致背景噪声较高。
高输入量:需要较多的RNA输入量(通常为微克级别)。
(5)MeRIP-seq(m6A免疫沉淀测序)
原理:通过特异性的m6A抗体对RNA进行免疫沉淀,然后通过高通量测序检测m6A修饰位点。
优点:
全转录组:能够实现全转录组的m6A检测。
广泛适用:适用于多种类型的RNA样本。
缺点:
高输入量:需要较多的RNA输入量(通常为微克级别)。
背景噪声高:由于抗体的非特异性结合,可能导致背景噪声较高。
操作复杂:需要进行免疫沉淀步骤,操作较为复杂。
参考文献:
Wang, P., Ye, C., Zhao, M. et al. Small-molecule-catalysed deamination enables transcriptome-wide profiling of N6-methyladenosine in RNA. Nat. Chem. (2025). https://doi.org/10.1038/s41557-025-01801-3
为了开发一种温和的化学脱氨基反应,以克服传统方法的局限性。近日,芝加哥大学何川团队通过设计一种接近中性pH值的温和化学脱氨基反应,不仅可以显著保护RNA,还能提高信噪比,从而实现对m6A位点的灵敏且稳健绘制。这种方法有望为研究m6A修饰在基因表达调控中的作用提供有力的工具,推动RNA修饰领域的研究进展。相关成果以《Small-molecule-catalysed deamination enables transcriptome-wide profiling of N6-methyladenosine in RNA》为题,发表于Nature子刊《Nature Chemistry》。

发表时间:2025-4-17
发表期刊:Nature Chemistry
影响因子:IF19.2/Q1
单位:芝加哥大学
研究方法
研究者采用一种N-亚硝化策略,通过羰基有机催化剂和路易斯酸催化剂的协同催化作用,实现对RNA中腺苷(A)的脱氨基反应,将其转化为次黄嘌呤(I)。这种方法被称为化学协同催化辅助m6A测序(chemical cooperative catalysis-assisted m6A sequencing,CAM-seq)。具体实验步骤如下:
- 反应条件优化:通过筛选不同的路易斯酸和羰基化合物,研究者发现硼酸和甘油醛(glyoxal)在促进脱氨基反应中表现出最高的效率和选择性。反应在接近中性的pH值(pH 6.0)下进行,温度为37℃,时间为12小时。
- 保护基团的选择:为了避免甘油醛与鸟苷(G)形成加合物导致的逆转录酶停止(RT stops),研究者选择了kethoxal作为保护基团,因为它具有更高的反应速率和更好的可逆性。
- RNA样本处理:从细胞或植物组织中提取总RNA,并进行poly(A)富集。将提取的RNA片段化,以提高测序效率。
- 测序文库制备:对化学处理后的RNA进行3'-端修复,连接3'-端接头,进行逆转录反应生成cDNA,再连接cDNA接头,完成文库制备。最后对文库进行PCR扩增,并使用Illumina平台进行测序。

图1:羰基有机催化剂和路易斯酸催化的一级胺协同脱氨基反应。
b. 本研究和GLORI-seq:由羰基有机催化剂和路易斯酸(LA)催化的协同脱氨基反应。
c. 全转录组m6A测序的m6A-CAM-seq方法示意图。RNA样本被片段化,并在优化的条件下进行处理,随后进行纯化和测序文库制备。
研究结果
(1)温和条件下对底物进行一般脱氨基处理
研究者在温和条件下对多种核苷酸底物进行了脱氨基反应,发现甘油醛与硼酸三氟化物乙醚(BF3·OEt2)组合能高效脱氨基广泛的核苷酸底物。通过改变羰基催化剂,从二羰基有机催化剂改为单羰基有机催化剂(如糠醛),可以显著提高鸟苷类似物的脱氨基产率。研究者推测这可能是因为鸟苷类似物在位置6处可以与甘油醛环化,形成鸟苷-甘油醛加合物。

图2:由有机催化剂与路易斯酸共同催化的核苷酸脱氨基反应。
a-c. 以胞嘧啶(a)、腺苷(b)和鸟苷(c)及其类似物为底物的脱氨基反应范围。d. 在优化的催化条件下,对甲基化核苷进行反应。
(2)阐明反应机制
通过15N核磁共振(NMR)光谱学跟踪反应过程,研究者发现,在没有路易斯酸的情况下,15N6腺苷与甘油醛的缩合反应非常缓慢,即使在50℃下加热2小时后,缩合产物的形成仍然很少。然而,加入BF3·OEt2后,15N标记的腺苷在半小时内迅速转化为中间体Int 3。二维1H-15N HMBC光谱学被用来监测路易斯酸催化的缩合反应,具有更高的15N灵敏度。在Na15NO2存在的情况下,15N亚胺信号消失,表明其转化为脂肪族硝基取代的中间体,并随后重排为N-亚硝化加合物。这些结果证实了通过亚胺中间体的反应路径。

图3:反应机制研究与催化循环。
a. 15N6腺苷脱氨基反应的一维15N核磁共振(NMR)谱图。b. 提出的脱氨基反应的催化循环。
(3)DNA和RNA中腺苷脱氨基的选择性条件
研究者进一步探索了优化CAM-seq选择性条件,使其对腺苷的脱氨基反应具有更高的选择性。通过测试不同的路易斯酸,发现硼酸在提高反应活性方面最为有效。在硼酸存在的情况下,二羰基化合物比单羰基化合物具有更高的脱氨基效率。通过液相色谱-串联质谱(LC-MS/MS)分析,甘油醛和三氟丙醛都表现出对腺苷的选择性,但由于三氟丙醛导致的显著DNA/RNA降解,研究者选择了甘油醛进行进一步研究。在优化的脱氨基条件下,甘油醛在DNA和RNA中都表现出对腺苷的完全脱氨基反应,而m6A位点保持不变。

图4:在寡核苷酸中优化脱氨基条件。
a-b.在不同路易斯酸催化剂(a)和羰基有机催化剂(b)条件下,寡核苷酸中腺苷位点的突变比率。硼酸(红色轮廓)和甘油醛(蓝色轮廓)催化剂被选中进行进一步优化(n=4)。c.不同羰基有机催化剂对A和C脱氨基的催化效率比较。二羰基催化剂在A位点的转化率高于C位点。
d.在优化条件下,6碱基DNA寡核苷酸CTCAGC表现出对G保护和A脱氨基的高反应性。
e.使用5碱基m6A RNA寡核苷酸探针(ACm6AGU),在与d相似条件下展示A和m6A的选择性。
f-h. LC–MS/MS监测DNA寡核苷酸脱氨基反应中甘油醛(f)、硼酸(g)和亚硝酸盐(h)浓度的优化(n=3)。
i-k. LC–MS/MS监测RNA寡核苷酸脱氨基反应中甘油醛(i)、硼酸(j)和亚硝酸盐(k)浓度的优化(n=3)。
(4)CAM-seq m6A检测的优化条件
研究者注意到,尽管甘油醛作为一种有机催化剂非常有效,但它倾向于与鸟苷形成加合物,这可能导致逆转录酶在逆转录过程中停止(RT stops)。因此,研究者选择了kethoxal作为保护基团,因为它具有更高的反应速率和更好的可逆性。在优化条件下,CAM-seq能够在接近中性的pH值下进行,显著减少RNA降解。通过测试11种不同的逆转录酶和3种不同的dNTP比例(dTTP/dCTP比例为1:1、1:40和1:400),研究者发现RevertAid RT在dTTP/dCTP比例为1:40时,背景噪声水平最低,约为0.36%。

图5:CAM-seq 协议的优化。
a. 使用甘油醛保护的G位点的RNA寡核苷酸探针测试了逆转录(RT)停止情况。b. 使用kethoxal保护的RNA寡核苷酸探针在与a相似的条件下展示了RT停止比率。
c-f. 在中性条件下,使用甘油醛(c,d)和kethoxal(e,f)对DNA寡核苷酸的笼化(caging)(c,e)和去笼化(decaging)(d,f)动态比较。
g. 在中性条件下,甘油醛对kethoxal完全笼化的DNA寡核苷酸的竞争。
h-i. 使用完整的RNA(h)和200个核苷酸片段化的RNA(i)进行RNA降解实验。
j. 通过插入寡核苷酸测序数据优化逆转录酶条件。测试了11种逆转录酶和3种dTTP/dCTP比例(1:1、1:40和1:400)。一个突出的条件(RevertAid RT在1:40比例下)显示出低于0.36%的背景噪声水平。
(5)人、拟南芥、玉米等不同物种转录组中的m6A全面图谱
使用优化的CAM-seq协议,研究者在人类HEK293T细胞系中鉴定了282281个高度可信的m6A位点(P<0.001)。其中,235173个和180056个位点的修饰比例分别大于5%和10%。GAC motif最为富集,占HEK293T转录组中可信位点的54%,其次是AAC motif,占27%。值得注意的是,YAC(CAC/UAC)和RAU(GAU/AAU)motif,这些与RAC motif仅相差一个核苷酸的motif,也显示出一定程度的m6A修饰。在人类转录组中,m6A富集的motif(如GAC)在3'-UTR区域的终止密码子附近表现出明显的富集信号,进一步证实了CAM-seq能够提供整个转录组的高质量m6A图谱。
研究者还对拟南芥和玉米的RNA样本进行了分析,发现RAC motif在这些植物中也是最富集的m6A修饰motif。然而,与人类样本不同的是,RAC motif仅占植物中所有m6A位点的40%,而在人类样本中约为85%。此外,植物中AAC motif丰度最高,而在人类中则是GAC motif丰度最高。这些结果表明,植物中的m6A修饰模式与人类存在差异,可能与植物中m6A修饰的调控机制有关。

图6:m6A修饰的精确定量揭示了在motif水平上的m6A沉积。
a. 所有A位点(覆盖度>20)的m6A修饰水平分布,以GAC和UAG motif为例。b. 多种方法检测到的m6A位点与估计背景噪声的比较。
c. CAM-seq和GLORI-seq在126362个重叠位点上m6A水平的相关性(r=0.883)。红色虚线表示相等水平。红色三角形标记的区域突出了GLORI-seq高估m6A水平的位点。
d. 在三种基于脱氨基的方法中观察到的所有m6A位点中,AAC motif的比例,计算为所有位点的(m6A比率×覆盖率)之和与所有位点的(m6A比率×覆盖率)之和的比值。
e. 人类样本中所有A位点(无过滤)的平均甲基化水平与相对motif频率的关系。GAC和AAC motif(红色)高于背景水平。整体m6A水平表示为0.41%。
f-g. 拟南芥(f)和玉米(g)中所有A位点的平均甲基化水平与相对motif频率的关系。整体m6A水平分别表示为0.77%和0.69%。
h. 人类、拟南芥和玉米中通过过滤的16 three-letter motif的频率与平均甲基化水平之间的关系。
i-k. 人(i)、拟南芥(j)和玉米(k)中相对于m6A位点的每个位置核苷酸重要性评分。
(6)饱和分析将转录速率与m6A水平关联分析
研究者通过饱和m6A图谱分析发现,基因表达水平与平均m6A水平呈负相关。具体来说,高转录率基因倾向于具有较低m6A水平,可能是由于m6A沉积复合物的可用性有限,或者甲基转移酶复合物与转录机制在细胞内的动态关联。此外,研究者还发现,基因的最大m6A修饰水平可以作为区分基因的一个重要参数。将基因分为两组:一组是所有m6A位点的修饰水平普遍较低的基因,另一组是具有高修饰潜力的基因。这两组基因的表达水平与m6A水平都呈现出显著的负相关性。

图7:影响m6A变化的因子。
a. 插图展示了A位点的区域和基因分布如何影响基因中m6A修饰水平的变异。b. 基于meta基因分析,终止密码子附近的-20到+180核苷酸区域被确定为m6A沉积的热点区域。
c. 基因间和单个基因内的变异对应数据。
d. log10基因表达水平与平均m6A水平之间的关系,以等高线图表示,并带有虚线趋势线。
e. 所有基因的最大m6A修饰水平分布。低甲基化和高甲基化组的拟合曲线分别用蓝色和红色虚线标记。
f. 基因内平均m6A修饰水平与最大m6A修饰水平之间的相关性。
g-h. 仅低修饰基因(g)和仅高修饰基因(h)的log10基因表达水平与平均m6A水平之间的关系。
i. 所有基因(黑色)、无m6A修饰基因(蓝色)、低m6A修饰基因(黄色)和高m6A修饰基因(红色)的m6A水平与基因表达之间的总体关系。
CAM-seq、NO-seq、NT-seq、GLORI、MeRIP-seq等m6A测序方法介绍及比较
(1)CAM-seq(化学协同催化辅助的m6A测序)
原理:通过化学协同催化策略,利用羰基催化剂和路易斯酸催化剂的协同作用,将RNA中的腺苷(A)转化为次黄嘌呤(I),而m6A位点抵抗脱氨基反应,保持为腺苷。通过逆转录酶或DNA聚合酶读取时,I被读作鸟嘌呤(G),从而实现m6A检测。
优点:
温和条件:反应在接近中性的pH值下进行,避免了RNA降解。
低背景噪声:背景噪声低至0.5%,远低于其他方法。
低输入量:仅需10ng的RNA输入即可实现高分辨率检测。
高灵敏度:能够检测到低比例的m6A修饰位点。
应用场景:
适用于低输入量的RNA样本,如单细胞RNA测序、微量组织样本等。
(2)NO-seq(硝酸盐介导的m6A测序)
原理:通过硝酸盐离子介导的化学脱氨基反应,将RNA中的腺苷(A)转化为次黄嘌呤(I),从而实现m6A的检测。
优点:
操作简单:不需要复杂的酶反应步骤。
成本低:试剂成本较低。
缺点:
反应条件苛刻:需要在酸性条件下进行,可能导致RNA降解。
背景噪声高:由于反应不完全,背景噪声较高,影响检测准确性。
(3)NT-seq(硝酸盐介导的转录组测序)
原理:与NO-seq类似,通过硝酸盐离子介导的化学脱氨基反应,将RNA中的腺苷(A)转化为次黄嘌呤(I),从而实现m6A的检测。
优点:
操作简单:不需要复杂的酶反应步骤。
成本低:试剂成本较低。
缺点:
反应条件苛刻:需要在酸性条件下进行,可能导致RNA降解。
背景噪声高:由于反应不完全,背景噪声较高,影响检测准确性。
(4)GLORI(化学保护基团介导的m6A测序)
原理:通过化学保护基团(如甘油醛)保护鸟苷(G),然后进行化学脱氨基反应,将RNA中的腺苷(A)转化为次黄嘌呤(I),从而实现m6A的检测。
优点:
选择性高:通过保护基团的选择性保护,提高了脱氨基反应的选择性。
高灵敏度:能够检测到低比例的m6A修饰位点。
缺点:
反应条件苛刻:需要在酸性条件下进行,可能导致RNA降解。
背景噪声高:由于保护基团的不完全去除,可能导致背景噪声较高。
高输入量:需要较多的RNA输入量(通常为微克级别)。
(5)MeRIP-seq(m6A免疫沉淀测序)
原理:通过特异性的m6A抗体对RNA进行免疫沉淀,然后通过高通量测序检测m6A修饰位点。
优点:
全转录组:能够实现全转录组的m6A检测。
广泛适用:适用于多种类型的RNA样本。
缺点:
高输入量:需要较多的RNA输入量(通常为微克级别)。
背景噪声高:由于抗体的非特异性结合,可能导致背景噪声较高。
操作复杂:需要进行免疫沉淀步骤,操作较为复杂。
参考文献:
Wang, P., Ye, C., Zhao, M. et al. Small-molecule-catalysed deamination enables transcriptome-wide profiling of N6-methyladenosine in RNA. Nat. Chem. (2025). https://doi.org/10.1038/s41557-025-01801-3
相关文章
更多 >

