RNA-BS在揭示DNMT1在m5C修饰中的线粒体功能机制中的应用
2025-05-14 来源:本站 点击次数:431
表观遗传调控,包括DNA甲基化、RNA修饰和染色质重塑等,在神经退行性疾病中起重要作用。DNA甲基转移酶1(DNMT1)是一种已知的DNA甲基转移酶,主要负责维持DNA甲基化。然而DNMT1在非分裂细胞中的功能尚不清楚。此外,DNMT1的RFTS(replication focus targeting sequence )结构域突变(如A560V)与多种神经退行性疾病相关,但其分子机制尚未完全阐明。
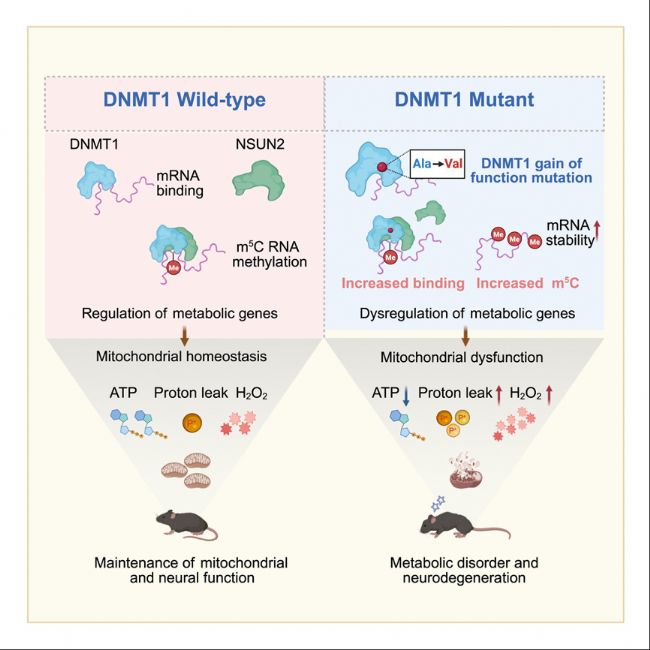
近日,美国加州大学洛杉矶分校终身教授/上海科技大学免疫化学研究所特聘教授范国平课题组揭示了 DNMT1在调控DNA和RNA甲基化中的双重作用,特别是其通过RNA修饰调控线粒体功能的机制。研究发现,DNMT1能够与mRNA结合并促进其稳定性,并通过招募NSUN2蛋白来调节RNA的5-甲基胞嘧啶(m5C)甲基化。此外,研究还发现DNMT1的RFTS结构域突变(如A560V)会导致代谢基因的RNA甲基化和稳定性异常,进而引发线粒体功能障碍和神经退行性疾病。这些发现为理解DNMT1在神经系统疾病中的作用提供了新的视角,并为开发靶向RNA甲基化的治疗策略提供了理论基础。相关研究成果以《DNA methyltransferase 1 modulates mitochondrial function through bridging m5C RNA methylation》为题发表于《Molecular Cell》期刊。

文章标题:DNA methyltransferase 1 modulates mitochondrial function through bridging m5C RNA methylation
影响因子:IF14.5/Q1
技术平台: RNA-BS-seq、RRBS、RNA-seq等

DNMT1是一种维持DNA甲基化的DNA甲基转移酶。其复制焦点靶向序列(RFTS)结构域中的点突变会导致晚发性神经退行性疾病,如常染色体显性小脑性共济失调-耳聋和嗜睡症(ADCA-DN)疾病。本研究首先验证了DNMT1具有结合mRNA转录本的功能,并通过招募NOP2/Sun RNA甲基转移酶2(NSUN2)来促进RNA m5C甲基化。同时,RNA m5C甲基化增强那些调节线粒体功能基因的RNA稳定性。当小鼠的DNMT1 RFTS结构域发生突变时,会引发异常的DNMT1-RNA相互作用,并显著提高部分代谢基因的m5C RNA甲基化和RNA稳定性。因此,代谢RNA转录本水平增加导致了累积性的氧化应激、线粒体功能障碍和神经症状。总体而言,本研究结果揭示了DNMT1在调节DNA和RNA甲基化中的双重作用,并进一步调节了线粒体功能,为DNMT1突变诱导的神经退行性疾病的发病机制提供了新见解。
研究方法
1. 细胞培养和基因编辑
细胞培养:使用HeLa细胞、HEK293T细胞以及小鼠胚胎干细胞(ESCs),并在特定条件下培养。
基因编辑:通过CRISPR-Cas9技术构建了携带Dnmt1A560V突变的小鼠模型和细胞系。
2、动物模型和行为学测试
小鼠模型:构建Dnmt1A560V突变小鼠模型,用于研究DNMT1突变对神经系统的长期影响。
行为学测试:包括后肢抓握测试和旋转杆测试,评估小鼠的运动功能障碍。
3. RNA结合蛋白分析
增强型交联免疫沉淀测序(eCLIP-seq):鉴定DNMT1结合的mRNA转录本(DNMT1-bound mRNA transcripts,DBTs),发现DNMT1能够结合大量mRNA,并影响其稳定性。
4. RNA甲基化分析
RNA-BS-seq:分析RNA m5C甲基化水平,发现DNMT1能够通过招募NSUN2蛋白来调节RNA的m5C甲基化。
质谱分析(UHPLC-MRM-MS/MS):定量分析RNA甲基化水平,验证DNMT1对m5C甲基化的调控作用。
5. 蛋白质互作分析
Co-IP:检测DNMT1与NSUN2互作,并通过质谱分析鉴定DNMT1的互作蛋白。
等温滴定量热法(ITC):检测DNMT1与NSUN2之间的结合亲和力。
6. 基因表达和表观遗传分析
RNA-seq:分析基因表达变化,发现Dnmt1A560V突变导致代谢基因表达失调。
DNA甲基化测序(EM-seq和RRBS):分析DNA甲基化水平,发现突变对DNA甲基化影响较小,但对RNA甲基化影响显著。
7. 单细胞分析
scRNA-seq和snRNA-seq:分析神经组织中不同细胞类型的基因表达变化,揭示了广泛的氧化应激反应。
8. 代谢和线粒体功能分析
细胞能量代谢分析:评估细胞的氧气消耗率(OCR)和胞外酸化率(ECAR)。
线粒体DNA含量测定:通过qPCR分析线粒体DNA含量。
氧化应激和ATP含量分析:检测细胞中的氧化应激和ATP水平。
结果图形
(1)DNMT1直接与mRNA结合以增强其稳定性
DNMT1能够与mRNA结合,并通过增强RNA稳定性以调控基因表达。通过eCLIP-seq技术,研究者在HeLa细胞和HEK293T细胞中鉴定出大量DBTs,这些转录本主要分布在5’UTR区域。DNMT1的结合显著增强了这些mRNA的稳定性,且这种稳定性与RNA的细胞核质比和翻译效率相关。

(2)DNMT1通过招募NSUN2调控DBTs的m5C RNA甲基化
DNMT1能够通过招募NSUN2蛋白来调节RNA m5C甲基化。通过免疫共沉淀实验和质谱分析,研究者发现DNMT1与NSUN2之间存在直接相互作用,且这种相互作用部分依赖于RNA。RNA-BS-seq分析显示,DNMT1敲低(KD)的细胞中m5C水平显著降低,且这些位点与DBTs高度重叠。
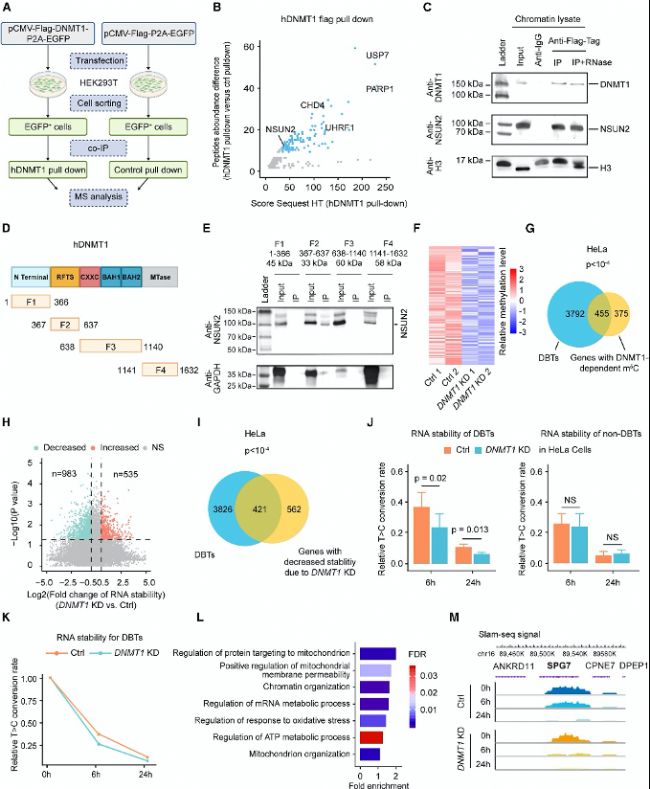
(B) 在IP-MS实验中,通过质谱检测到的DNMT1相互作用肽段与非特异性肽段(仅EGFP)的丰度差异。
(C) 在HeLa细胞中异位表达全长NSUN2和FLAG标签的DNMT1。随后使用抗FLAG抗体进行染色质裂解液的IP。然后用抗NSUN2和抗DNMT1抗体对IP蛋白进行免疫检测。
(D) DNMT1结构域和FLAG-DNMT1分离片段(F1–F4)的示意图。
(E) 共免疫沉淀检测FLAG-DNMT1分离片段(F1–F4)与NSUN2的相互作用。
(F) RNA-BS-seq热图显示在HeLa细胞中鉴定出的依赖DNMT1的m5C位点。
(G) DBTs与含有DNMT1依赖性m5C位点的基因之间的重叠。
(H) 由于DNMT1敲低(KD)处理而在HeLa细胞中稳定性发生变化的转录本的鉴定。
(I) DBTs与因DNMT1 KD而RNA稳定性降低的基因之间的重叠。
(J) 对照组(Ctrl)和DNMT1 KD HeLa细胞中DBTs(左侧)和非DBTs(右侧)的RNA稳定性条形图。
(K) 对照组(Ctrl)和DNMT1 KD HeLa细胞中所有DBTs的RNA稳定性总结。
(L) 对含有DNMT1依赖性m5C位点的DBTs进行GO分析。
(M) 基因组轨迹显示在对照组和DNMT1 KD HeLa细胞中Slam-seq信号在SPG7上的分布。
(3)Dnmt1A560V突变小鼠出现代谢和神经系统疾病
Dnmt1A560V突变小鼠表现出多种代谢和神经症状,包括体重下降、运动功能障碍和氧化应激增加。这些症状与线粒体功能障碍相关,且在突变小鼠的多个组织中观察到代谢基因的RNA甲基化和稳定性显著增加。
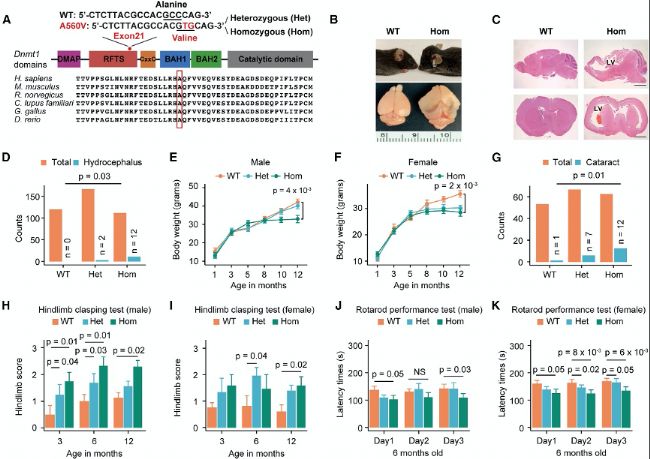
(B) 部分纯合突变(Hom)小鼠表现出圆顶状头颅的脑积水(上)。整体大脑显示出扩大的大脑半球、受压的嗅球和下陷的大脑皮层(下)。
(C) 代表性大脑矢状面(上)和冠状面(下)切片显示,与野生型(WT)小鼠相比,Hom突变小鼠的侧脑室(LVs)极度扩张,且大脑皮层变薄。
(D) 本研究中鉴定出的WT、Het和Hom小鼠的总数和脑积水小鼠的数量。
(E-F) 雄性小鼠(每种基因型n=20)(E)和磁性小鼠(每种基因型n=20)(F)的生长曲线。
(G) 本研究中三种基因型的白内障发病率。
(H-I) 三种基因型小鼠的后肢抓握评分,雄性(H)和雌性(I)。
(J-K) 6个月大雄性(J)和雌性(K)小鼠的旋转杆性能测试。
(4)Dnmt1A560V突变显著增加代谢mRNA转录本水平
在Dnmt1A560V突变小鼠细胞中,代谢基因的mRNA转录本水平显著增加。这些转录本的增加与RNA m5C甲基化水平升高相关,表明DNMT1突变增强了RNA甲基化和稳定性。
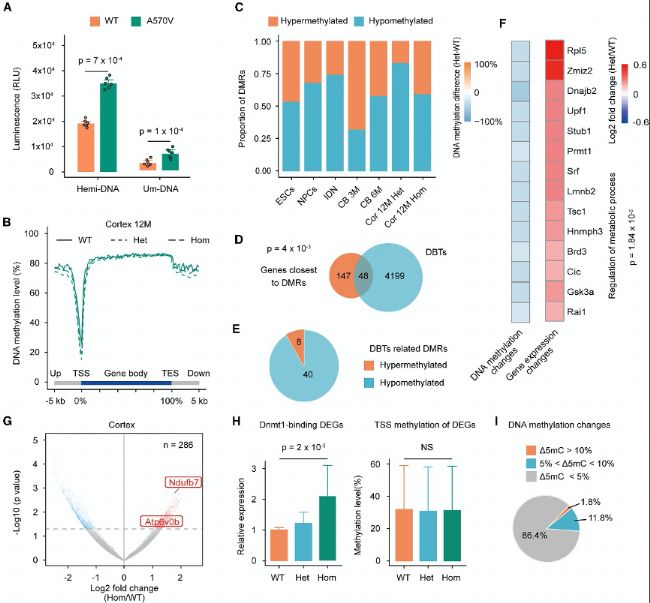
(B) 不同小鼠组织中基因体的平均甲基化水平。CB,小脑;Cor,皮层;M,月龄。
(C) 不同样本中高甲基化和低甲基化DMRs比例。
(D) 最接近DMRs基因与DBTs的重叠。
(E) 皮层中与DBT相关的DMRs数量的饼图。
(F) 皮层中与DBT相关的DMRs的甲基化差异(左)和相应的基因表达变化倍数(右)。
(G) 鉴定皮层中的差异表达基因(DEGs)。
(H) 所有与DBT相关的DEGs的相对表达(左)和皮层中相应TSS±2 kb区域的甲基化水平(右)。
(I) 对皮层中与DBT相关的DEGs的TSS±2kb区域中,纯合子(Hom)与野生型(WT)之间的DNA甲基化变化比例分析。
(5)稳定化的DNMT1结合mRNA参与线粒体调节
DNMT1结合的mRNA稳定性增加与线粒体功能调节密切相关。研究发现,这些mRNA的稳定性增加导致代谢基因表达水平升高,进而影响线粒体功能和氧化应激反应。
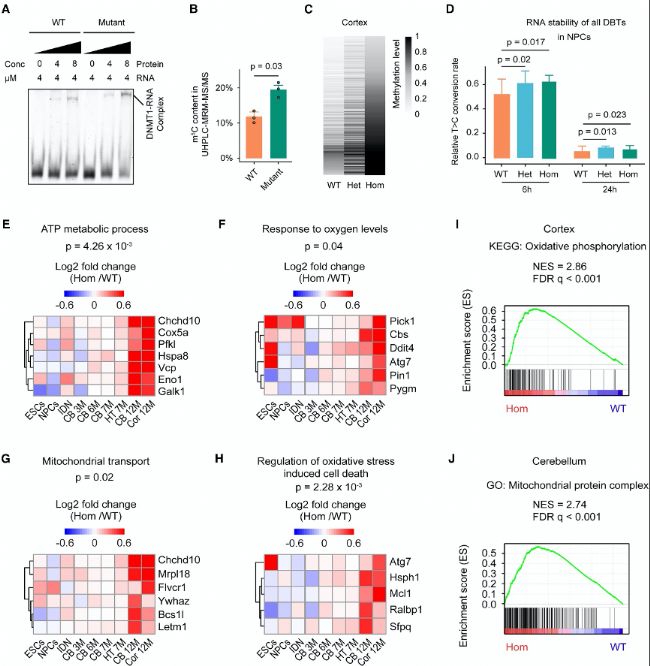
(B) 与NSUN2和WT或突变型hDNMT1蛋白孵育的RNA寡核苷酸R1的单核苷酸中的RNA m5C含量。
(C) 小鼠皮层中DBTs的m5C位点的RNA甲基化水平热图。
(D) WT、杂合子(Het)和纯合子(Hom)神经前体细胞(NPCs)中DBTs的RNA稳定性。
(E–H) 不同组织和细胞中一致上调的DBTs热图。
(I-J) 纯合子Dnmt1A560V突变在皮层(I)和小脑(J)中诱导的指示基因特征变化基因集富集分析(GSEA)。
(6)失调的DNMT1结合mRNA导致线粒体功能障碍
Dnmt1A560V突变导致DNMT1结合的mRNA失调,进而引发线粒体功能障碍。研究发现,突变小鼠的线粒体呼吸功能下降,ATP合成减少,氧化应激增加,这些变化与代谢基因的RNA甲基化和稳定性异常相关。
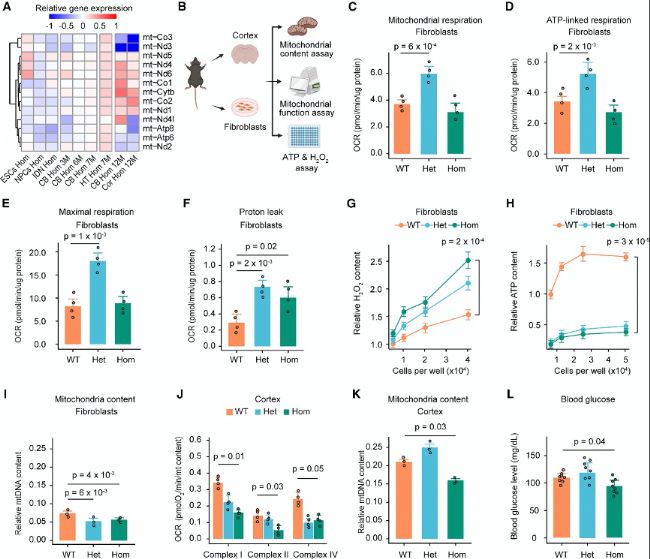
(B) 与线粒体功能相关的实验设计图。
(C-F) 条形图显示三种基因型成纤维细胞的线粒体呼吸(C)、ATP相关呼吸(D)、最大呼吸(E)和质子泄漏(F)。
(G-H) 三种基因型成纤维细胞的相对H2O2含量(G)和ATP含量(H)。
(I) 条形图显示成纤维细胞中线粒体DNA含量。
(J) 条形图显示三种基因型大脑皮层的线粒体复合体驱动的呼吸。
(K) 条形图显示大脑皮层的线粒体DNA含量。
(L) 12月龄小鼠禁食4小时后的血糖水平。
(7)单细胞分析揭示神经组织中广泛的氧化应激反应
通过单细胞RNA测序分析,研究发现Dnmt1A560V突变小鼠的神经组织中存在广泛的氧化应激反应。这些反应涉及多个细胞类型,包括少突胶质细胞和抑制性神经元,表明DNMT1突变对神经系统的广泛影响。

(B) 基于snRNA-seq的无偏倚UMAP可视化。
(C) 皮层中每个细胞亚型的标记物的点图。
(D) 细胞亚型中鉴定出的单细胞差异表达基因(scDEGs)数量及其与神经退行性相关基因的重叠条形图。
(E) scDEGs与神经退行性相关基因的重叠维恩图。
(F) 不同细胞亚型中Klf13b、Klf3a和Sqstm1表达的箱线图。
(G) 所有兴奋性神经元中鉴定出的scDEGs的GO分析。
(H) 基于UMAP可视化的视网膜中14669个细胞的9个聚类。
(I) 视网膜中scRNA-seq和bulk RNA-seq结果一致的差异表达基因(DEGs)的GO分析。在scRNA-seq和bulk RNA-seq中表现出一致变化趋势的DEGs被定义为一致DEGs。
(J) DNMT1调控的DBTs模型。突变导致DNMT1与RNA的相互作用增强,从而导致RNA过度抑制DNA甲基化(转录水平)和通过m5C RNA甲基化增强转录本稳定性。转录去抑制和DBTs的RNA甲基化共同驱动线粒体功能障碍,而ATP缺失和累积的氧化应激最终导致代谢和神经障碍。
易小结
本研究揭示了DNMT1在RNA修饰和线粒体功能调节中的新功能。DNMT1通过招募NSUN2调节RNA m5C甲基化,进而影响线粒体功能和神经退行性疾病发生。这些发现为开发靶向RNA甲基化的治疗策略提供了新的靶点,并为理解DNMT1在神经系统疾病中的作用提供了新视角。
RNA-BS-seq分析在本研究中的重要作用
RNA-BS-seq技术在本研究中发挥了关键作用。它不仅用于分析DNMT1和NSUN2在RNA甲基化中的作用,还揭示了Dnmt1A560V突变对RNA甲基化水平的影响。通过RNA-BS-seq,研究者能够单碱基分辨率检测RNA m5C甲基化水平,并鉴定出与DNMT1结合的mRNA转录本。这些数据为理解DNMT1在RNA修饰中的作用提供了重要依据。
参考文献:
Wang et al., DNA methyltransferase 1 modulates mitochondrial function through bridging m5C RNA methylation,Molecular Cell (2025), https://doi.org/10.1016/j.molcel.2025.04.019
近日,美国加州大学洛杉矶分校终身教授/上海科技大学免疫化学研究所特聘教授范国平课题组揭示了 DNMT1在调控DNA和RNA甲基化中的双重作用,特别是其通过RNA修饰调控线粒体功能的机制。研究发现,DNMT1能够与mRNA结合并促进其稳定性,并通过招募NSUN2蛋白来调节RNA的5-甲基胞嘧啶(m5C)甲基化。此外,研究还发现DNMT1的RFTS结构域突变(如A560V)会导致代谢基因的RNA甲基化和稳定性异常,进而引发线粒体功能障碍和神经退行性疾病。这些发现为理解DNMT1在神经系统疾病中的作用提供了新的视角,并为开发靶向RNA甲基化的治疗策略提供了理论基础。相关研究成果以《DNA methyltransferase 1 modulates mitochondrial function through bridging m5C RNA methylation》为题发表于《Molecular Cell》期刊。

文章标题:DNA methyltransferase 1 modulates mitochondrial function through bridging m5C RNA methylation
发表时间:2025-05-05
发表期刊:Molecular Cell影响因子:IF14.5/Q1
技术平台: RNA-BS-seq、RRBS、RNA-seq等

DNMT1是一种维持DNA甲基化的DNA甲基转移酶。其复制焦点靶向序列(RFTS)结构域中的点突变会导致晚发性神经退行性疾病,如常染色体显性小脑性共济失调-耳聋和嗜睡症(ADCA-DN)疾病。本研究首先验证了DNMT1具有结合mRNA转录本的功能,并通过招募NOP2/Sun RNA甲基转移酶2(NSUN2)来促进RNA m5C甲基化。同时,RNA m5C甲基化增强那些调节线粒体功能基因的RNA稳定性。当小鼠的DNMT1 RFTS结构域发生突变时,会引发异常的DNMT1-RNA相互作用,并显著提高部分代谢基因的m5C RNA甲基化和RNA稳定性。因此,代谢RNA转录本水平增加导致了累积性的氧化应激、线粒体功能障碍和神经症状。总体而言,本研究结果揭示了DNMT1在调节DNA和RNA甲基化中的双重作用,并进一步调节了线粒体功能,为DNMT1突变诱导的神经退行性疾病的发病机制提供了新见解。

图形摘要
研究方法
1. 细胞培养和基因编辑
细胞培养:使用HeLa细胞、HEK293T细胞以及小鼠胚胎干细胞(ESCs),并在特定条件下培养。
基因编辑:通过CRISPR-Cas9技术构建了携带Dnmt1A560V突变的小鼠模型和细胞系。
2、动物模型和行为学测试
小鼠模型:构建Dnmt1A560V突变小鼠模型,用于研究DNMT1突变对神经系统的长期影响。
行为学测试:包括后肢抓握测试和旋转杆测试,评估小鼠的运动功能障碍。
3. RNA结合蛋白分析
增强型交联免疫沉淀测序(eCLIP-seq):鉴定DNMT1结合的mRNA转录本(DNMT1-bound mRNA transcripts,DBTs),发现DNMT1能够结合大量mRNA,并影响其稳定性。
4. RNA甲基化分析
RNA-BS-seq:分析RNA m5C甲基化水平,发现DNMT1能够通过招募NSUN2蛋白来调节RNA的m5C甲基化。
质谱分析(UHPLC-MRM-MS/MS):定量分析RNA甲基化水平,验证DNMT1对m5C甲基化的调控作用。
5. 蛋白质互作分析
Co-IP:检测DNMT1与NSUN2互作,并通过质谱分析鉴定DNMT1的互作蛋白。
等温滴定量热法(ITC):检测DNMT1与NSUN2之间的结合亲和力。
6. 基因表达和表观遗传分析
RNA-seq:分析基因表达变化,发现Dnmt1A560V突变导致代谢基因表达失调。
DNA甲基化测序(EM-seq和RRBS):分析DNA甲基化水平,发现突变对DNA甲基化影响较小,但对RNA甲基化影响显著。
7. 单细胞分析
scRNA-seq和snRNA-seq:分析神经组织中不同细胞类型的基因表达变化,揭示了广泛的氧化应激反应。
8. 代谢和线粒体功能分析
细胞能量代谢分析:评估细胞的氧气消耗率(OCR)和胞外酸化率(ECAR)。
线粒体DNA含量测定:通过qPCR分析线粒体DNA含量。
氧化应激和ATP含量分析:检测细胞中的氧化应激和ATP水平。
结果图形
(1)DNMT1直接与mRNA结合以增强其稳定性
DNMT1能够与mRNA结合,并通过增强RNA稳定性以调控基因表达。通过eCLIP-seq技术,研究者在HeLa细胞和HEK293T细胞中鉴定出大量DBTs,这些转录本主要分布在5’UTR区域。DNMT1的结合显著增强了这些mRNA的稳定性,且这种稳定性与RNA的细胞核质比和翻译效率相关。

图1:DNMT1与参与转录后调控的部分mRNA结合
(2)DNMT1通过招募NSUN2调控DBTs的m5C RNA甲基化
DNMT1能够通过招募NSUN2蛋白来调节RNA m5C甲基化。通过免疫共沉淀实验和质谱分析,研究者发现DNMT1与NSUN2之间存在直接相互作用,且这种相互作用部分依赖于RNA。RNA-BS-seq分析显示,DNMT1敲低(KD)的细胞中m5C水平显著降低,且这些位点与DBTs高度重叠。

图2:DNMT1对mRNA上m5C RNA甲基化的调控
(A) 鉴定DNMT1相互作用蛋白的FLAG免疫沉淀(IP)实验方案,随后进行质谱(MS)分析。(B) 在IP-MS实验中,通过质谱检测到的DNMT1相互作用肽段与非特异性肽段(仅EGFP)的丰度差异。
(C) 在HeLa细胞中异位表达全长NSUN2和FLAG标签的DNMT1。随后使用抗FLAG抗体进行染色质裂解液的IP。然后用抗NSUN2和抗DNMT1抗体对IP蛋白进行免疫检测。
(D) DNMT1结构域和FLAG-DNMT1分离片段(F1–F4)的示意图。
(E) 共免疫沉淀检测FLAG-DNMT1分离片段(F1–F4)与NSUN2的相互作用。
(F) RNA-BS-seq热图显示在HeLa细胞中鉴定出的依赖DNMT1的m5C位点。
(G) DBTs与含有DNMT1依赖性m5C位点的基因之间的重叠。
(H) 由于DNMT1敲低(KD)处理而在HeLa细胞中稳定性发生变化的转录本的鉴定。
(I) DBTs与因DNMT1 KD而RNA稳定性降低的基因之间的重叠。
(J) 对照组(Ctrl)和DNMT1 KD HeLa细胞中DBTs(左侧)和非DBTs(右侧)的RNA稳定性条形图。
(K) 对照组(Ctrl)和DNMT1 KD HeLa细胞中所有DBTs的RNA稳定性总结。
(L) 对含有DNMT1依赖性m5C位点的DBTs进行GO分析。
(M) 基因组轨迹显示在对照组和DNMT1 KD HeLa细胞中Slam-seq信号在SPG7上的分布。
(3)Dnmt1A560V突变小鼠出现代谢和神经系统疾病
Dnmt1A560V突变小鼠表现出多种代谢和神经症状,包括体重下降、运动功能障碍和氧化应激增加。这些症状与线粒体功能障碍相关,且在突变小鼠的多个组织中观察到代谢基因的RNA甲基化和稳定性显著增加。

图3:Dnmt1A560V小鼠表现出代谢和神经紊乱
(A) Dnmt1结构域示意图及ADCA-DN A560V突变的位置。(B) 部分纯合突变(Hom)小鼠表现出圆顶状头颅的脑积水(上)。整体大脑显示出扩大的大脑半球、受压的嗅球和下陷的大脑皮层(下)。
(C) 代表性大脑矢状面(上)和冠状面(下)切片显示,与野生型(WT)小鼠相比,Hom突变小鼠的侧脑室(LVs)极度扩张,且大脑皮层变薄。
(D) 本研究中鉴定出的WT、Het和Hom小鼠的总数和脑积水小鼠的数量。
(E-F) 雄性小鼠(每种基因型n=20)(E)和磁性小鼠(每种基因型n=20)(F)的生长曲线。
(G) 本研究中三种基因型的白内障发病率。
(H-I) 三种基因型小鼠的后肢抓握评分,雄性(H)和雌性(I)。
(J-K) 6个月大雄性(J)和雌性(K)小鼠的旋转杆性能测试。
(4)Dnmt1A560V突变显著增加代谢mRNA转录本水平
在Dnmt1A560V突变小鼠细胞中,代谢基因的mRNA转录本水平显著增加。这些转录本的增加与RNA m5C甲基化水平升高相关,表明DNMT1突变增强了RNA甲基化和稳定性。

图4:Dnmt1点突变导致部分代谢基因的转录去抑制
(A) hDNMT1蛋白对DNA的甲基转移酶活性的发光检测。(B) 不同小鼠组织中基因体的平均甲基化水平。CB,小脑;Cor,皮层;M,月龄。
(C) 不同样本中高甲基化和低甲基化DMRs比例。
(D) 最接近DMRs基因与DBTs的重叠。
(E) 皮层中与DBT相关的DMRs数量的饼图。
(F) 皮层中与DBT相关的DMRs的甲基化差异(左)和相应的基因表达变化倍数(右)。
(G) 鉴定皮层中的差异表达基因(DEGs)。
(H) 所有与DBT相关的DEGs的相对表达(左)和皮层中相应TSS±2 kb区域的甲基化水平(右)。
(I) 对皮层中与DBT相关的DEGs的TSS±2kb区域中,纯合子(Hom)与野生型(WT)之间的DNA甲基化变化比例分析。
(5)稳定化的DNMT1结合mRNA参与线粒体调节
DNMT1结合的mRNA稳定性增加与线粒体功能调节密切相关。研究发现,这些mRNA的稳定性增加导致代谢基因表达水平升高,进而影响线粒体功能和氧化应激反应。

图5:与线粒体功能相关的DBTs的稳定性
(A) hDNMT1蛋白与RNA寡核苷酸R1结合的电泳迁移率变化分析(EMSA)。(B) 与NSUN2和WT或突变型hDNMT1蛋白孵育的RNA寡核苷酸R1的单核苷酸中的RNA m5C含量。
(C) 小鼠皮层中DBTs的m5C位点的RNA甲基化水平热图。
(D) WT、杂合子(Het)和纯合子(Hom)神经前体细胞(NPCs)中DBTs的RNA稳定性。
(E–H) 不同组织和细胞中一致上调的DBTs热图。
(I-J) 纯合子Dnmt1A560V突变在皮层(I)和小脑(J)中诱导的指示基因特征变化基因集富集分析(GSEA)。
(6)失调的DNMT1结合mRNA导致线粒体功能障碍
Dnmt1A560V突变导致DNMT1结合的mRNA失调,进而引发线粒体功能障碍。研究发现,突变小鼠的线粒体呼吸功能下降,ATP合成减少,氧化应激增加,这些变化与代谢基因的RNA甲基化和稳定性异常相关。

图6:失调的DBTs导致线粒体功能障碍
(A) 热图显示不同组织和细胞中线粒体(mt)基因的倍数变化。(B) 与线粒体功能相关的实验设计图。
(C-F) 条形图显示三种基因型成纤维细胞的线粒体呼吸(C)、ATP相关呼吸(D)、最大呼吸(E)和质子泄漏(F)。
(G-H) 三种基因型成纤维细胞的相对H2O2含量(G)和ATP含量(H)。
(I) 条形图显示成纤维细胞中线粒体DNA含量。
(J) 条形图显示三种基因型大脑皮层的线粒体复合体驱动的呼吸。
(K) 条形图显示大脑皮层的线粒体DNA含量。
(L) 12月龄小鼠禁食4小时后的血糖水平。
(7)单细胞分析揭示神经组织中广泛的氧化应激反应
通过单细胞RNA测序分析,研究发现Dnmt1A560V突变小鼠的神经组织中存在广泛的氧化应激反应。这些反应涉及多个细胞类型,包括少突胶质细胞和抑制性神经元,表明DNMT1突变对神经系统的广泛影响。

图7:单细胞分析揭示神经组织中广泛的氧化应激反应
(A) 单细胞文库制备示意图。(B) 基于snRNA-seq的无偏倚UMAP可视化。
(C) 皮层中每个细胞亚型的标记物的点图。
(D) 细胞亚型中鉴定出的单细胞差异表达基因(scDEGs)数量及其与神经退行性相关基因的重叠条形图。
(E) scDEGs与神经退行性相关基因的重叠维恩图。
(F) 不同细胞亚型中Klf13b、Klf3a和Sqstm1表达的箱线图。
(G) 所有兴奋性神经元中鉴定出的scDEGs的GO分析。
(H) 基于UMAP可视化的视网膜中14669个细胞的9个聚类。
(I) 视网膜中scRNA-seq和bulk RNA-seq结果一致的差异表达基因(DEGs)的GO分析。在scRNA-seq和bulk RNA-seq中表现出一致变化趋势的DEGs被定义为一致DEGs。
(J) DNMT1调控的DBTs模型。突变导致DNMT1与RNA的相互作用增强,从而导致RNA过度抑制DNA甲基化(转录水平)和通过m5C RNA甲基化增强转录本稳定性。转录去抑制和DBTs的RNA甲基化共同驱动线粒体功能障碍,而ATP缺失和累积的氧化应激最终导致代谢和神经障碍。
易小结
本研究揭示了DNMT1在RNA修饰和线粒体功能调节中的新功能。DNMT1通过招募NSUN2调节RNA m5C甲基化,进而影响线粒体功能和神经退行性疾病发生。这些发现为开发靶向RNA甲基化的治疗策略提供了新的靶点,并为理解DNMT1在神经系统疾病中的作用提供了新视角。
RNA-BS-seq分析在本研究中的重要作用
RNA-BS-seq技术在本研究中发挥了关键作用。它不仅用于分析DNMT1和NSUN2在RNA甲基化中的作用,还揭示了Dnmt1A560V突变对RNA甲基化水平的影响。通过RNA-BS-seq,研究者能够单碱基分辨率检测RNA m5C甲基化水平,并鉴定出与DNMT1结合的mRNA转录本。这些数据为理解DNMT1在RNA修饰中的作用提供了重要依据。
参考文献:
Wang et al., DNA methyltransferase 1 modulates mitochondrial function through bridging m5C RNA methylation,Molecular Cell (2025), https://doi.org/10.1016/j.molcel.2025.04.019
相关文章
更多 >

