游离药物浓度检测——生物样本分析前处理技术
2025-05-09 来源:本站 点击次数:89
关键词:游离药物浓度,Free Concentration,生物样本前处理,生物样品前处理,平衡透析法,equilibrium dialysis(ED),超滤法,Ultra-filtration(UF),快速平衡透析装置,RED,血浆蛋白结合,Plasma Protein Binding(PPB)
游离药物浓度(Free Concentration)是指生物样本(如血浆、血清、组织液等)中未与蛋白质或其他大分子结合的游离态药物、激素、代谢物或其他小分子分析物的浓度。由于许多生物活性物质在体内会与蛋白质(如白蛋白、α₁-酸性糖蛋白、免疫球蛋白等)结合,只有游离部分才能发挥药理或生理活性,因此测定游离药物浓度(Free Concentration)在药代动力学(PK)、药效学(PD)、临床监测和生物分析样本前处理过程中具有重要意义。
一、游离浓度的前处理技术
在生物样本(如血液、尿液、组织等)中测定游离(未结合)药物、激素或其他分析物的浓度时,生物样本前处理步骤需确保目标物质的游离状态不被破坏,同时去除干扰物质。目前的游离药物浓度分析生物样品前处理技术有平衡透析法(equilibrium dialysis,ED)、超滤法(Ultra-filtration,UF)、超速离心法(Ultracentrifugation,UC)、凝胶过滤/尺寸排阻色谱(Size-Exclusion Chromatography, SEC)、固相萃取或免疫亲和纯化和化学或酶解处理(结合型释放后检测),但常用的是平衡透析法(equilibrium dialysis,ED)、超滤法(Ultra-filtration,UF)和超速离心法(Ultracentrifugation,UC),其中平衡透析法更是游离药物浓度生物样品前处理技术的金标准。
1.1 平衡透析法
平衡透析法(equilibrium dialysis,ED)是测定生物样本(如血浆、血清)中游离药物、激素或代谢物浓度的金标准方法,常用于血浆蛋白结合试验(Plasma Protein Binding, PPB),其核心原理是利用半透膜使游离小分子在样本与缓冲液之间达到平衡,而大分子结合物(如蛋白结合型药物)因无法透过膜被分离。
【试验步骤】
1、样本准备:血浆、血清、脑脊液或其它基质
2、透析装置:不锈钢特氟龙板平衡透析装置(HTD)或快速平衡透析装置(RED)
3、膜选择:纤维素膜
4、加样:供体室加入含药基质,受体室加入PBS
5、孵育:37℃,5% CO2培养箱培养4~24小时,根据装置决定孵育时间
6、终止与收集:分别从供体室和受体室取一定体积的溶液,用LC-MS/MS、HPLC或免疫分析法检测浓度。
由上可知,平衡透析法的关键步骤在于装置、膜的选择、平衡时间的优化等三个方面。IPHASE作为体外研究生物试剂的引领者,为提供更好的服务,开发了普通平衡透析装置(HTD)和快速平衡透析装置(RED)两种,均配以纤维素膜,以期满足不同客户的多种需求。它们在原理上相似,但在实验设计、操作效率、适用性等方面存在差异,以下为两者详细对比:


简而言之,平衡透析法具有高准确性、适用于低结合率物质(游离浓度<1%)、无剪切力干扰及可同时处理多个样本(具有96孔板)等多个优点,但其也同时具备耗时长、样本需求量大、可能受膜吸附或体积位移影响及缓冲液成分可能影响蛋白结合等多个缺点。因此,客户需根据具体试验结合选择。
1.2 超滤法
超滤法(Ultrafiltration, UF)的核心原理是通过离心力驱动小分子游离分析物通过超滤膜,而大分子蛋白及结合物被截留。以下是超滤法的全面解析,包括原理、步骤、优缺点、优化策略及与平衡透析的对比。
【试验步骤】
1、样本类型:血浆或血清
2、样本预处理:3000×g, 10分钟,去除细胞碎片或纤维蛋白
3、加样:将100-200 μL血浆加入超滤离心管
4、离心:37℃ 2000-3000×g, 30分钟(需优化转速和时间,避免膜堵塞或结合物解离)
5、收集滤液:取滤液(通常10-50 μL)用于检测(LC-MS/MS、HPLC等)
作为快速经济测定游离浓度的方法之一,超滤法具有快速高效、使用样本量少、及操作简便等优点,但同样由于其装置的影响,超滤法存在着膜吸附、剪切力干扰及高结合药物灵敏度受限等不可忽视的缺点。因此,客户可根据自己的试验需求选择前处理技术,若需快速筛查或样本量有限,可优先选择超滤法;若需高精度数据,则应选择平衡透析法。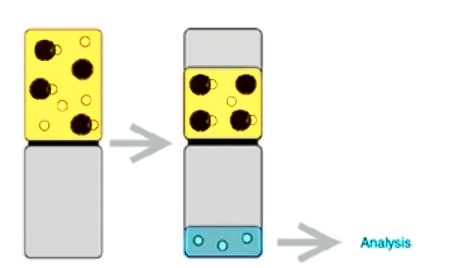
1.3 超速离心法
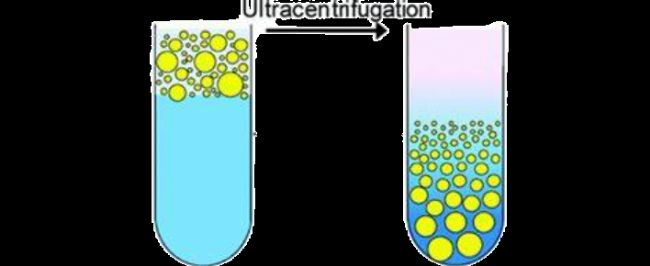
超速离心法(Ultracentrifugation, UC)是一种基于物理分离的技术,通过极高的离心力(通常 >100,000×g)将生物样本中的游离分析物与结合型分析物(如蛋白结合物)分离。该方法适用于血浆、血清、脑脊液等样本中游离药物、激素或代谢物的测定。其原理是依据在超高速离心条件下,由于分子大小和密度的差异,大分子(如蛋白质、蛋白结合型分析物)因分子量大、密度高而沉降到管底,而游离的小分子(未结合)则保留在上清液中。
【试验步骤】
1、样本类型:血清、血浆、组织样本
2、离心速度:100,000–150,000×g,速度过低可能导致结合物沉降不完全
3、离心时间:30min-2小时,时间过长可能导致游离分子吸附或降解
4、温度:4℃(推荐)或室温,低温减少蛋白变性和结合物解离
5、离心管类型:聚碳酸酯或超离心专用管,避免使用易吸附分析物的材质
6、收集滤液:小心吸取上清液(避免扰动沉淀),用于后续分析(如HPLC、LC-MS/MS);
若需测定结合型分析物,可溶解沉淀(如用缓冲液或有机溶剂)后检测。
超速离心法(Ultracentrifugation, UC)由于其不引入抗体、吸附剂等物质,具有无外源干扰、适用性强和样本兼容性强等3种优点,但由于其通过高速离心进行分离,亦存在潜在结合物解离、样本损伤多及硬件设施不满足试验等问题。因此,若实验条件允许,可结合超滤或平衡透析进行方法验证,确保数据可靠性。
综上所述,常见的游离浓度样本分析前处理技术包括平衡透析法(equilibrium dialysis,ED)、超滤法(Ultra-filtration,UF)和超速离心法(Ultracentrifugation,UC),它们有各自的适用范围和优缺点。因此,客户应结合实际情况以选择合适的方法进行游离浓度的获取。
综上所述,游离浓度的生物样本分析前处理主要有平衡透析法、超滤法和超速离心法等三种方法,作为体外研究生物试剂引领者,IPHASE可以给平衡透析前处理提供血浆蛋白结合试验平衡透析装置、一次性快速平衡透析板、可重复使用快速平衡透析板、快速平衡透析插件、平衡透析膜、血浆蛋白结合试验平衡透析装置封口膜、血浆蛋白结合试验平衡透析装置底座、特氟龙板和超滤管等多类产品。
关 于 我 们
汇智和源,致力于为创新药研发企业及生命科学研究机构提供高品质的生物试剂,IPHASE为公司核心品牌,品牌宗旨“Innovative Reagents For Innovative Research”。
游离药物浓度(Free Concentration)是指生物样本(如血浆、血清、组织液等)中未与蛋白质或其他大分子结合的游离态药物、激素、代谢物或其他小分子分析物的浓度。由于许多生物活性物质在体内会与蛋白质(如白蛋白、α₁-酸性糖蛋白、免疫球蛋白等)结合,只有游离部分才能发挥药理或生理活性,因此测定游离药物浓度(Free Concentration)在药代动力学(PK)、药效学(PD)、临床监测和生物分析样本前处理过程中具有重要意义。
一、游离浓度的前处理技术
在生物样本(如血液、尿液、组织等)中测定游离(未结合)药物、激素或其他分析物的浓度时,生物样本前处理步骤需确保目标物质的游离状态不被破坏,同时去除干扰物质。目前的游离药物浓度分析生物样品前处理技术有平衡透析法(equilibrium dialysis,ED)、超滤法(Ultra-filtration,UF)、超速离心法(Ultracentrifugation,UC)、凝胶过滤/尺寸排阻色谱(Size-Exclusion Chromatography, SEC)、固相萃取或免疫亲和纯化和化学或酶解处理(结合型释放后检测),但常用的是平衡透析法(equilibrium dialysis,ED)、超滤法(Ultra-filtration,UF)和超速离心法(Ultracentrifugation,UC),其中平衡透析法更是游离药物浓度生物样品前处理技术的金标准。
1.1 平衡透析法
平衡透析法(equilibrium dialysis,ED)是测定生物样本(如血浆、血清)中游离药物、激素或代谢物浓度的金标准方法,常用于血浆蛋白结合试验(Plasma Protein Binding, PPB),其核心原理是利用半透膜使游离小分子在样本与缓冲液之间达到平衡,而大分子结合物(如蛋白结合型药物)因无法透过膜被分离。
【试验步骤】
1、样本准备:血浆、血清、脑脊液或其它基质
2、透析装置:不锈钢特氟龙板平衡透析装置(HTD)或快速平衡透析装置(RED)
3、膜选择:纤维素膜
4、加样:供体室加入含药基质,受体室加入PBS
5、孵育:37℃,5% CO2培养箱培养4~24小时,根据装置决定孵育时间
6、终止与收集:分别从供体室和受体室取一定体积的溶液,用LC-MS/MS、HPLC或免疫分析法检测浓度。
由上可知,平衡透析法的关键步骤在于装置、膜的选择、平衡时间的优化等三个方面。IPHASE作为体外研究生物试剂的引领者,为提供更好的服务,开发了普通平衡透析装置(HTD)和快速平衡透析装置(RED)两种,均配以纤维素膜,以期满足不同客户的多种需求。它们在原理上相似,但在实验设计、操作效率、适用性等方面存在差异,以下为两者详细对比:
| 参数 | 平衡透析(HTD) | 快速平衡透析(RED) |
| 平衡时间 | 12~16小时 | 4-6小时 |
| 最低样本量 | 100~200 uL | 50~100 uL |
| 准确性 | 金标准 | 金标准 |
| 适用结合率范围 | 低至高(游离浓度0.1%~99%) | 中至高(游离浓度>0.5%更可靠) |
| 操作便捷性 | 需手动组装,步骤较多 | 商业化试剂盒,操作简便 |
| 高通量支持 | 是(96孔板) | 是(48孔板) |


简而言之,平衡透析法具有高准确性、适用于低结合率物质(游离浓度<1%)、无剪切力干扰及可同时处理多个样本(具有96孔板)等多个优点,但其也同时具备耗时长、样本需求量大、可能受膜吸附或体积位移影响及缓冲液成分可能影响蛋白结合等多个缺点。因此,客户需根据具体试验结合选择。
1.2 超滤法
超滤法(Ultrafiltration, UF)的核心原理是通过离心力驱动小分子游离分析物通过超滤膜,而大分子蛋白及结合物被截留。以下是超滤法的全面解析,包括原理、步骤、优缺点、优化策略及与平衡透析的对比。
【试验步骤】
1、样本类型:血浆或血清
2、样本预处理:3000×g, 10分钟,去除细胞碎片或纤维蛋白
3、加样:将100-200 μL血浆加入超滤离心管
4、离心:37℃ 2000-3000×g, 30分钟(需优化转速和时间,避免膜堵塞或结合物解离)
5、收集滤液:取滤液(通常10-50 μL)用于检测(LC-MS/MS、HPLC等)
作为快速经济测定游离浓度的方法之一,超滤法具有快速高效、使用样本量少、及操作简便等优点,但同样由于其装置的影响,超滤法存在着膜吸附、剪切力干扰及高结合药物灵敏度受限等不可忽视的缺点。因此,客户可根据自己的试验需求选择前处理技术,若需快速筛查或样本量有限,可优先选择超滤法;若需高精度数据,则应选择平衡透析法。

1.3 超速离心法
超速离心法(Ultracentrifugation, UC)是一种基于物理分离的技术,通过极高的离心力(通常 >100,000×g)将生物样本中的游离分析物与结合型分析物(如蛋白结合物)分离。该方法适用于血浆、血清、脑脊液等样本中游离药物、激素或代谢物的测定。其原理是依据在超高速离心条件下,由于分子大小和密度的差异,大分子(如蛋白质、蛋白结合型分析物)因分子量大、密度高而沉降到管底,而游离的小分子(未结合)则保留在上清液中。
【试验步骤】
1、样本类型:血清、血浆、组织样本
2、离心速度:100,000–150,000×g,速度过低可能导致结合物沉降不完全
3、离心时间:30min-2小时,时间过长可能导致游离分子吸附或降解
4、温度:4℃(推荐)或室温,低温减少蛋白变性和结合物解离
5、离心管类型:聚碳酸酯或超离心专用管,避免使用易吸附分析物的材质
6、收集滤液:小心吸取上清液(避免扰动沉淀),用于后续分析(如HPLC、LC-MS/MS);
若需测定结合型分析物,可溶解沉淀(如用缓冲液或有机溶剂)后检测。
超速离心法(Ultracentrifugation, UC)由于其不引入抗体、吸附剂等物质,具有无外源干扰、适用性强和样本兼容性强等3种优点,但由于其通过高速离心进行分离,亦存在潜在结合物解离、样本损伤多及硬件设施不满足试验等问题。因此,若实验条件允许,可结合超滤或平衡透析进行方法验证,确保数据可靠性。

综上所述,常见的游离浓度样本分析前处理技术包括平衡透析法(equilibrium dialysis,ED)、超滤法(Ultra-filtration,UF)和超速离心法(Ultracentrifugation,UC),它们有各自的适用范围和优缺点。因此,客户应结合实际情况以选择合适的方法进行游离浓度的获取。
| 参数 | 平衡透析(ED) | 超滤(UF) | 超速离心(UC) |
| 分离原理 | 扩散平衡 | 膜截留+离心力驱动 | 沉降速度差异 |
| 速度 | 慢(小时级) | 快(分钟级) | 中等(1-2小时) |
| 是否干扰平衡 | 几乎不干扰 | 可能干扰(浓差极化) | 可能干扰(高压/剪切力) |
| 样品量 | 微量(50-200 uL) | 中小量(100-500 uL) | 中大量(0.5-2 mL) |
| 适用场景 | 科研(结合常数测定) | 临床(快速检测) | 特殊体系(脂蛋白、纳米颗粒) |
| 成本 | 低(透析膜成本低) | 中(超滤管一次性) | 高(设备昂贵) |
综上所述,游离浓度的生物样本分析前处理主要有平衡透析法、超滤法和超速离心法等三种方法,作为体外研究生物试剂引领者,IPHASE可以给平衡透析前处理提供血浆蛋白结合试验平衡透析装置、一次性快速平衡透析板、可重复使用快速平衡透析板、快速平衡透析插件、平衡透析膜、血浆蛋白结合试验平衡透析装置封口膜、血浆蛋白结合试验平衡透析装置底座、特氟龙板和超滤管等多类产品。
| 名称 | 规格 |
| 血浆蛋白结合试验平衡透析装置 | 24/48/96孔 |
| 一次性快速平衡透析板 | 1 Plate,48 Wells |
| 可重复使用快速平衡透析板 | 1 Plate,48 Wells |
| 快速平衡透析插件10个,12-14kDa | 10 Inserts,12-14kDa |
| 快速平衡透析插件10个,8kDa | 10 Inserts,8kDa |
| 快速平衡透析插件50个,12-14kDa | 50 Inserts,12-14kDa |
| 快速平衡透析插件50个,8kDa | 50 Inserts,8kDa |
| 快速平衡透析装置48插管 | 48 Inserts,12-14kDa |
| 快速平衡透析装置48插管 | 48 Inserts,8kDa |
| 平衡透析膜 | 3.5kd,12-14kd,25kd,50kd |
| 血浆蛋白结合试验平衡透析装置封口膜 | 100 Sheets |
| 特氟龙板 | 96孔-9块,24孔-5块,48孔-7块 |
| 超滤管 | 0.5mL 10 kd/50支 |
| 血浆蛋白结合试验平衡透析装置底座 | 1个 |
关 于 我 们
汇智和源,致力于为创新药研发企业及生命科学研究机构提供高品质的生物试剂,IPHASE为公司核心品牌,品牌宗旨“Innovative Reagents For Innovative Research”。
相关文章
更多 >

