Amyloid β-Peptide的结构、作用机制及在科研中的应用
2025-05-12 来源:本站 点击次数:52
在神经科学与分子生物学研究领域,Amyloid β-Peptide (β-Amyloid ,β淀粉样蛋白,AbMole,M1555)始终是一个备受瞩目的焦点。Amyloid β-Peptide在阿尔茨海默症(Alzheimer's disease,AD)的发展过程中起到了重要作用,它也是研究神经退行性变化的重要靶点。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。

参考文献及鸣谢
Amyloid β-Peptide的结构与生理活性
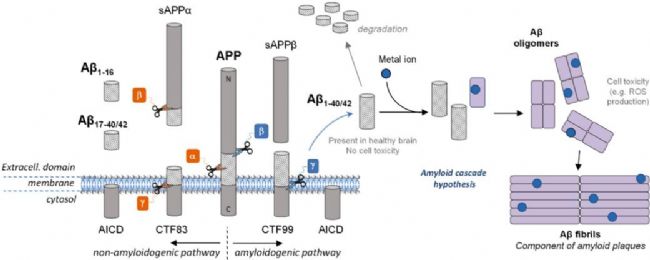
Amyloid β-Peptide(AbMole,M1555)是一种来源于淀粉样前体蛋白(Amyloid Precursor Protein,APP)的多肽。APP 是一种跨膜糖蛋白,广泛存在于多种细胞类型中。Amyloid β-Peptide(AbMole,M1555)的生成过程涉及一系列复杂的酶促反应,主要包括 β-分泌酶(β-secretase)和 γ-分泌酶(γ-secretase)对APP的连续切割。首先,β-分泌酶在 APP 的细胞外区域进行切割,产生一个较大的C-终端片段。随后,γ-分泌酶进一步作用于 CTF,最终释放出Amyloid β-Peptide肽段。这一生成过程受到多种因素的精细调控,包括细胞内信号通路、酶的活性以及细胞环境等。研究发现,Amyloid β-Peptide(β淀粉样蛋白,β-Amyloid)的生成水平在不同生理状态下存在差异,其生成的调控机制也成为当前研究的热点之一。

图1. Amyloid β-Peptide的切割和聚集示意图[1]
尽管 Amyloid β-Peptide(AbMole,M1555)在病理状态下与神经退行性变化密切相关,但在正常生理条件下,它也具有一些重要的生理功能。Amyloid β-Peptide可以参与调节神经细胞的生长、发育和突触可塑性。它能够与神经细胞表面的多种受体相互作用,影响神经细胞的信号传导过程。
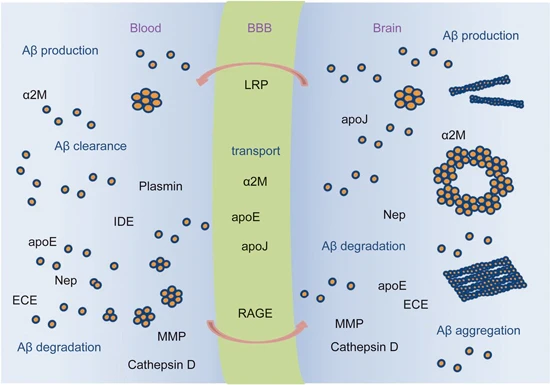
Amyloid β-Peptide(AbMole,M1555)可通过多种途径被清除,包括被蛋白酶 Neprilysin (Nep)、内皮素转换酶 (ECE)、胰岛素降解酶 (IDE)、纤溶酶和其他 Aβ 降解蛋白酶(MMP、组织蛋白酶 D)等降解,以及被小胶质细胞介导的途径清除(图1)[2]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。

图2. Amyloid β-Peptide的聚集、运输、降解和清除[2]。
Amyloid β-Peptide的聚集和神经退行性变化
Amyloid β-Peptide(AbMole,M1555)可以聚集形成淀粉样斑块(Amyloid plaques),上述聚集过程受到多种因素的影响,包括其自身的氨基酸序列、细胞外环境的 pH 值、离子浓度以及与其他蛋白质的相互作用等。研究表明,Amyloid β-Peptide的聚集过程是一个动态的过程,从单体状态到寡聚体状态,再到最终的纤维状结构,每一步都伴随着分子间相互作用的变化。Amyloid β-Peptide的聚集对神经细胞产生了一系列的毒性作用。它可以诱导神经细胞的氧化应激反应,产生大量的活性氧(ROS),导致细胞内的氧化还原平衡失调(图2)。此外,Amyloid β-Peptide的聚集还可以激活神经细胞内的多种信号通路,例如使Tau蛋白过度磷酸化并引起炎症反应,这可能导致神经元死亡。

图3. Amyloid β-Peptide聚集形成的淀粉样斑块诱导神经细胞的氧化应激[1]
Amyloid β-Peptide在科研中的应用
Amyloid β-Peptide(AbMole,M1555)在多个领域中有着广泛的应用。从基础分子机制研究到复杂的细胞与动物模型构建,再到生物标志物的开发,Amyloid β-Peptide都是不可或缺的工具。
1.Amyloid β-Peptide在细胞实验中的应用
在细胞水平上,Amyloid β-Peptide(AbMole,M1555)广泛应用于构建神经退行性疾病的细胞模型。通过向细胞培养基中添加 Amyloid β-Peptide,可以诱导神经细胞的氧化应激、炎症反应和细胞凋亡。这些细胞模型为研究Amyloid β-Peptide(β-Amyloid)的细胞毒性机制提供了直接的实验平台。例如,Amyloid β-Peptide能够下调抗凋亡蛋白bcl-2并上调促凋亡蛋白bax的表达,从而诱导神经细胞凋亡[3]。
2.动物模型研究中的应用
在动物实验中,Amyloid β-Peptide (AbMole,M1555)同样发挥着关键作用。Amyloid β-Peptide可作为动物实验造模剂使用,例如通过将 Amyloid β-Peptide注入动物大脑,可以诱导其在大脑中形成淀粉样斑块,构建阿尔茨海默症等神经退行性变化模型。这些动物模型为研究神经炎症反应、神经细胞死亡以及认知功能障碍提供了更为真实的实验平台[4]。上述方法相较于转基因动物而言,能够快速诱导局部的神经炎症反应和神经退行性变化,适合研究 Amyloid β-Peptide(β淀粉样蛋白)对特定脑区或神经环路的影响。
3.Amyloid β-Peptide作为生物标志物
Amyloid β-Peptide(AbMole,M1555)在生物标志物研究中也具有重要的应用。Amyloid β-Peptide(Aβ1-42)及其代谢产物在生物体液中的水平变化可作为神经退行性变化的潜在生物标志物。此外,Amyloid β-Peptide 的聚集状态和修饰形式也可作为生物标志物的候选指标。通过开发高灵敏度和高特异性的检测方法,研究人员可以更准确地检测 Amyloid β-Peptide 在聚集和修饰等方面的变化[5]。
4.结构分析和药物筛选
Amyloid β-Peptide(AbMole,M1555)是研究相关蛋白质折叠和聚集机制的重要模型。其氨基酸序列使其具有易于聚集的特性,这种聚集过程在分子水平上为研究蛋白质的构象变化提供了绝佳的样本。通过核磁共振(NMR)和冷冻电镜等技术,研究人员能够深入解析 Amyloid β-Peptide 的结构特征,揭示其从单体到寡聚体再到纤维状结构的转变机制[6]。Amyloid β-Peptide也可用于药物筛选,例如通过研究Amyloid β-Peptide的聚集或分解途径,科研人员已经开发出一些抗聚集剂[2]。此外,由于Amyloid β-Peptide(AbMole,M1555)可以诱导神经细胞的氧化应激、炎症反应、细胞凋亡,利用 Amyloid β-Peptide诱导的细胞和动物模型,研究人员可以筛选具有抗氧化、抗炎和抗凋亡作用的化合物,以评估其对 Amyloid β-Peptide 诱导的神经毒性的保护效果[7]。也有研究表明,Amyloid β-Peptide(β淀粉样蛋白)可以通过调节胆碱能系统来影响神经元的兴奋性和突触传递,这为开发针对胆碱能系统的抑制剂提供了基础[7]。
5.不同长度Amyloid β-Peptide的应用区别
不同长度的β-淀粉样蛋白(Amyloid β-Peptide,Aβ)在实验中表现出显著的差异,这些差异主要体现在聚集特性、结构稳定性、神经毒性以及在疾病模型中的作用等方面。以下是一些常见长度的Aβ肽在实验中的差别:
- Amyloid β-Protein 25-35(β-Amyloid 16-22,Aβ 25-35)
β-Amyloid 25-35(Amyloid β-Protein 25-35,Aβ 25-35,AbMole,M28442)是Aβ肽的一个关键片段,能够促进Aβ的聚集。它可以通过与完整的Aβ肽或其他片段相互作用,形成寡聚体和纤维。Aβ25-35在神经毒性方面表现出显著的作用,能够诱导神经元细胞内的钙离子稳态失衡,激活细胞内信号通路,导致细胞凋亡,Aβ25-35(AbMole,M28442)多用于细胞层面的实验研究。
- Amyloid β-Peptide 1-42(Aβ1-42)和Amyloid β-Peptide 1-40(Aβ1-40)
Amyloid β-Peptide (1-42)(β-Amyloid1-42,Aβ1-42,AbMole,M1555)比Amyloid β-Peptide (1-40)(β-Amyloid1-40,Aβ1-40,AbMole,M10194)更容易聚集。β-Amyloid1-42由于多出两个氨基酸(Ile-41和Ala-42),其疏水性和β-折叠倾向更强,因此更容易形成稳定的淀粉样纤维,导致Aβ1-42的神经毒性更强。Aβ1-42形成的寡聚体和纤维能够更有效地破坏神经元细胞,导致细胞内钙离子失衡和氧化应激,最终引起细胞死亡。Amyloid β-Peptide 1-42主要用于动物阿尔兹海默症的造模。
- Amyloid β-Peptide 16-22
Amyloid β-Peptide 16-22(β-Amyloid16-22,Aβ16-22,AbMole,M52460)是Aβ肽中富含疏水氨基酸的片段,这一部分在Aβ的聚集过程中起关键作用。Aβ16-22能够快速自组装形成寡聚体和纤维,且在疏水-亲水界面上的聚集能力更强。由于其较短且易于聚集的特性,因此更容易形成稳定的淀粉样纤维。在实验中,Aβ16-22常被用于模拟Aβ的早期聚集过程[8]。
范例详解
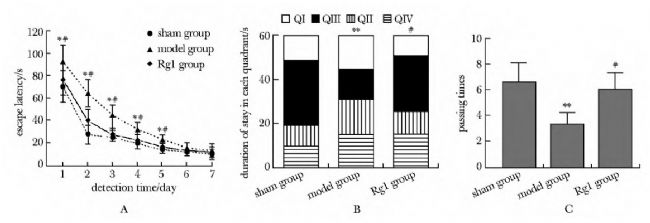
科研人员探究了三七皂苷Rg1(notoginsenoside Rg1)保护神经系统并抑制阿尔茨海默症(Alzheimer's disease,AD)的作用机制。实验人员对SD大鼠侧脑室注射了由AbMole提供的Amyloid β-Peptide(Aβ1-42,β淀粉样蛋白,AbMole,M1555)以构建AD大鼠模型,将大鼠随机分为3组(假手术组、模型组和三七皂苷Rg1治疗组)。Morris水迷宫实验(MWM)用于检测大鼠学习和记忆行为能力变化,化学比色法试剂盒检测大脑皮质丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性,免疫组织化学法检测大脑皮质中caspase-3蛋白含量,Western blot检测p38和p-p38蛋白表达水平。最终发现三七皂苷Rg1可显著改善AD模型大鼠的学习记忆能力,增加抗氧化能力,抑制神经细胞凋亡并起到神经系统保护作用。

图4. 水迷宫检测大鼠学习与记忆行为结果[8]

参考文献及鸣谢
[1] CHEIGNON C, TOMAS M, BONNEFONT-ROUSSELOT D, et al. Oxidative stress and the amyloid beta peptide in Alzheimer's disease [J]. Redox biology, 2018, 14: 450-64.
[2] CHEN G F, XU T H, YAN Y, et al. Amyloid beta: structure, biology and structure-based therapeutic development [J]. Acta pharmacologica Sinica, 2017, 38(9): 1205-35.
[3] PARADIS E, DOUILLARD H, KOUTROUMANIS M, et al. Amyloid beta peptide of Alzheimer's disease downregulates Bcl-2 and upregulates bax expression in human neurons [J]. The Journal of neuroscience : the official journal of the Society for Neuroscience, 1996, 16(23): 7533-9.
[4] FACCHINETTI R, BRONZUOLI M R, SCUDERI C. An Animal Model of Alzheimer Disease Based on the Intrahippocampal Injection of Amyloid β-Peptide (1-42) [J]. Methods in molecular biology (Clifton, NJ), 2018, 1727: 343-52.
[5] <β淀粉样蛋白生物标志物在阿尔茨海默病临床应用中的价值探讨.pdf> [J].
[6] GREMER L, SCHöLZEL D, SCHENK C, et al. Fibril structure of amyloid-β(1-42) by cryo-electron microscopy [J]. Science (New York, NY), 2017, 358(6359): 116-9.
[7] RICHTER K, OGIEMWONYI-SCHAEFER R, WILKER S, et al. Amyloid Beta Peptide (Aβ(1-42)) Reverses the Cholinergic Control of Monocytic IL-1β Release [J]. Journal of clinical medicine, 2020, 9(9).
[8] ITOH S G, OKUMURA H. Promotion and Inhibition of Amyloid-β Peptide Aggregation: Molecular Dynamics Studies [J]. International journal of molecular sciences, 2021, 22(4)
相关文章
更多 >

