单细胞力谱推动天然粘合剂纳米药物研发
2025-06-08 来源:本站 点击次数:772肿瘤免疫疗法已成为肿瘤治疗中有效的策略。然而,如何在肿瘤部位实现局部化、持久的免疫刺激,同时有效对抗肿瘤的免疫抑制环境,仍是当前科学家们亟待解决的关键问题。近日,浙江大学的研究团队在这一领域取得了突破性进展,创新性开发了一种基于天然贻贝粘附蛋白(NMPs)的纳米药物递送系统,并借助多功能单细胞显微操作技术- FluidFM,精确测量了纳米药物与细胞之间的粘附力,实时观察了纳米药物与细胞的相互作用过程,为持久性免疫疗法开辟了新路径。

高水平文献助力神器:多功能单细胞显微操作系统- FluidFM OMNIUM
该研究成果以“A natural adhesive-based nanomedicine initiates photothermal-directed in situ immunotherapy with durability and maintenance”为题,发表于Biomaterials上。
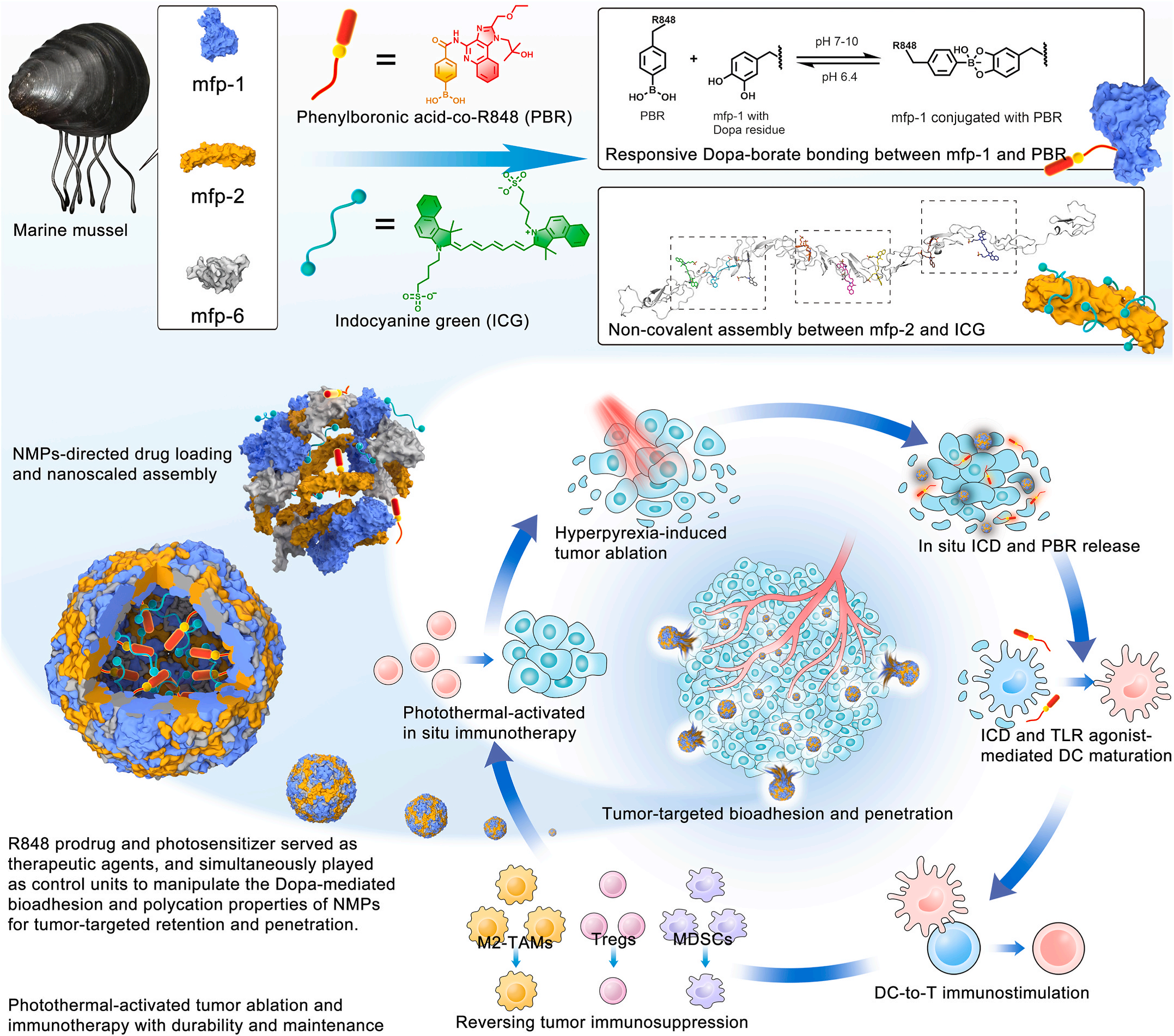
一、仿生粘附蛋白构建智能递送系统
研究团队从天然贻贝足蛋白中获取灵感,利用其富含的3,4-二羟基苯丙氨酸(Dopa)成分所具备的氧化氢键双重粘附机制,开发出具有超强粘附的NMPs材料,成为构建纳米药物递送系统的超绝选择。
研究团队运用动态键合和非共价组装技术,巧妙地把免疫佐剂前药和光敏剂“装进”了NMPs蛋白载体,构建了一种共递送纳米药物。这种纳米药物能借助NMPs的生物粘附特性,精准地把药物送到肿瘤部位,还能在特定时间和空间内控制药物释放,大大提高了治疗效果。
当这种纳米药物遇到近红外光,里面的光敏剂就会迅速产生光热效应,直接“烧死”肿瘤细胞,同时引发免疫原性细胞死亡(ICD)。这一过程不仅消灭了肿瘤细胞,还释放出大量肿瘤抗原和损伤相关分子模式(DAMPs)。这些物质就像“警报器”,激活了树突状细胞(DCs)等抗原呈递细胞,进而启动身体的适应性免疫应答,让免疫系统对肿瘤发起攻击。
二、调控免疫微环境,FluidFM显神通
这种纳米药物不仅能直接杀伤肿瘤细胞,还能调节肿瘤免疫微环境。它能把肿瘤里那些抑制免疫反应的细胞(比如肿瘤相关巨噬细胞TAMs)重新“编程”,让免疫系统更积极地对抗肿瘤。在这个过程中,FluidFM技术发挥了重要作用。
研究团队用FluidFM技术精确测量了纳米药物与细胞之间的粘附力,了解了纳米药物在不同条件下的粘附性能以及对细胞行为的影响。这为优化纳米药物的设计和性能提供了重要依据。除了粘附力的测量,FluidFM还能实时观察纳米药物与细胞的相互作用过程。通过这一前沿技术,研究人员发现纳米药物在酸性肿瘤微环境中会解离和碎片化,从而更好地渗透进肿瘤组织,延长在肿瘤里的停留时间。这一发现为纳米药物的进一步优化设计指明了方向。
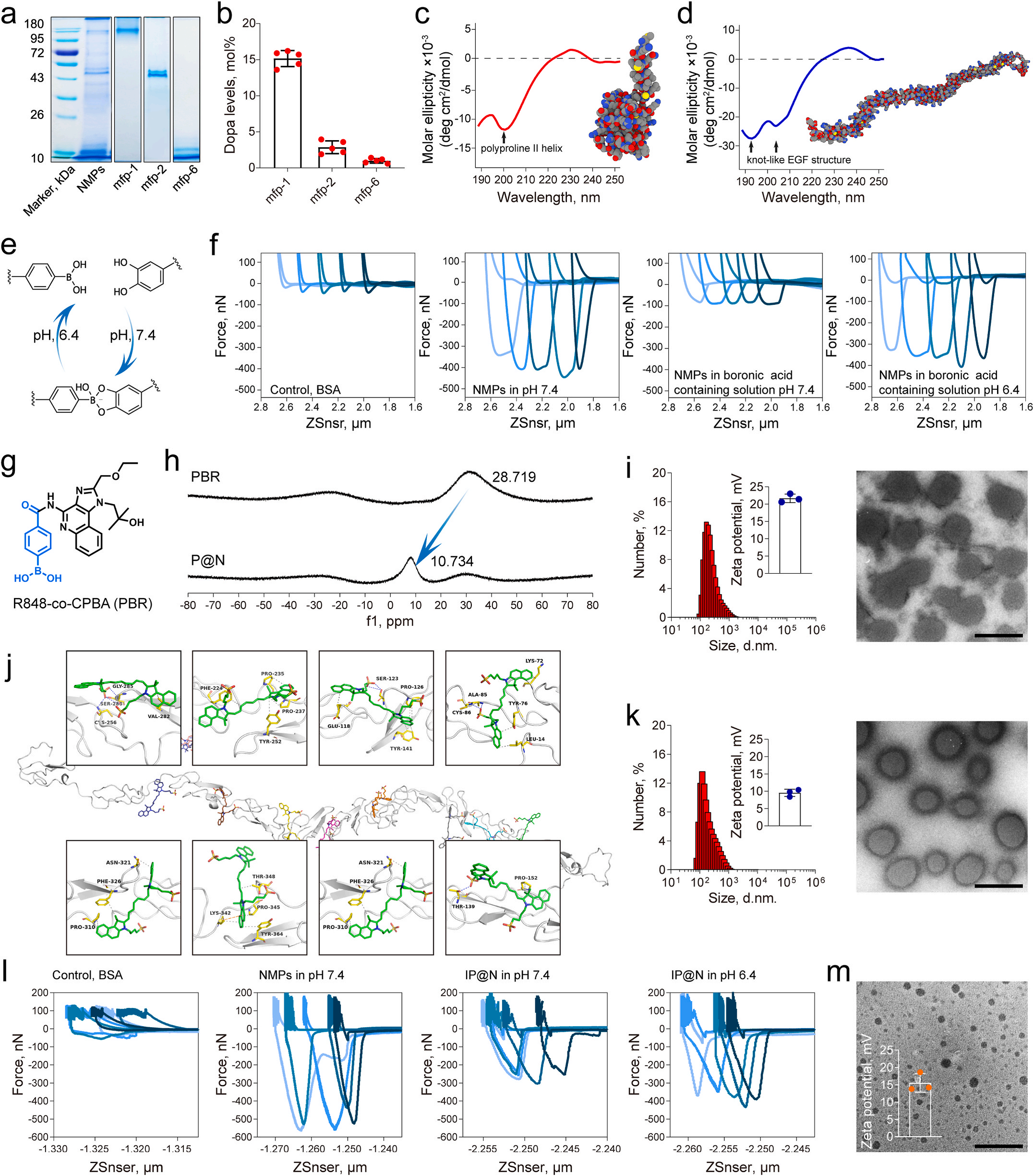
三、体内外实验验证卓越抗肿瘤效果
在体外实验阶段,研究团队借助FluidFM等前沿技术,对纳米药物的各项关键性能展开了细致评估,包括生物粘附性、光热转换效率以及免疫刺激活性。实验结果显示,这款纳米药物展现出了优异的性能。它能够显著推动树突状细胞(DC)走向成熟,让这些免疫系统的“哨兵”更好地识别和呈递肿瘤抗原;同时,它还能有效活化T细胞,增强免疫系统对肿瘤细胞的攻击能力。值得一提的是,纳米药物能够对肿瘤相关巨噬细胞(TAMs)进行重编程,让原本可能抑制免疫反应的TAMs“改邪归正”,转变为具有抗肿瘤功能的细胞,进一步增强了免疫系统对抗肿瘤的力量。
体内实验环节,研究团队将纳米药物通过静脉注射的方式送入实验动物体内。结果显示,该纳米药物就像安装了精准导航一样,能够特异性地靶向肿瘤部位,并且在肿瘤组织中长时间停留。在光热照射的配合下,纳米药物发挥出强大的威力,高效地消融了肿瘤组织。不仅如此,它还诱导产生了持久的抗肿瘤免疫应答,让免疫系统在肿瘤被消灭后依然保持警惕,防止肿瘤再次“卷土重来”。此外,借助FluidFM等技术的辅助观测,研究团队发现这款纳米药物在抑制肿瘤转移和术后复发方面同样表现出色,为肿瘤的综合治疗带来了新的希望。
四、FluidFM 技术的创新优势
FluidFM技术是瑞士Cytosurge公司将原子力系统、显微成像系统、微流控系统、活细胞培养系统融为一体,研发出了多功能单细胞显微操作系统-FluidFM OMNIUM。该系统可以轻松实现单个细胞水平、fL级别超高精度、全自动化的细胞操作。尤其是系统所具备的单细胞力谱功能,可在单细胞水平上提供高质量的力学数据,具有操作简单、适用细胞种类广、通量高、力学范围宽等优势。在本研究中,FluidFM技术发挥了不可或缺的作用,为纳米药物的研发和性能评估提供了关键支持。研究团队利用该技术深入了解了在不同条件下的生物粘附性能,包括在中性或酸性环境中的表现。这些数据对于优化纳米药物的设计至关重要,确保了其在生理环境中的稳定性和在肿瘤部位的特异性粘附。
FluidFM技术还用于实时观测纳米药物与细胞之间的相互作用过程。通过这一技术,研究团队发现在酸性肿瘤微环境中能够发生解离和碎片化,从而增强其在肿瘤组织中的渗透性和滞留时间。这一发现为纳米药物的优化设计提供了重要指导,有助于进一步提高其抗肿瘤效果。

