Gastrin-I(胃泌素)的作用机理及在类器官培养中的应用
2025-07-28 来源:本站 点击次数:4
类器官作为一种新兴的三维细胞培养模型,能够高度模拟体内器官的结构和功能。在类器官培养过程中,小分子调节剂和细胞因子发挥着关键作用,它们之间的不同组合可用于培养多种类器官。Gastrin-I(胃泌素,AbMole,M9320)作为一种重要的胆囊收缩素2受体(CCK2R)的选择性激动剂,对胃肠道、肝脏和多种肿瘤类器官的生长、发育及功能维持具有重要影响。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、Gastrin-I的作用机理
Gastrin-I(胃泌素,AbMole,M9320)是一种多肽类生物活性分子,Gastrin-I通过与CCK2R结合,激活细胞内信号通路,如提高细胞内Ca2+浓度、促进磷酸肌醇生成和蛋白激酶C激活。此外,Gastrin-I还参与胃上皮细胞的增殖和分化过程,刺激胃泌酸腺区黏膜和十二指肠黏膜的DNA、RNA及蛋白质合成,促进黏膜细胞的生长与增殖。
二、Gastrin-I用于类器官的培养
在胃类器官的培养过程中,Gastrin-I(胃泌素,AbMole,M9320)是培养基中的重要组分。研究表明,Gastrin-I能够通过其受体激活下游信号通路,从而促进胃上皮细胞的增殖和分化。例如,在一项研究中,Gastrin-I被添加到3D胃类器官的培养基中,浓度为1 nM,与其他生长因子如表皮生长因子(EGF)和成纤维细胞生长因子10(FGF10)协同作用,显著提高了类器官的形成效率和生长速度[1]。这种培养体系不仅能够模拟胃组织的生理结构,还为研究胃肠道疾病提供了理想的模型[1]。


在小肠和结肠类器官培养中,Gastrin-I 同样具有重要意义Gastrin-I(胃泌素,AbMole,M9320)能够促进结肠上皮细胞的增殖和分化,维持结肠类器官的稳定性和功能性。在结肠类器官的培养基中,Gastrin-I通常与TGF-β抑制剂如A 83-01(AbMole,M5037)、LY2157299(AbMole,M1980)和p38MAPK抑制剂如SB202190(AbMole,M2062)协同作用,以支持结肠干细胞的扩增和分化[3]。此外,Gastrin-I在小肠类器官的代谢功能中也具有重要作用,它能够调节小肠上皮细胞的吸收功能,促进营养物质的吸收和转运。这种调节作用对于维持小肠类器官的生理功能和稳定性至关重要[3]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
Gastrin-I(胃泌素,AbMole,M9320)在肝脏类器官培养中也是必不可少的成分之一。研究表明,Gastrin-I能够通过激活下游信号通路,从而促进肝细胞的增殖和分化。在肝脏类器官的培养基中,Gastrin-I通常与其他生长因子如EGF(AbMole,M10016)、FGF10(AbMole,M10353)和HGF(AbMole,M10352)协同作用,以支持肝脏干细胞的扩增和分化。例如,一项研究中提到,在肝脏类器官的培养基中添加10 nM的重组人Gastrin-I,能够显著提高类器官的形成效率和生长速度[4]。
Gastrin-I(胃泌素,AbMole,M9320)还被广泛用于多种肿瘤类器官的培养,包括胃癌、结肠癌、胰腺癌和肝癌等。为肿瘤类器官在疾病研究和药物筛选中的应用提供了重要的支持。
三、范例详解
AbMole是ChemBridge中国区官方指定合作伙伴。

参考文献及鸣谢
[1] Jayati Chakrabarti, Yana Zavros, Chapter 2 - Generation and use of gastric organoids for the study of Helicobacter pylori pathogenesis, in: J.R. Spence (Ed.), Methods in Cell Biology, Academic Press2020, pp. 23-46.
[2] C. Günther, B. Winner, M. F. Neurath, et al., Organoids in gastrointestinal diseases: from experimental models to clinical translation, Gut 71(9) (2022) 1892-1908.
[3] Antonio Barbáchano, Asunción Fernández-Barral, Pilar Bustamante-Madrid, et al., Organoids and Colorectal Cancer, 13(11) (2021) 2657.
[4] E. De Crignis, T. Hossain, S. Romal, et al., Application of human liver organoids as a patient-derived primary model for HBV infection and related hepatocellular carcinoma, eLife 10 (2021).
[5] Dianhui Wei, Lili Yuan, Xiaoli Xu, et al., Exploring epigenetic dynamics unveils a super-enhancer-mediated NDRG1-β-catenin axis in modulating gemcitabine resistance in pancreatic cancer, Cancer letters 605 (2024) 217284.
一、Gastrin-I的作用机理
Gastrin-I(胃泌素,AbMole,M9320)是一种多肽类生物活性分子,Gastrin-I通过与CCK2R结合,激活细胞内信号通路,如提高细胞内Ca2+浓度、促进磷酸肌醇生成和蛋白激酶C激活。此外,Gastrin-I还参与胃上皮细胞的增殖和分化过程,刺激胃泌酸腺区黏膜和十二指肠黏膜的DNA、RNA及蛋白质合成,促进黏膜细胞的生长与增殖。
二、Gastrin-I用于类器官的培养
在胃类器官的培养过程中,Gastrin-I(胃泌素,AbMole,M9320)是培养基中的重要组分。研究表明,Gastrin-I能够通过其受体激活下游信号通路,从而促进胃上皮细胞的增殖和分化。例如,在一项研究中,Gastrin-I被添加到3D胃类器官的培养基中,浓度为1 nM,与其他生长因子如表皮生长因子(EGF)和成纤维细胞生长因子10(FGF10)协同作用,显著提高了类器官的形成效率和生长速度[1]。这种培养体系不仅能够模拟胃组织的生理结构,还为研究胃肠道疾病提供了理想的模型[1]。


图 1. 胃和肠道类器官的构建[2]
在小肠和结肠类器官培养中,Gastrin-I 同样具有重要意义Gastrin-I(胃泌素,AbMole,M9320)能够促进结肠上皮细胞的增殖和分化,维持结肠类器官的稳定性和功能性。在结肠类器官的培养基中,Gastrin-I通常与TGF-β抑制剂如A 83-01(AbMole,M5037)、LY2157299(AbMole,M1980)和p38MAPK抑制剂如SB202190(AbMole,M2062)协同作用,以支持结肠干细胞的扩增和分化[3]。此外,Gastrin-I在小肠类器官的代谢功能中也具有重要作用,它能够调节小肠上皮细胞的吸收功能,促进营养物质的吸收和转运。这种调节作用对于维持小肠类器官的生理功能和稳定性至关重要[3]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
Gastrin-I(胃泌素,AbMole,M9320)在肝脏类器官培养中也是必不可少的成分之一。研究表明,Gastrin-I能够通过激活下游信号通路,从而促进肝细胞的增殖和分化。在肝脏类器官的培养基中,Gastrin-I通常与其他生长因子如EGF(AbMole,M10016)、FGF10(AbMole,M10353)和HGF(AbMole,M10352)协同作用,以支持肝脏干细胞的扩增和分化。例如,一项研究中提到,在肝脏类器官的培养基中添加10 nM的重组人Gastrin-I,能够显著提高类器官的形成效率和生长速度[4]。
Gastrin-I(胃泌素,AbMole,M9320)还被广泛用于多种肿瘤类器官的培养,包括胃癌、结肠癌、胰腺癌和肝癌等。为肿瘤类器官在疾病研究和药物筛选中的应用提供了重要的支持。
三、范例详解
上海交通大学、吉林大学的研究团队探索了胰腺导管腺癌(PDAC)在Gemcitabine耐药性发展过程中的动态表观遗传学变化,特别是超级增强子及其调控效应。研究使用了Gemcitabine耐药(Gem-R)的PDAC细胞系,并构建了类器官模型。实验人员还进行了高通量的表观基因组、增强子连接组和转录组分析。研究发现,在从Gemcitabine敏感到耐药的PDAC细胞转变过程中,表观遗传景观和基因组结构发生了显著变化。特别是超级增强子的激活状态表现出极大的可塑性,许多顺式元件在耐药细胞中被去激活。此外,研究还确定了NDRG1超级增强子(NDRG1-SE)是Gemcitabine耐药中一个关键的调控因子,NDRG1-SE的关闭诱导了WNT/β-catenin信号通路的激活,从而赋予了细胞对Gemcitabine的耐药[5]。在上述研究中,实验人员使用了由AbMole提供的多个产品:Gastrin I(胃泌素,AbMole,M9320)、Forskolin(AbMole,M2191)、Y-27632(AbMole,M1817)、A83-01(AbMole,M5037)、Dexamethasone(AbMole,M2176)、Prostaglandin E2(AbMole,M5929)、Nicotinamide(AbMole,M4896),并用于PDAC类器官的培养[5]。
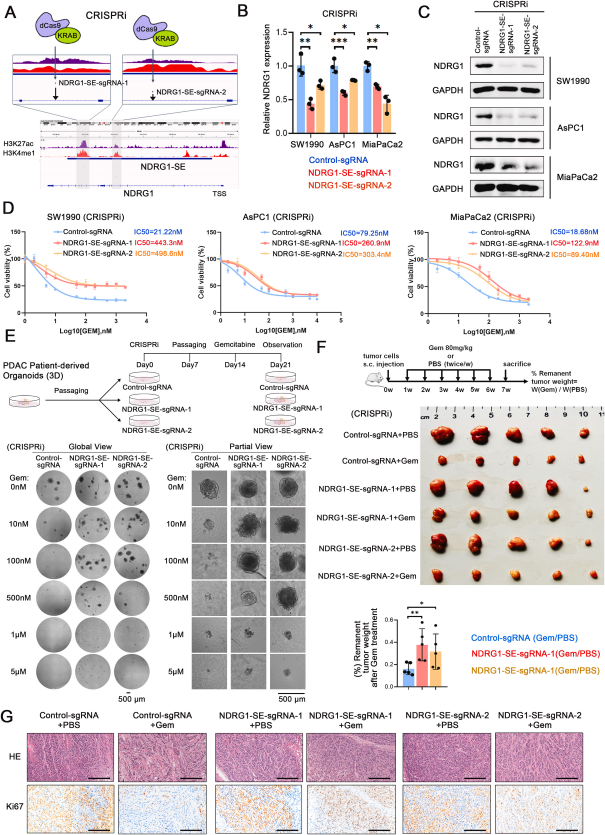



图 2. Induction of Chemoresistance to Gemcitabine by NDRG1 Super-Enhancer Deactivation[5]
AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] Jayati Chakrabarti, Yana Zavros, Chapter 2 - Generation and use of gastric organoids for the study of Helicobacter pylori pathogenesis, in: J.R. Spence (Ed.), Methods in Cell Biology, Academic Press2020, pp. 23-46.
[2] C. Günther, B. Winner, M. F. Neurath, et al., Organoids in gastrointestinal diseases: from experimental models to clinical translation, Gut 71(9) (2022) 1892-1908.
[3] Antonio Barbáchano, Asunción Fernández-Barral, Pilar Bustamante-Madrid, et al., Organoids and Colorectal Cancer, 13(11) (2021) 2657.
[4] E. De Crignis, T. Hossain, S. Romal, et al., Application of human liver organoids as a patient-derived primary model for HBV infection and related hepatocellular carcinoma, eLife 10 (2021).
[5] Dianhui Wei, Lili Yuan, Xiaoli Xu, et al., Exploring epigenetic dynamics unveils a super-enhancer-mediated NDRG1-β-catenin axis in modulating gemcitabine resistance in pancreatic cancer, Cancer letters 605 (2024) 217284.
相关文章
更多 >

