Verteporfin(维替泊芬)的结构、作用机理及在科研和疾病研究中的应用
2025-08-15 来源:本站 点击次数:64Verteporfin(维替泊芬,AbMole,M3539)是第二代卟啉类光敏剂,同时也是 YAP-TEAD相互作用的抑制剂。自其被发现以来,对Verteporfin的研究不断拓展,从最初用于眼科疾病的研究,逐渐深入到细胞生物学和肿瘤学等多个领域,例如对内质网应激和细胞自噬的调控。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、Verteporfin的结构和作用机理
1. Verteporfin作为光敏剂
Verteporfin(BPD-MA,AbMole,M3539)的分子骨架为苯基-卟啉环,可在689nm波长的激光照射下产生活性氧(ROS),可作为Photodynamic Therapy(PDT)的光敏剂。在PDT过程中,Verteporfin吸收激发光后,分子从基态跃迁到激发态。处于激发态的Verteporfin将电子转移给周围环境中的氧分子,因此可将基态氧分子催化为单线态氧(1O2)。单线态氧具有极高的化学活性,能够氧化细胞内的生物大分子,如脂质、蛋白质和核酸等,导致细胞损伤和死亡[1]。
2. Verteporfin高效抑制YAP-TEAD的相互作用
在非光照条件下,Verteporfin依然能够展现出生物学活性,这主要源于其分子结构与细胞内YAP-TEAD复合体的相互作用。YAP是Hippo通路的核心效应分子,可与TEAD形成转录激活复合体,上调CTGF、CYR61及CCN家族等基因,驱动细胞增殖、迁移及干性维持。Verteporfin(维替泊芬,AbMole,M3539)可以高效抑制YAP和TEAD之间的蛋白-蛋白相互作用。Verteporfin与YAP-TEAD复合体的结合位点位于TEAD的中央腔体中,它可与YAP的helix-turn-helix结构域竞争性结合TEAD的疏水部分,IC₅₀约1–2 µM[2]。

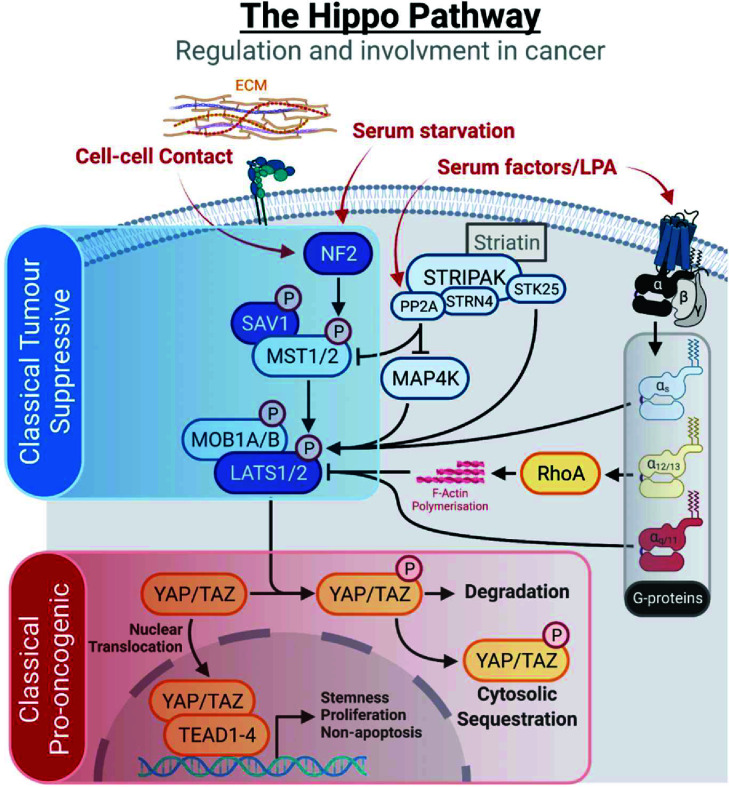 图1. Hippo-YAP信号通路促进细胞增殖和肿瘤形成[3]
图1. Hippo-YAP信号通路促进细胞增殖和肿瘤形成[3]
3. Verteporfin激活内质网应激相关的IRE1α通路
内质网是细胞内蛋白质折叠和加工的重要场所,当内质网的内环境稳态失衡,如未折叠或错误折叠蛋白质积累时,会引发未折叠蛋白反应(UPR)。IRE1α(Inositol-requiring enzyme 1α)是UPR的关键传感器之一。在正常情况下,IRE1α以单体形式存在于内质网膜上。当内质网应激发生时,IRE1α会发生二聚化或寡聚化,从而激活其激酶和核糖核酸酶(RNase)活性。Verteporfin(CL 318952,AbMole,M3539)能够起到类似分子胶的作用,直接诱导IRE1α二聚化与自磷酸化,激活后的IRE1α可引起UPR反应,包括切割XBP1u、降解内质网驻留mRNA、减轻翻译负荷并放大内质网应激信号[4]。
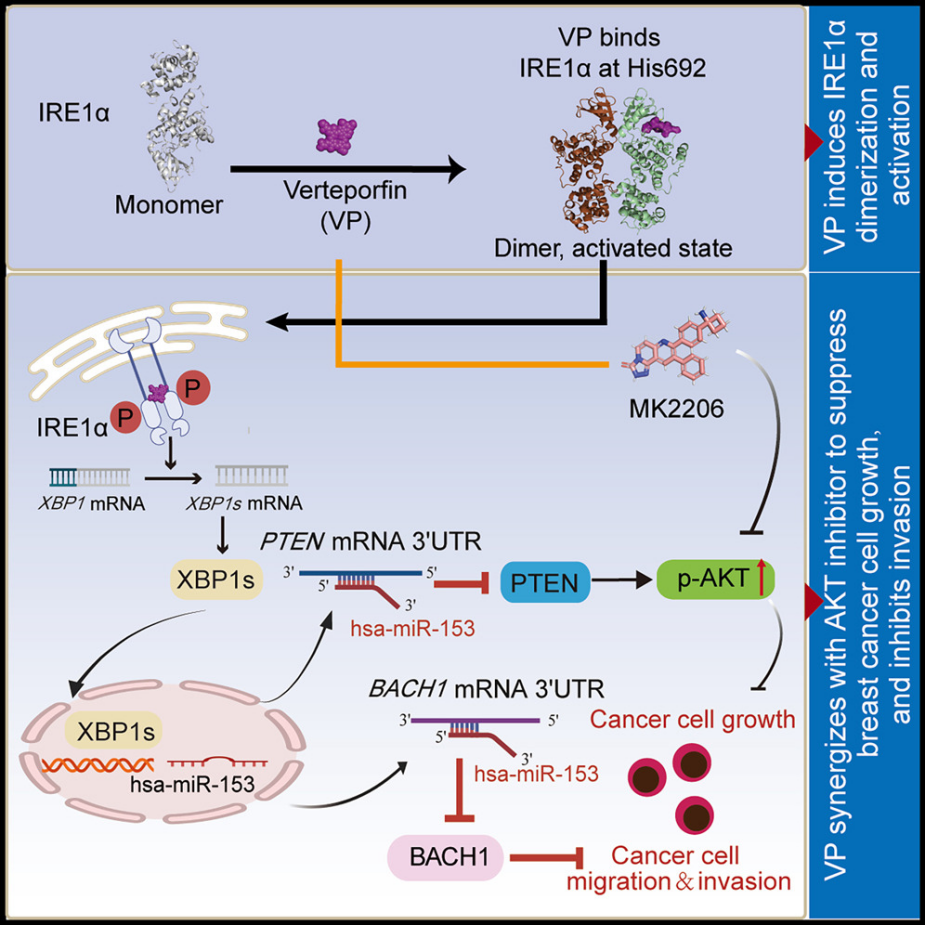

图2.Verteporfin诱导IRE1α并激活UPR抑制肿瘤细胞转移和侵袭[4]。
4. Verteporfin抑制自噬
Verteporfin(维替泊芬,AbMole,M3539)还是一种自噬抑制剂,其作用机制主要通过影响p62蛋白来实现。p62这是一种在自噬过程中起关键作用的支架和适配器蛋白。p62蛋白能够结合待降解的多泛素化蛋白以及自噬体膜上的LC3蛋白,从而促进目标蛋白被自噬体包裹并降解。研究发现Verteporfin及其在激光照射下产生的单线态氧均可共价交联p62,形成p62寡聚体并抑制其功能,因此对自噬起到抑制作用[5]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。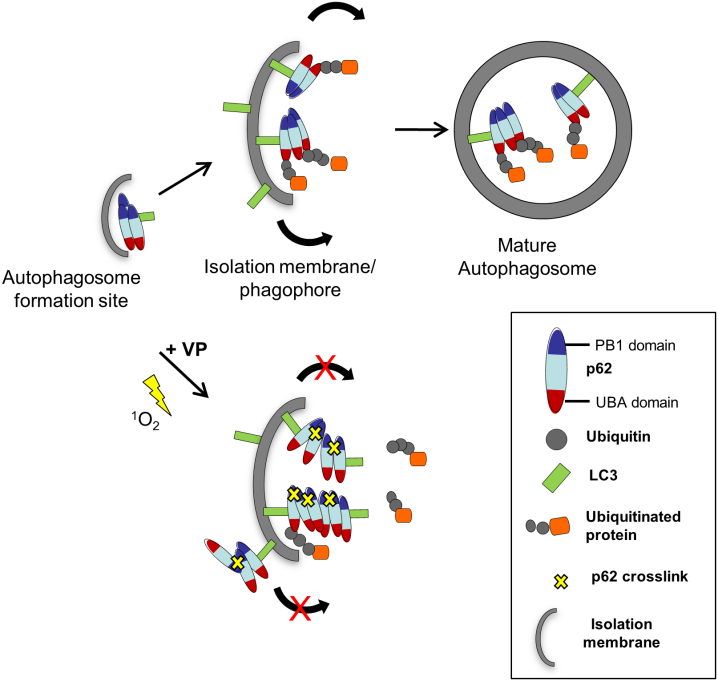

图3.维替泊芬介导的抑制p62交联产物自噬体形成的模型[5]。
二、Verteporfin的研究应用
1. Verteporfin用于眼部疾病研究
Verteporfin(维替泊芬,AbMole,M3539)在由血管增生导致的眼部疾病研究中具有重要的潜力。Verteporfin可用于动物模型(小鼠、大鼠等)的PDT,作为光敏剂产生ROS,进而破坏脉络膜新生血管(CNV)的内皮细胞,引发血管收缩、血栓形成,进而导致血管闭塞,抑制新生血管的生长,减少脉络膜血管的渗漏。Verteporfin还可联合人源化单抗如Bevacizumab进一步抑制上述动物模型中的眼部疾病进展[6]。
2. Verteporfin在肿瘤细胞中的生长抑制与PDT
在多种肿瘤细胞系中,Verteporfin(维替泊芬,AbMole,M3539)展现出明显的生长抑制作用。在视网膜母细胞瘤细胞中,通过抑制YAP-TEAD复合物,阻断相关下游促生长信号通路,抑制细胞增殖。在人胶质瘤细胞系(LN229和SNB19)中,Verteporfin处理后,YAP-TEAD相关下游信号分子下调,同时肿瘤生长抑制因子p38 MAPK上调,细胞生长受到抑制。在乳腺癌细胞MDA-MB-231、肝癌HepG2、肺癌A549等细胞系中,也观察到Verteporfin处理后细胞增殖受到不同程度抑制,并且与多种信号通路的调控改变相关[7]。
除了抑制YAP-TEAD复合物,Verteporfin(维替泊芬,AbMole,M3539)也可以通过PDT抑制肿瘤细胞。过量的活性氧可引起肿瘤细胞的氧化应激,造成线粒体损伤,并引发细胞色素c释放和激活Caspase级联反应,最终导致肿瘤细胞的凋亡。Verteporfin也可以作为装载对象被包裹或者负载于脂质体、介孔硅、金属有机框架(MOF)等纳米材料中,以增大在肿瘤部位的蓄积程度,或联合Photothermal Therapy(PTT)、Magnetic Hyperthermia Therapy(MHT)等方法协同抑制肿瘤生长[8]。
3. Verteporfin用于纤维化研究
Hippo-YAP信号通路在纤维化过程中起重要调控作用。YAP的异常激活会促进成纤维细胞的增殖和活化,增加细胞外基质的合成。Verteporfin(维替泊芬,AbMole,M3539)通过抑制YAP-TEAD复合物,显示出显著的抗纤维化作用。例如在博来霉素(Bleomycin)诱导的肺纤维化小鼠模型中,Verteporfin治疗显著减轻了纤维化病变。具体表现为小鼠体重变化率和肺系数降低,肺组织中胶原蛋白沉积减少,羟脯氨酸(HYP)、Ⅰ型胶原蛋白(Collagen Ⅰ)和α-平滑肌肌动蛋白(α-SMA)水平降低。


参考文献及鸣谢
[1] W. M. Chan, T. H. Lim, A. Pece, et al., Verteporfin PDT for non-standard indications--a review of current literature, Graefe's archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie 248(5) (2010) 613-26.
[2] J. Feng, J. Gou, J. Jia, et al., Verteporfin, a suppressor of YAP-TEAD complex, presents promising antitumor properties on ovarian cancer, OncoTargets and therapy 9 (2016) 5371-81.
[3] R. Cunningham, C. G. Hansen, The Hippo pathway in cancer: YAP/TAZ and TEAD as therapeutic targets in cancer, Clinical science (London, England : 1979) 136(3) (2022) 197-222.
[4] Y. Liu, H. Hua, Y. Cao, et al., Mechanism by which the molecular glue-like verteporfin induces IRE1α dimerization and activation to synergize with AKT inhibition in breast cancer, Cell chemical biology 32(6) (2025) 854-871.e6.
[5] Elizabeth Donohue, Aruna D Balgi, Masaaki Komatsu, et al., Induction of Covalently Crosslinked p62 Oligomers with Reduced Binding to Polyubiquitinated Proteins by the Autophagy Inhibitor Verteporfin, 9(12) (2014) e114964.
[6] Jing Yu Min, Yanan Lv, Lei Mao, et al., A rodent model of anterior ischemic optic neuropathy (AION) based on laser photoactivation of verteporfin, 18(1) (2018).
[7] Pina Fusco, Elena Mattiuzzo, Chiara Frasson, et al., Verteporfin induces apoptosis and reduces the stem cell-like properties in Neuroblastoma tumour-initiating cells through inhibition of the YAP/TAZ pathway, 893 (2021) 173829.
[8] A. Greco A, G. Garoffolo B, E. Chiesa C, et al., Nanotechnology, a booster for the multitarget drug Verteporfin, (2021).

