Pexidartinib在肿瘤免疫微环境、肿瘤抑制、神经免疫上的应用研究
2025-08-15 来源:本站 点击次数:55
Pexidartinib(PLX3397,AbMole,M4867)是一种口服小分子多靶点酪氨酸激酶抑制剂,通过选择性抑制集落刺激因子1受体(CSF1R)、干细胞因子受体(KIT)及FMS样酪氨酸激酶3内部串联重复突变(FLT3-ITD),在肿瘤免疫微环境调控、肿瘤抑制及神经免疫等交叉领域展现出独特作用。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、Pexidartinib(PLX3397)的作用机制
CSF-1R在多种细胞的生长、存活、分化及功能调节中发挥着关键作用。在正常生理状态下,CSF-1与其受体CSF-1R结合,激活下游一系列信号转导途径,包括RAS-MAPK、PI3K-AKT和 JAK-STAT 等通路,进而调控细胞的多种生物学行为。当Pexidartinib(PLX3397,AbMole,M4867)作用于细胞时,它能够与CSF-1R的ATP结合位点紧密结合,阻断ATP与受体的结合,从而抑制CSF-1R的磷酸化及后续的信号转导过程。在一些以巨噬细胞为研究对象的体外实验中,加入Pexidartinib后,巨噬细胞对CSF-1刺激的响应被削弱,表现为细胞增殖速度减缓,细胞周期相关蛋白的表达发生改变,这充分证明了Pexidartinib对CSF-1R信号通路的有效阻断[1]。 KIT和FLT3则在细胞的生长、分化及造血过程中扮演着重要角色。KIT信号通路的异常激活与多种细胞的异常增殖和分化相关,而FLT3的内部串联重复(ITD)突变在一些血液系统疾病中较为常见,会导致该信号通路的持续激活。Pexidartinib能够通过抑制KIT和FLT3的激酶活性,阻断其下游信号转导。用Pexidartinib处理FLT3突变的细胞系时发现,FLT3下游的STAT5磷酸化水平明显下降,细胞的增殖能力显著降低。在一些白血病细胞模型中,Pexidartinib能够抑制KIT和FLT3的活性,影响细胞内相关信号分子的磷酸化状态,进而诱导细胞凋亡或改变细胞的分化方向[2]。此外,Pexidartinib可以通过抑制KIT信号通路,减少相关细胞中BCL-2蛋白的表达,促进细胞凋亡的发生[2]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
二、Pexidartinib(PLX3397)的科研应用
1. Pexidartinib(PLX3397)用于调节肿瘤免疫微环境
肿瘤免疫微环境(Tumor Immune Microenvironment, TIME)是肿瘤组织内部及周围由免疫细胞、细胞因子、血管网络、细胞外基质等共同构成的动态生物环境,其核心特征是免疫抑制(促进肿瘤逃避免疫系统)、参与肿瘤的发生和转移。巨噬细胞在TIME中主要有两种形态,即具有抗肿瘤活性的M1型和促进肿瘤生长、转移及免疫逃逸的M2型。TIME中的CSF-1(集落刺激因子因子1)可促进免疫抑制性M2表型巨噬细胞的募集和分化。许多细胞实验表明,Pexidartinib(PLX3397,AbMole,M4867)能够有效抑制巨噬细胞向M2型极化,并降低肿瘤组织中M2型巨噬细胞的数量。Pexidartinib 处理后,M2型巨噬细胞相关基因如CD206、CCL-2 的 mRNA 表达下降,而M1型巨噬细胞相关基因如IL-1β、iNOS、CD80的 mRNA 表达相对增加。这些结果一致表明,Pexidartinib能够对肿瘤免疫微环境产生积极的调节作用[1]。
2. Pexidartinib(PLX3397)用于急性髓性白血病(AML)的研究
对于FLT3-ITD突变的急性髓性白血病(AML),研究发现FLT3-ITD阳性AML细胞能够极化M2样白血病相关巨噬细胞(M2-LAM),并抑制其吞噬活性,而M2-LAM 能通过激活FLT3信号通路保护 AML 细胞免受 FLT3抑制剂的影响。Pexidartinib https://www.abmole.cn/products/pexidartinib.html作为 FLT3/CSF1R 双重抑制剂,能够有效抑制M2-LAM,并延长MOLM-13小鼠模型的生存期。此外,也有研究构建了以FLT3配体为识别域的CAR-巨噬细胞,与Pexidartinib联合使用,在体外实验中,CAR-巨噬细胞能够有效吞噬MOLM-13细胞,这为 FLT3-ITD阳性AML 的抑制提供了一种新的、有前景的联合策略。Pexidartinib在其中发挥了关键的调节肿瘤微环境中巨噬细胞功能的作用,与 CAR-巨噬细胞治疗协同抑制AML细胞的生长[3]。
3. Pexidartinib(PLX3397)用于多种肿瘤的细胞和动物模型抑制研究
Pexidartinib(PLX3397,AbMole,M4867)在多种类型的肿瘤细胞中表现出了强大的抑制活性。例如在卵巢癌的研究中发现,CSF-1R高表达与肿瘤体积增大、淋巴结转移增多、以及小鼠生存期显著缩短密切相关。体外实验中,Pexidartinib能够有效抑制卵巢癌细胞的增殖,诱导细胞周期停滞在G1期,促进细胞凋亡,抑制克隆形成,减少细胞迁移和侵袭能力。在ID8卵巢癌小鼠模型中,Pexidartinib与紫杉醇联合使用,显著抑制了肿瘤生长,减少了腹水生成,并延长了小鼠的生存期[4]。在黑色素瘤小鼠模型中,Pexidartinib同样表现出良好的抗肿瘤效果:在B16F10小鼠黑色素瘤模型中,Pexidartinib能够减少免疫抑制性巨噬细胞在全身和肿瘤局部的积累[5]。在结直肠癌相关研究中,Pexidartinib 也显示出对肿瘤生长和转移的抑制作用,在小鼠结直肠癌腹膜内转移模型中,使用肿瘤微环境响应性靶向纳米颗粒共同递送表达IL-12基因和 Pexidartinib,实验组小鼠腹腔肿瘤重量最低,转移性结节显著减少[6]。除了上述细胞和动物模型外,Pexidartinib还能用于骨肉瘤、前列腺肿瘤细胞、结直肠癌等模型的研究[7]。
4. Pexidartinib (PLX3397)用于神经免疫学研究
神经免疫系统是中枢神经系统(CNS)维持稳态的核心调控网络,其异常激活与神经退行性疾病、神经创伤及神经肿瘤的发生发展密切相关。小胶质细胞作为 CNS 内的固有免疫细胞,通过动态调控炎症反应、突触修剪和神经修复,在神经免疫过程中扮演关键角色。集落刺激因子 1 受体(CSF-1R)信号通路在小胶质细胞的存活、增殖和极化中起决定性作用,而Pexidartinib(PLX3397,AbMole,M4867)作为高选择性CSF-1R酪氨酸激酶抑制剂,通过靶向该通路重塑神经免疫微环境,为神经免疫疾病的机制研究和干预策略提供了新视角[8]。
三、范例详解
Cancer Lett. 2022 Feb 28;527:174-190.
上海交通大学、南京医科大学的实验人员在上述研究中探讨了三阴性乳腺癌(TNBC)中的 Hippo/YAP 信号通路,及其对肿瘤免疫微环境的调控作用。研究发现Hippo通路与TNBC预后不良及免疫微环境高度相关,其关键分子TAZ的高表达会减少CD8阳性T细胞的浸润、增加肿瘤相关巨噬细胞(TAMs)浸润,形成免疫抑制微环境。在分子机制上,科研人员发现TAZ通过直接调控IL-34和PD-L1的转录,促进TAMs的增殖和迁移,同时抑制T细胞的免疫功能;此外,TAMs分泌的TGF-β1会反促 TAZ 表达,形成正反馈 loop,加剧肿瘤进展。研究团队还设计并验证了如下的抑制策略:通过将CSF-1R 抑制剂(Pexidartinib)与PD-L1 抗体联合使用,可显著减少TAMs浸润、增加CD8阳性T细胞的浸润,逆转免疫抑制微环境,协同抑制TNBC生长和转移。在上述实验中,科研人员使用了由AbMole提供的Pexidartinib(PLX3397,AbMole,M4867)[1]。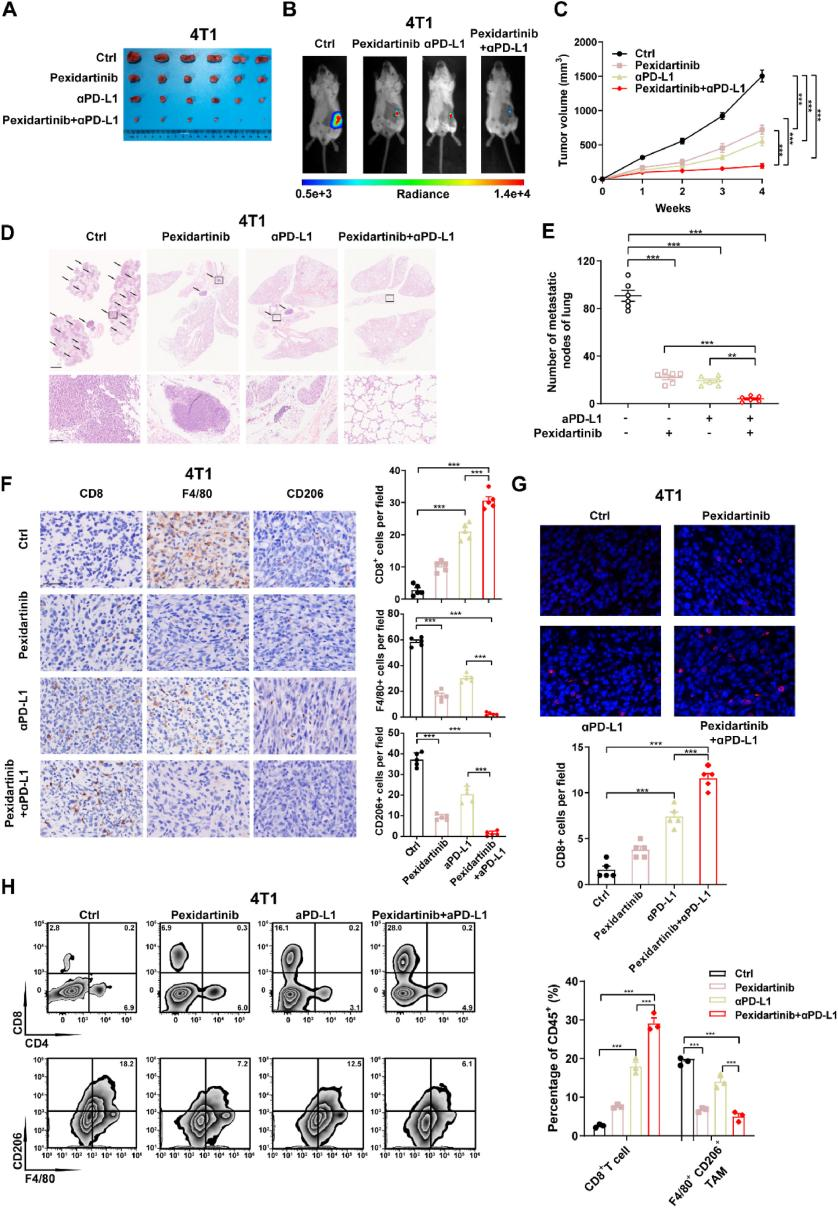

AbMole是ChemBridge中国区官方指定合作伙伴。

参考文献及鸣谢
[1] Z. Wang, F. Wang, X. Y. Ding, et al., Hippo/YAP signaling choreographs the tumor immune microenvironment to promote triple negative breast cancer progression via TAZ/IL-34 axis, Cancer letters 527 (2022) 174-190.
[2] A. P. Schade, D. A. Smith, L. M. Klinghoffer, et al., PLX3397, a novel CSF1R, KIT, and FLT3 inhibitor, is active in models of human acute myeloid leukemia, Leukemia 27 (2013) 2218-2227.
[3] J. H. Park, Y. J. Kim, S. H. Lee, et al., FLT3 ligand-targeted CAR-macrophages combined with PLX3397 enhance phagocytosis and anti-leukemic activity in FLT3-ITD+ AML, Blood advances 5 (2021) 3452-3465.
[4] Y. Liu, H. Zhang, X. Li, et al., CSF-1R inhibitor PLX3397 enhances paclitaxel efficacy in ovarian cancer by reprogramming tumor-associated macrophages, Journal of experimental & clinical cancer research 40 (2021) 324.
[5] S. A. Condeelis, J. M. Pollard, Macrophages and metastasis: implications for new cancer therapies, Nature reviews cancer 16 (2016) 709-723.
[6] X. Zhang, L. Chen, Y. Wang, et al., Tumor microenvironment-responsive nanoparticles co-delivering IL-12 plasmid and PLX3397 for combinatorial immunotherapy of colorectal cancer, Journal of controlled release 332 (2021) 600-613.
[7] W. D. Tap, H. Gelderblom, E. Palmerini, et al., Pexidartinib versus placebo for advanced tenosynovial giant cell tumour (ENLIVEN): a randomised phase 3 trial, Lancet 394 (2019) 478-487.
[8] M. A. Colonna, R. Butovsky, Microglia function in the central nervous system during health and neurodegeneration, Annual review of immunology 35 (2017) 441-468.
一、Pexidartinib(PLX3397)的作用机制
CSF-1R在多种细胞的生长、存活、分化及功能调节中发挥着关键作用。在正常生理状态下,CSF-1与其受体CSF-1R结合,激活下游一系列信号转导途径,包括RAS-MAPK、PI3K-AKT和 JAK-STAT 等通路,进而调控细胞的多种生物学行为。当Pexidartinib(PLX3397,AbMole,M4867)作用于细胞时,它能够与CSF-1R的ATP结合位点紧密结合,阻断ATP与受体的结合,从而抑制CSF-1R的磷酸化及后续的信号转导过程。在一些以巨噬细胞为研究对象的体外实验中,加入Pexidartinib后,巨噬细胞对CSF-1刺激的响应被削弱,表现为细胞增殖速度减缓,细胞周期相关蛋白的表达发生改变,这充分证明了Pexidartinib对CSF-1R信号通路的有效阻断[1]。 KIT和FLT3则在细胞的生长、分化及造血过程中扮演着重要角色。KIT信号通路的异常激活与多种细胞的异常增殖和分化相关,而FLT3的内部串联重复(ITD)突变在一些血液系统疾病中较为常见,会导致该信号通路的持续激活。Pexidartinib能够通过抑制KIT和FLT3的激酶活性,阻断其下游信号转导。用Pexidartinib处理FLT3突变的细胞系时发现,FLT3下游的STAT5磷酸化水平明显下降,细胞的增殖能力显著降低。在一些白血病细胞模型中,Pexidartinib能够抑制KIT和FLT3的活性,影响细胞内相关信号分子的磷酸化状态,进而诱导细胞凋亡或改变细胞的分化方向[2]。此外,Pexidartinib可以通过抑制KIT信号通路,减少相关细胞中BCL-2蛋白的表达,促进细胞凋亡的发生[2]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
二、Pexidartinib(PLX3397)的科研应用
1. Pexidartinib(PLX3397)用于调节肿瘤免疫微环境
肿瘤免疫微环境(Tumor Immune Microenvironment, TIME)是肿瘤组织内部及周围由免疫细胞、细胞因子、血管网络、细胞外基质等共同构成的动态生物环境,其核心特征是免疫抑制(促进肿瘤逃避免疫系统)、参与肿瘤的发生和转移。巨噬细胞在TIME中主要有两种形态,即具有抗肿瘤活性的M1型和促进肿瘤生长、转移及免疫逃逸的M2型。TIME中的CSF-1(集落刺激因子因子1)可促进免疫抑制性M2表型巨噬细胞的募集和分化。许多细胞实验表明,Pexidartinib(PLX3397,AbMole,M4867)能够有效抑制巨噬细胞向M2型极化,并降低肿瘤组织中M2型巨噬细胞的数量。Pexidartinib 处理后,M2型巨噬细胞相关基因如CD206、CCL-2 的 mRNA 表达下降,而M1型巨噬细胞相关基因如IL-1β、iNOS、CD80的 mRNA 表达相对增加。这些结果一致表明,Pexidartinib能够对肿瘤免疫微环境产生积极的调节作用[1]。
2. Pexidartinib(PLX3397)用于急性髓性白血病(AML)的研究
对于FLT3-ITD突变的急性髓性白血病(AML),研究发现FLT3-ITD阳性AML细胞能够极化M2样白血病相关巨噬细胞(M2-LAM),并抑制其吞噬活性,而M2-LAM 能通过激活FLT3信号通路保护 AML 细胞免受 FLT3抑制剂的影响。Pexidartinib https://www.abmole.cn/products/pexidartinib.html作为 FLT3/CSF1R 双重抑制剂,能够有效抑制M2-LAM,并延长MOLM-13小鼠模型的生存期。此外,也有研究构建了以FLT3配体为识别域的CAR-巨噬细胞,与Pexidartinib联合使用,在体外实验中,CAR-巨噬细胞能够有效吞噬MOLM-13细胞,这为 FLT3-ITD阳性AML 的抑制提供了一种新的、有前景的联合策略。Pexidartinib在其中发挥了关键的调节肿瘤微环境中巨噬细胞功能的作用,与 CAR-巨噬细胞治疗协同抑制AML细胞的生长[3]。
3. Pexidartinib(PLX3397)用于多种肿瘤的细胞和动物模型抑制研究
Pexidartinib(PLX3397,AbMole,M4867)在多种类型的肿瘤细胞中表现出了强大的抑制活性。例如在卵巢癌的研究中发现,CSF-1R高表达与肿瘤体积增大、淋巴结转移增多、以及小鼠生存期显著缩短密切相关。体外实验中,Pexidartinib能够有效抑制卵巢癌细胞的增殖,诱导细胞周期停滞在G1期,促进细胞凋亡,抑制克隆形成,减少细胞迁移和侵袭能力。在ID8卵巢癌小鼠模型中,Pexidartinib与紫杉醇联合使用,显著抑制了肿瘤生长,减少了腹水生成,并延长了小鼠的生存期[4]。在黑色素瘤小鼠模型中,Pexidartinib同样表现出良好的抗肿瘤效果:在B16F10小鼠黑色素瘤模型中,Pexidartinib能够减少免疫抑制性巨噬细胞在全身和肿瘤局部的积累[5]。在结直肠癌相关研究中,Pexidartinib 也显示出对肿瘤生长和转移的抑制作用,在小鼠结直肠癌腹膜内转移模型中,使用肿瘤微环境响应性靶向纳米颗粒共同递送表达IL-12基因和 Pexidartinib,实验组小鼠腹腔肿瘤重量最低,转移性结节显著减少[6]。除了上述细胞和动物模型外,Pexidartinib还能用于骨肉瘤、前列腺肿瘤细胞、结直肠癌等模型的研究[7]。
4. Pexidartinib (PLX3397)用于神经免疫学研究
神经免疫系统是中枢神经系统(CNS)维持稳态的核心调控网络,其异常激活与神经退行性疾病、神经创伤及神经肿瘤的发生发展密切相关。小胶质细胞作为 CNS 内的固有免疫细胞,通过动态调控炎症反应、突触修剪和神经修复,在神经免疫过程中扮演关键角色。集落刺激因子 1 受体(CSF-1R)信号通路在小胶质细胞的存活、增殖和极化中起决定性作用,而Pexidartinib(PLX3397,AbMole,M4867)作为高选择性CSF-1R酪氨酸激酶抑制剂,通过靶向该通路重塑神经免疫微环境,为神经免疫疾病的机制研究和干预策略提供了新视角[8]。
三、范例详解
Cancer Lett. 2022 Feb 28;527:174-190.
上海交通大学、南京医科大学的实验人员在上述研究中探讨了三阴性乳腺癌(TNBC)中的 Hippo/YAP 信号通路,及其对肿瘤免疫微环境的调控作用。研究发现Hippo通路与TNBC预后不良及免疫微环境高度相关,其关键分子TAZ的高表达会减少CD8阳性T细胞的浸润、增加肿瘤相关巨噬细胞(TAMs)浸润,形成免疫抑制微环境。在分子机制上,科研人员发现TAZ通过直接调控IL-34和PD-L1的转录,促进TAMs的增殖和迁移,同时抑制T细胞的免疫功能;此外,TAMs分泌的TGF-β1会反促 TAZ 表达,形成正反馈 loop,加剧肿瘤进展。研究团队还设计并验证了如下的抑制策略:通过将CSF-1R 抑制剂(Pexidartinib)与PD-L1 抗体联合使用,可显著减少TAMs浸润、增加CD8阳性T细胞的浸润,逆转免疫抑制微环境,协同抑制TNBC生长和转移。在上述实验中,科研人员使用了由AbMole提供的Pexidartinib(PLX3397,AbMole,M4867)[1]。


图 1. CSF-1R 阻断通过逆转免疫抑制肿瘤微环境使 TNBC 对PD-L1抗体敏感[1]
AbMole是ChemBridge中国区官方指定合作伙伴。

参考文献及鸣谢
[1] Z. Wang, F. Wang, X. Y. Ding, et al., Hippo/YAP signaling choreographs the tumor immune microenvironment to promote triple negative breast cancer progression via TAZ/IL-34 axis, Cancer letters 527 (2022) 174-190.
[2] A. P. Schade, D. A. Smith, L. M. Klinghoffer, et al., PLX3397, a novel CSF1R, KIT, and FLT3 inhibitor, is active in models of human acute myeloid leukemia, Leukemia 27 (2013) 2218-2227.
[3] J. H. Park, Y. J. Kim, S. H. Lee, et al., FLT3 ligand-targeted CAR-macrophages combined with PLX3397 enhance phagocytosis and anti-leukemic activity in FLT3-ITD+ AML, Blood advances 5 (2021) 3452-3465.
[4] Y. Liu, H. Zhang, X. Li, et al., CSF-1R inhibitor PLX3397 enhances paclitaxel efficacy in ovarian cancer by reprogramming tumor-associated macrophages, Journal of experimental & clinical cancer research 40 (2021) 324.
[5] S. A. Condeelis, J. M. Pollard, Macrophages and metastasis: implications for new cancer therapies, Nature reviews cancer 16 (2016) 709-723.
[6] X. Zhang, L. Chen, Y. Wang, et al., Tumor microenvironment-responsive nanoparticles co-delivering IL-12 plasmid and PLX3397 for combinatorial immunotherapy of colorectal cancer, Journal of controlled release 332 (2021) 600-613.
[7] W. D. Tap, H. Gelderblom, E. Palmerini, et al., Pexidartinib versus placebo for advanced tenosynovial giant cell tumour (ENLIVEN): a randomised phase 3 trial, Lancet 394 (2019) 478-487.
[8] M. A. Colonna, R. Butovsky, Microglia function in the central nervous system during health and neurodegeneration, Annual review of immunology 35 (2017) 441-468.
相关文章
更多 >

