抵抗素诱导巨噬细胞与平滑肌细胞共培养体系中细胞从增殖向凋亡转变
2025-09-23 来源:本站 点击次数:59动脉粥样硬化性心血管疾病中,斑块不稳定性是导致中风、心肌梗死等临床事件的关键原因。其核心在于斑块易损性,而纤维帽变薄、坏死核心形成、炎性巨噬细胞浸润增加及大量凋亡细胞构成的坏死核心,均会提升斑块易损性,其中冠状动脉和颈动脉的薄帽斑块更易破裂。血管平滑肌细胞和巨噬细胞是斑块发展的主要细胞。血管平滑肌细胞通过迁移、增殖和产生基质促进内膜增厚与纤维帽形成。巨噬细胞可在促炎的 M1 型和修复性的 M2 型间转换,且 M1 型在易破裂斑块区域更常见。
抵抗素是一种由巨噬细胞分泌的促炎脂肪因子,研究发现其与颈动脉手术患者的炎症增强相关,且体外实验显示抵抗素可促使巨噬细胞向 M1 样表型转化、诱导血管平滑肌细胞功能障碍。PKCε 作为抵抗素作用的重要上游调节因子,会介导下游信号加剧细胞功能障碍和炎症。
基于此,美国帕洛阿尔托医疗保健系统血管外科的研究团队探讨了在细胞间存在通讯与相互作用的情况下,生理水平的抵抗素对血管平滑肌细胞和巨噬细胞的影响。研究采用间接和直接共培养模型,分别考察细胞分泌物和直接细胞接触条件下抵抗素的作用,并聚焦于与斑块稳定性相关的细胞增殖、炎症反应及细胞死亡等方面。研究成果发表在Surgery期刊,题为“Physiological levels of resistin induce a shift from proliferation to apoptosis in macrophage and VSMC co-culture”。

首先,研究人员发现在间接共培养体系中,未处理的巨噬细胞条件培养基对血管平滑肌细胞(VSMC)增殖有轻微促进作用,而经抵抗素处理的巨噬细胞条件培养基的促进作用更明显(图 1)。抵抗素处理能显著增强 VSMC 增殖,且若提前用 εV1-2 抑制巨噬细胞中的 PKCε,这种增殖促进效应会减弱(p<0.05)。
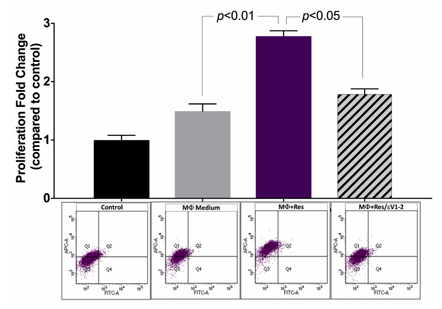
图1 间接共培养可促进 VSMC 增殖,且抵抗素通过PKCε 进一步增强该增殖作用
为了进一步研究巨噬细胞分泌物对 VSMCs的影响,研究人员通过检测增殖标志物(PCNA、cyclin D1)和炎症指标(NFκB-2)的基因表达发现,经抵抗素处理的巨噬细胞条件培养基可显著上调 VSMCs 中上述标志物的表达(图 2A和B),而抑制 PKCε 可减弱这些效应,使基因表达回到接近对照组的水平。

图2 巨噬细胞分泌物上调 VSMCs 中增殖和炎症标志物的基因表达
接下来,研究人员直接共培养中巨噬细胞与血管平滑肌细胞的不同比例。结果显示,未处理的巨噬细胞能促进体系增殖,其中血管平滑肌细胞:巨噬细胞为 1:4 时增殖显著增加,1:6 时趋于稳定(图 3A),故后续实验选用 1:4 比例。向该体系加入抵抗素后,24 小时和 48 小时增殖细胞数量逐渐减少,凋亡细胞数量增加,且这种从增殖向凋亡的转变由 PKCε 介导(图 3B–C)。
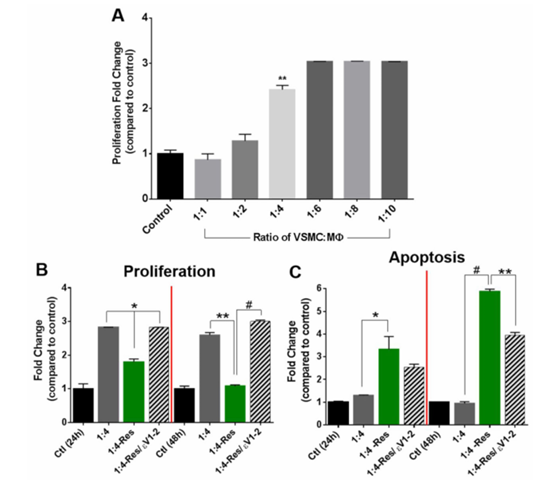
图3 直接共培养可刺激细胞增殖,但抵抗素会诱导细胞向凋亡转化。
最后,为了进一步研究直接细胞间相互作用下抵抗素对细胞状态的影响,研究人员将细胞与抵抗素共培养 48 小时后,对增殖标志物、炎症标志物及凋亡标志物的基因表达情况进行了分析,结果发现,抵抗素处理使共培养体系在转录水平呈现从增殖向凋亡的转变:48 小时后增殖标志物基因表达无变化(图 4A),炎症标志物表达与间接共培养类似(图 4B)。但凋亡标志物 caspase 3 和 caspase 8 表达上调(图 4C),且 PKCε 在该转变中的作用得到进一步确认。
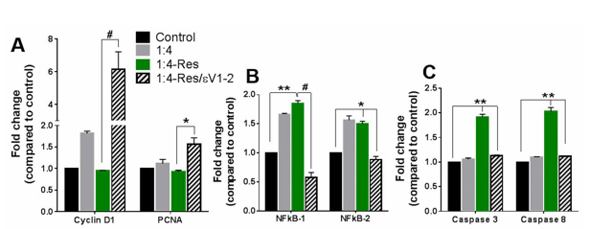
图4 直接的细胞间相互作用使抵抗素能够上调凋亡标志物。
总之,该研究表明,在细胞组成接近斑块易损区域的血管平滑肌细胞与巨噬细胞共培养体系中,抵抗素会促使细胞从增殖转向凋亡,而这一过程由 PKCε 介导。这意味着 PKCε 可能成为治疗抵抗素相关动脉粥样硬化并发症的潜在靶点。
参考文献:Zuniga MC, Raghuraman G, Zhou W. Physiologic levels of resistin induce a shift from proliferation to apoptosis in macrophage and VSMC co-culture. Surgery. 2018 Apr;163(4):906-911. doi: 10.1016/j.surg.2017.10.051. Epub 2018 Feb 1. PMID: 29361366; PMCID: PMC5857465.
原文链接:https://pubmed.ncbi.nlm.nih.gov/29361366/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:仿生多细胞动态共培养系统

